深圳泽医原代细胞生物技术有限公司
2 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
2025年诺贝尔奖揭秘:免疫细胞如何成为人体“区分敌我”的武器
140 人阅读发布时间:2025-10-16 11:03

2025年诺贝尔生理学或医学奖的揭晓,将全球科学界的目光聚焦于人体免疫系统的核心奥秘——细胞如何精准区分敌我。美国科学家玛丽·布伦科、弗雷德·拉姆斯迪尔与日本科学家坂口志文,因发现免疫系统的“安全卫士”调节性T细胞(Treg)及其调控机制,共同摘得这一殊荣。他们的研究不仅颠覆了传统免疫学认知,更为癌症、自身免疫疾病的治疗开辟了全新路径。
免疫系统的“双重防线”:
中枢与外周耐受
人体免疫系统每天需应对数以万计的病原体入侵,同时避免误伤自身组织。这一精密平衡依赖于两道防线:
-
中枢耐受:在胸腺和骨髓中,未成熟的免疫细胞(如T细胞、B细胞)通过基因重组生成多样化受体,随后经历“自我筛查”——凡能识别自身抗原的细胞均被清除。这一过程如同“军事训练营”,确保释放到外周的免疫细胞仅针对“非己”目标。
-
外周耐受:尽管中枢耐受效率高达60%-70%,仍有部分“漏网之鱼”进入外周组织。此时,调节性T细胞(Treg)作为第二道防线登场,通过抑制过度活跃的免疫反应,防止自身免疫疾病的发生。
Treg细胞:
免疫系统的“刹车机制”
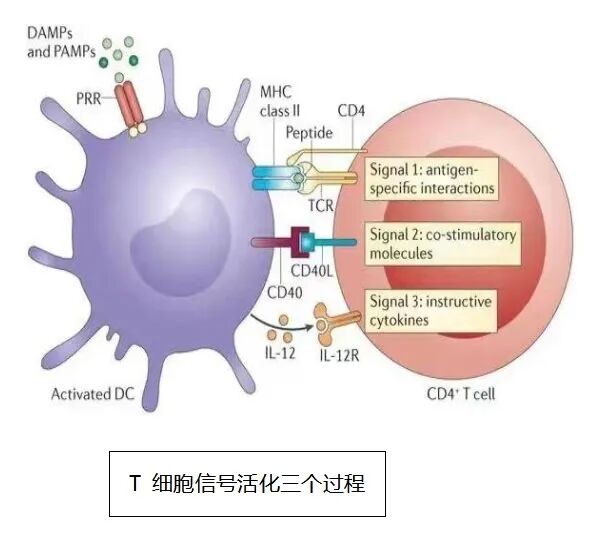
坂口志文教授在1995年的突破性发现,彻底改变了免疫学格局。他通过实验证实,存在一类表面携带CD25分子的T细胞亚群,能够主动抑制其他免疫细胞的攻击行为,并将其命名为调节性T细胞(Treg)。这一发现解决了长期困扰学界的谜题:为何中枢耐受后,人体仍能避免广泛自身免疫反应?
关键证据链:
-
基因突变与疾病关联:布伦科与拉姆斯迪尔在研究scurfy小鼠时,发现其X染色体上的Foxp3基因突变会导致致命性自身免疫病。进一步研究显示,人类中类似的IPEX综合征(免疫失调-多内分泌腺病-肠病-X连锁综合征)亦由Foxp3基因缺陷引起。
-
Treg的核心调控作用:坂口志文团队证明,Foxp3基因是Treg细胞发育与功能的主控基因。缺乏Foxp3的Treg细胞无法履行“免疫刹车”职责,导致免疫系统失控。
从基础到临床:
Treg疗法的革命性潜力
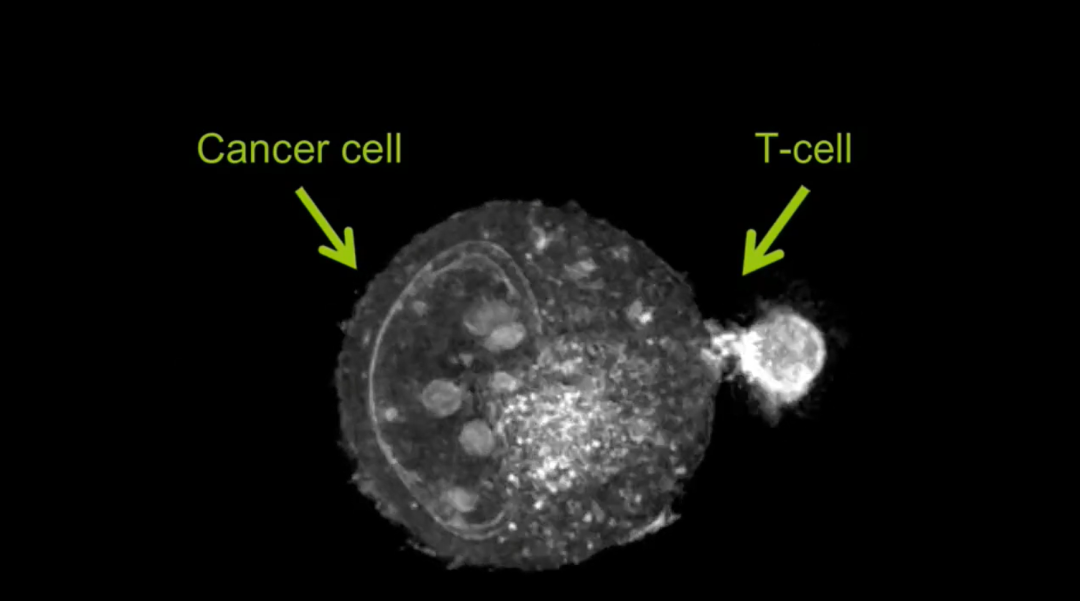
三位科学家的发现不仅深化了理论认知,更直接推动了医学实践的革新:
-
自身免疫疾病治疗:通过扩增患者体内Treg细胞或注射白细胞介素-2(IL-2)促进其生成,可有效缓解1型糖尿病、类风湿关节炎等疾病。例如,针对红斑狼疮的临床试验已显示初步疗效。
-
癌症免疫治疗:肿瘤微环境常招募大量Treg细胞以逃避免疫攻击。研发靶向Treg的抑制剂(如抗CTLA-4抗体)或通过CAR-Treg技术改造Treg细胞,可增强免疫系统对肿瘤的识别与清除。
-
器官移植耐受:调节Treg细胞活性可降低移植排斥反应,提高手术成功率。目前,相关疗法已进入临床试验阶段。
科学启示:
复杂系统的平衡之美
诺贝尔奖委员会主席欧莱·卡珀指出,Treg细胞的发现揭示了生命系统的本质——通过多层次调控实现动态平衡。正如社会需要法律与道德的双重约束,免疫系统依赖中枢与外周耐受的协同作用,才能精准区分敌我。这一原理不仅适用于生物学,也为人工智能、复杂网络管理等跨学科领域提供了哲学启示。
2025年诺贝尔奖的授予,是对免疫学基础研究价值的最高肯定。从胸腺中的“自我筛查”到外周的“免疫调解”,Treg细胞如同训练有素的“和平使者”,在微观世界中维护着生命的和谐。随着基因编辑、细胞治疗等技术的突破,人类正逐步掌握调控免疫系统的钥匙,为攻克癌症、自身免疫疾病等顽疾带来前suo未有的希望。这场由细胞引领的医学革命,才刚刚拉开序幕。