广州艾迪基因科技有限责任公司
5 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
超详细!一文带你了解多种单细胞CRISPR筛选方法!
1009 人阅读发布时间:2024-03-28 17:24
一、传统CRISPR 文库筛选技术
自从CRISPR文库筛选技术出现以后,以高通量的方式建立基因与表型的确定关系,成为大规模的基因筛选的最佳方案。传统的CRISPR 筛选技术,根据研究目的,合成靶向不同基因的sgRNA(single guide RNA, sgRNA),以慢病毒作为载体,将基因编辑系统转导至筛选细胞中,获得不同编辑事件的细胞混合库。经筛选培养后再根据特定表型将细胞富集。扩增富集细胞中的sgRNA序列,便能筛选出与该表型相关的基因。传统的CRISPR筛选技术已经在高通量筛选目的基因和寻找药物靶点等方面广泛应用。
二、单细胞CRISPR筛选的原理
传统的CRISPR筛选仅仅知道筛选得到的候选基因与该表型相关,却无法得知该基因的调控网络。当我们想筛选产生表型的目的基因,并且还想知道每个目的基因对其他信号通路的影响,单细胞CRISPR筛选是一个很好的解决方案。
单细胞CRISPR筛选是基于CRISPR筛选的单细胞转录组测序技术,对CRISPR筛选文库进行单细胞测序,获得了单个细胞的sgRNA信息和转录组数据信息,再通过sgRNA在文库中的索引(indexes)来确定表型与相关扰动基因的对应关系。该测序的要点在于建立sgRNA与转录组数据的对应关系,基于这样的测序思路,已经开发出多种测序技术。比如Perturb-Seq、CRISP-Seq、CROP-Seq(CRISPR droplet sequencing)和Direct capture PerturbSeq等。
这些技术能够以单细胞的分辨率进行检测,直接建立sgRNA与其他基因表达谱和表型之间的关系。相比于传统CRISPR筛选技术或单个基因编辑细胞模型,具有更高的验证效率。下面对这些经典的单细胞CRISPR筛选进行介绍。
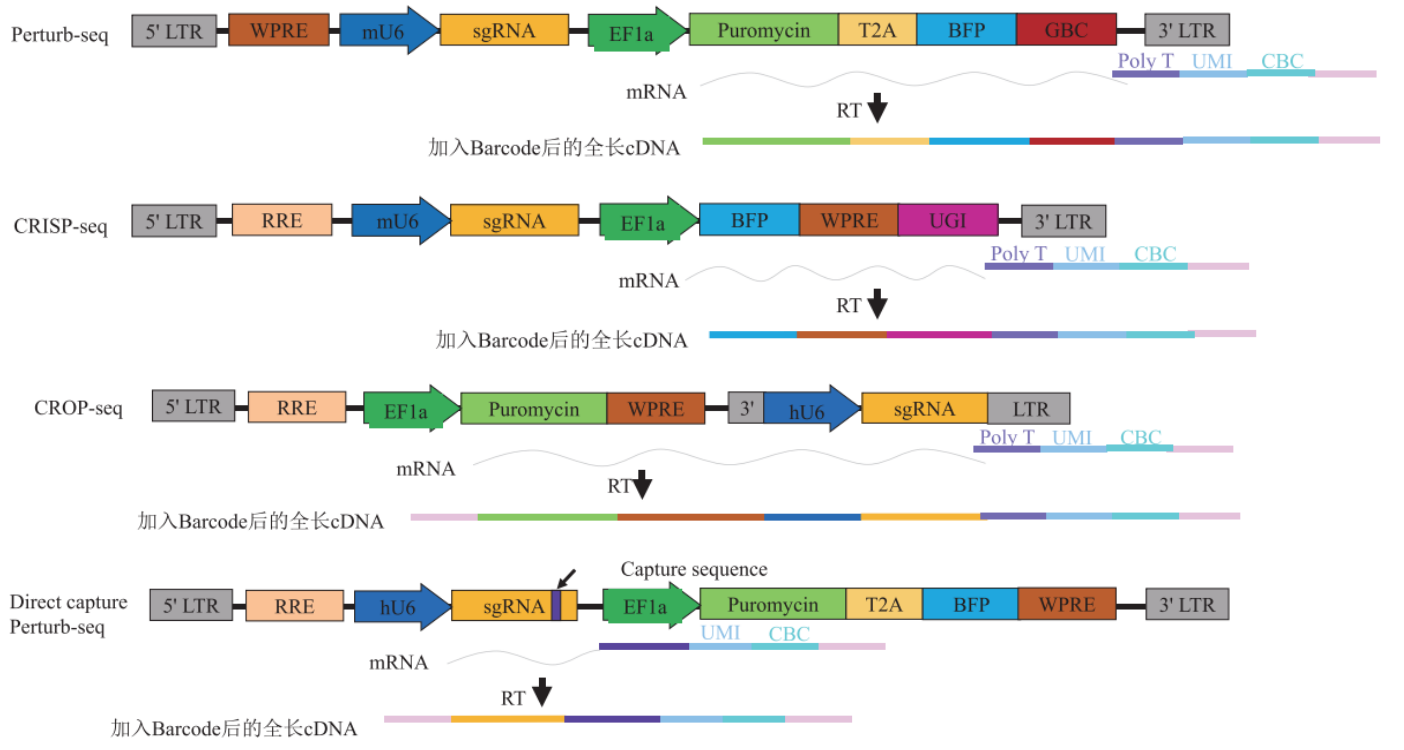
基于CRISPR的单细胞转录组测序文库制备[1]
三、单细胞CRISPR筛选方法
- Perturb-Seq
Perturb-Seq是在传统CRISPR筛选的基础上进行优化,并结合单细胞测序的高通量基因组功能分析方法[2]。该方法针对每个sgRNA设计一个引导条形码(guide barcode ,GBC) ,并在CRISPR慢病毒载体中添加GBC的表达盒。由于该表达盒可以用于单细胞测序的测序体系中,那么得到的数据便包含GBC和转录组两部分。从中分析出每个细胞扰动基因、调控网络和表现之间的关系。此外,该表达盒还含有蓝色荧光蛋白(blue fluorescent protein,BFP)和嘌呤霉素抗性基因,以便用于流式细胞仪分选或抗生素选择转导的细胞。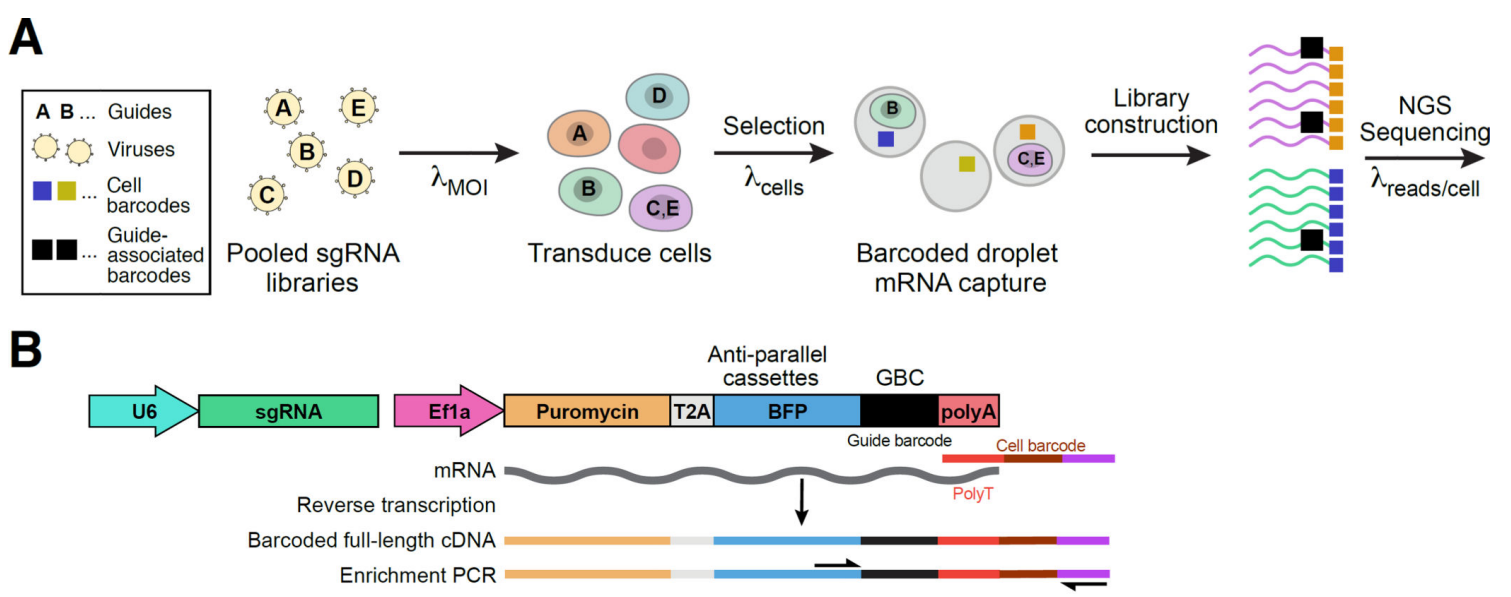
-
CRISP-Seq
CRISP-Seq的作用原理与Perturb-Seq相似。在CRISPR慢病毒载体中添加多聚腺苷独特向导标签(unique guide index,UGI)的表达盒,与GBC作用相似,用于标记sgRNA。经过单细胞测序,结合UGI与单细胞转录组数据,便能够对基因扰动进行深入而全面的表型分析,并在单个实验中研究它们的功能和相互作用[3]。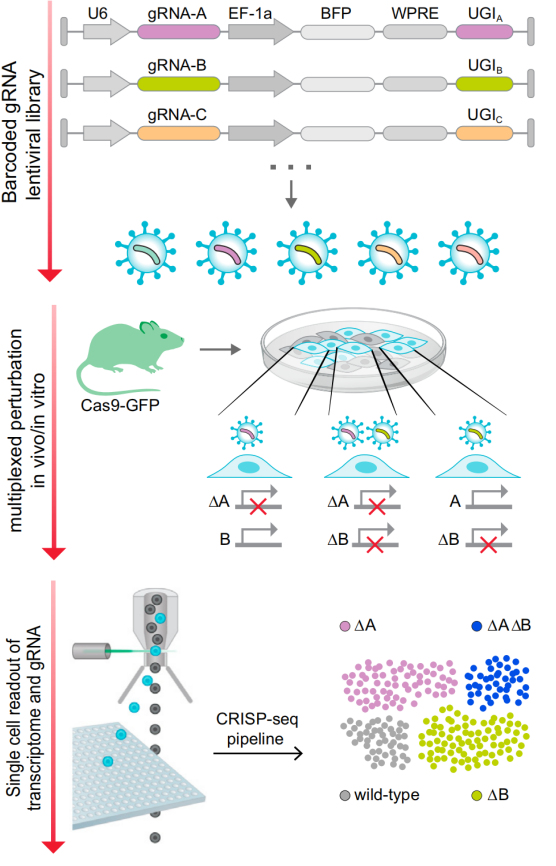
-
CROP-Seq
CROP-Seq的慢病毒载体结构,是在Puro抗性基因后3′LTR区插入U6-gRNA表达盒。这样的设计,RNA聚合酶III转录U6-gRNA,行驶基因编辑的功能。而RNA聚合酶Ⅱ转录Puro抗性基因,嘌呤霉素mRNA会包含U6-gRNA表达盒的序列,在后续的单细胞测序时,便可以直接获得sgRNA的信息,极大地简化了后续操作[4]。此外,在慢病毒的逆转录和整合过程中,整个U6-gRNA表达盒还会被复制插入到5′LTR,但并不会干扰EF-1a启动子上游的第二个拷贝。
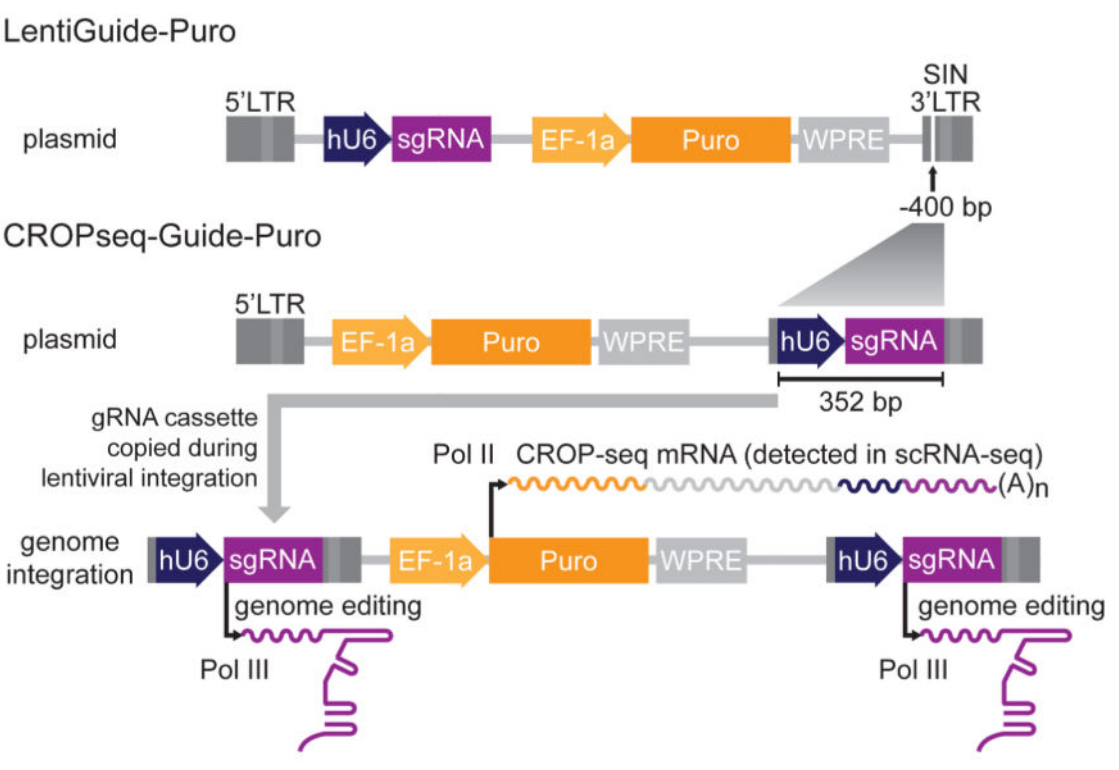
-
Direct capture PerturbSeq
Perturb-Seq、CRISP-Seq和CROP-Seq等方法已经可以在单细胞的基础上分析目的基因、调控网络与表型之间的关系,但这几种方法仍然有缺陷:
1) 在Perturb-Seq和CRISP-Seq中,需要GBC或UGI标记sgRNA,才能检测出对应的sgRNA。但是在测序和生信分析等过程中存在误差,GBC或UGI与sgRNA配对有一定概率出错。
2)GBC或UGI与sgRNA存在一一对应的关系,意味着标记序列和sgRNA都需要克隆进慢病毒载体中,这极大地增加了sgRNA文库制作的难度。
3)CROP-Seq是将U6-sgRNA表达盒大片段添加至Puro抗性基因后3′LTR区,这就限制了不能添加多个sgRNA。
Direct capture PerturbSeq则很好地解决了这些问题。Direct capture PerturbSeq是基于10×Gebomics公司的5′端和3′端的建库方法,开发了5′端和3′端两种检测sgRNA方案[5]。在5′端的检测方案中,针对sgRNA后面的恒定序列设计逆转录引物,逆转录合成sgRNA序列的cDNA,sgRNA-cDNA与其他mRNA-cDNA一同与凝胶微珠上的TSO序列结合,连接上细胞条形码(Cell Barcode,CBC)和单细胞转录本独特的分子标识(unique molecular identifier,UMI),进行建库测序。在3′端的检测方案中,凝胶微珠上具有CBC、UMI和针对恒定区中特定序列设计的反转录引物,在逆转录过程中合成sgRNA序列的cDNA,并添加TSO序列,与其他mRNA-cDNA一同建库测序。
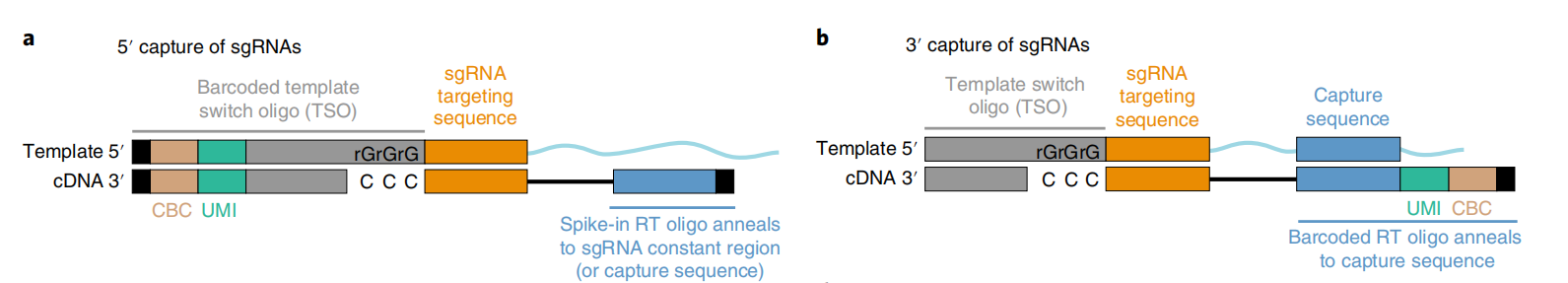
这里需要补充说明的是,sgRNA后面的恒定序列,是指sgRNA-scafold,是锚定sgRNA与Cas9蛋白的二级RNA结构序列。恒定区中特定序列,是只在不影响恒定序列的功能和编辑效率的情况下,选定恒定序列的某个位点添加一段特异序列,用于反转录引物的设计。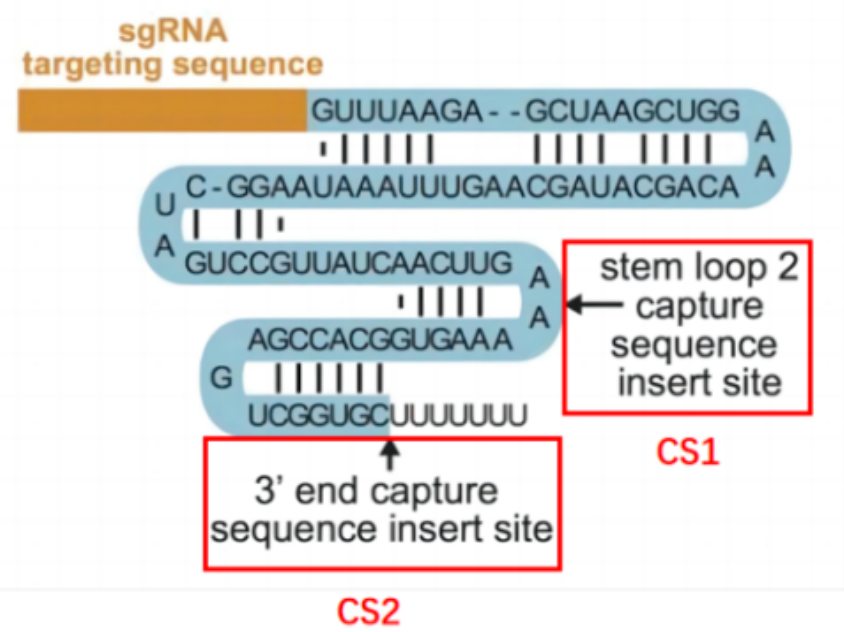
Direct capture PerturbSeq的两种建库测序方法与之前Perturb-Seq、CRISP-Seq和CROP-Seq等方法的检测效果一样好,并且一个慢病毒载体可以装载多个U6-sgRNA,极大地提高了单细胞扰动实验的效率。
四、小结
CRISPR 文库筛选技术具有高通量、精确筛选靶基因等特点,大大简化我们研究的实验流程和节省时间成本。在结合单细胞测序后,在单细胞高分辨率的基础上,直接建立sgRNA与其他基因表达谱和表型之间的关系,使研究结果更加精确和全面。随着技术的不断迭代更新,CRISPR 文库筛选结合单细胞测序的手段,必将对生命基础研究的探索和人类疾病治疗等方面作出巨大贡献。

参考文献
[1]郭俊璠, 黄行许, 乔云波. 基于CRISPR的单细胞转录组测序技术研究进展[J]. 生命的化学, 2022, 42 (01): 1-11.
[2]Dixit A, Parnas O, Li B, et al. Perturb-Seq: Dissecting Molecular Circuits with Scalable Single-Cell RNA Profiling of Pooled Genetic Screens. Cell. 2016;167(7):1853-1866.e17.
[3]Jaitin DA, Weiner A, Yofe I, et al. Dissecting Immune Circuits by Linking CRISPR-Pooled Screens with Single-Cell RNA-Seq. Cell. 2016;167(7):1883-1896.e15.
[4]Datlinger P, Rendeiro AF, Schmidl C, et al. Pooled CRISPR screening with single-cell transcriptome readout. Nat Methods. 2017;14(3):297-301.
[5]Replogle JM, Norman TM, Xu A, et al. Combinatorial single-cell CRISPR screens by direct guide RNA capture and targeted sequencing. Nat Biotechnol. 2020;38(8):954-961.