武汉傲星生物科技有限公司
2 年
手机商铺
- NaN
- 0.6000000000000001
- 1.6
- 0.6000000000000001
- 3.6
武汉傲星生物科技有限公司
入驻年限:2 年
- 联系人:
李彬
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
技术服务、ELISA 试剂盒、细胞库 / 细胞培养、抗体、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 经销商
公司新闻/正文
IF:12.8,高分捷径!单细胞×双硫死亡双热点碰撞,预后分析+多实验支撑,顶刊级发文模板!
179 人阅读发布时间:2025-07-18 14:46
题目:CASC8通过c-Myc-GLUT1轴激活磷酸戊糖途径抑制胰腺导管腺癌中的双硫死亡
英文名:CASC8 activates the pentose phosphate pathway to inhibit disulfidptosis in pancreatic ductal adenocarcinoma though the c-Myc-GLUT1 axis
杂志:Journal of Experimental & Clinical Cancer Research
影响因子:12.8
发表时间:2025年1月27日
研究背景:胰腺导管腺癌(PDAC)是高度侵袭性的消化道恶性肿瘤,虽仅占所有癌症的3%,却为美国癌症相关死亡的第三大原因。程序性细胞死亡(如铁死亡、坏死性凋亡等)在PDAC应激条件下的发展中起重要作用,而双硫死亡作为一种代谢相关的程序性细胞死亡,在PDAC中的作用及调控机制尚不明确。lncRNA CASC8在PDAC代谢和双硫死亡中的功能及分子机制也有待阐明。
研究思路:通过分析TCGA和GTEx数据库中PDAC样本的基因表达数据,鉴定双硫死亡相关基因(DRGs)和lncRNA(DRLs),构建风险模型并发现CASC8高表达与PDAC不良预后相关;随后通过细胞实验(敲低/过表达CASC8)和动物模型(皮下移植瘤、原位移植瘤)探究其对PDAC细胞增殖、迁移及双硫死亡的影响;结合转录组测序、代谢组测序、RNA免疫沉淀等技术,揭示CASC8通过与c-Myc结合增强其稳定性,激活磷酸戊糖途径,降低NADP⁺/NADPH比值,从而抑制双硫死亡的分子机制。
研究结果:
1、PDAC中双硫死亡及双硫死亡相关基因的表达模式
先前研究总结了24个双硫死亡相关基因(DRGs),分析TCGA-PAAD和GTEx数据发现,多数DRGs在PDAC中高表达,突变率低,ACTN4、TLN1 CNV扩增最多,CAPZB、NUDFA11 CNV缺失,且有11个基因与PDAC预后相关(图1A-F)。评估PDAC细胞系SLC7A11表达后,选4个高表达细胞系实验,显示葡萄糖饥饿使PI阳性细胞增多,DTT和TCEP可逆转,且细胞出现F-肌动蛋白收缩等变化,提示双硫死亡可能促进PDAC进展(图1G-J)。
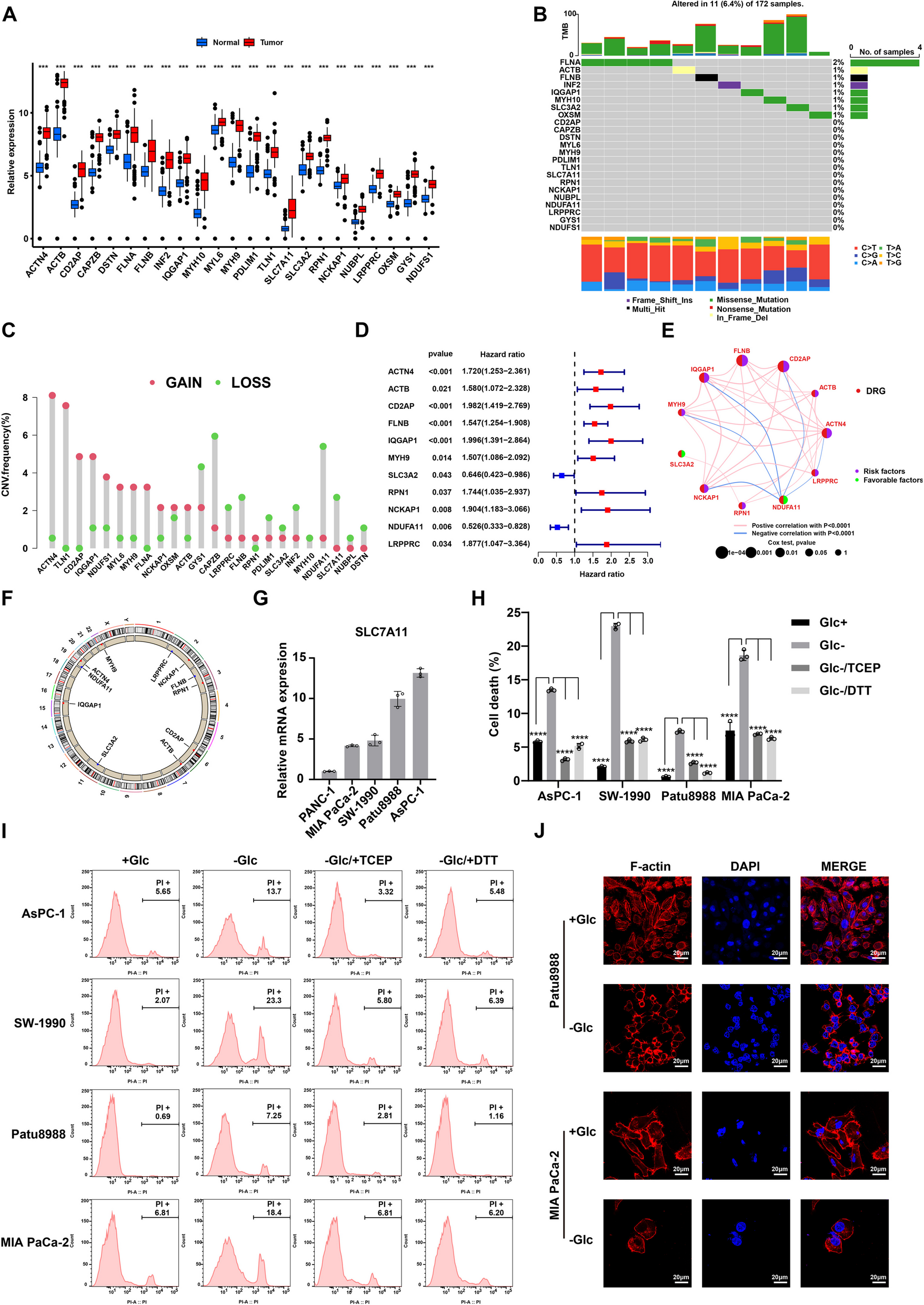
图1
2、基于双硫死亡相关lncRNA的风险特征在PDAC中的构建
为鉴定双硫死亡相关lncRNA(DRLs),用limma包分析PDAC样本,按|cor|≥0.3且P≤0.001得173个DRLs(图2A);将TCGA样本分训练和测试组,经相关分析确定5个关键DRLs(含CASC8)建立风险特征(图2B)。GEPIA数据库显示CASC8在PDAC中高表达,与较短OS和DFS相关(图2C-E);单细胞转录组、FISH及CISH验证其主要定位于肿瘤细胞,且表达高于正常和慢性胰腺炎组织,或为PDAC进展预测指标(图2F-I)。
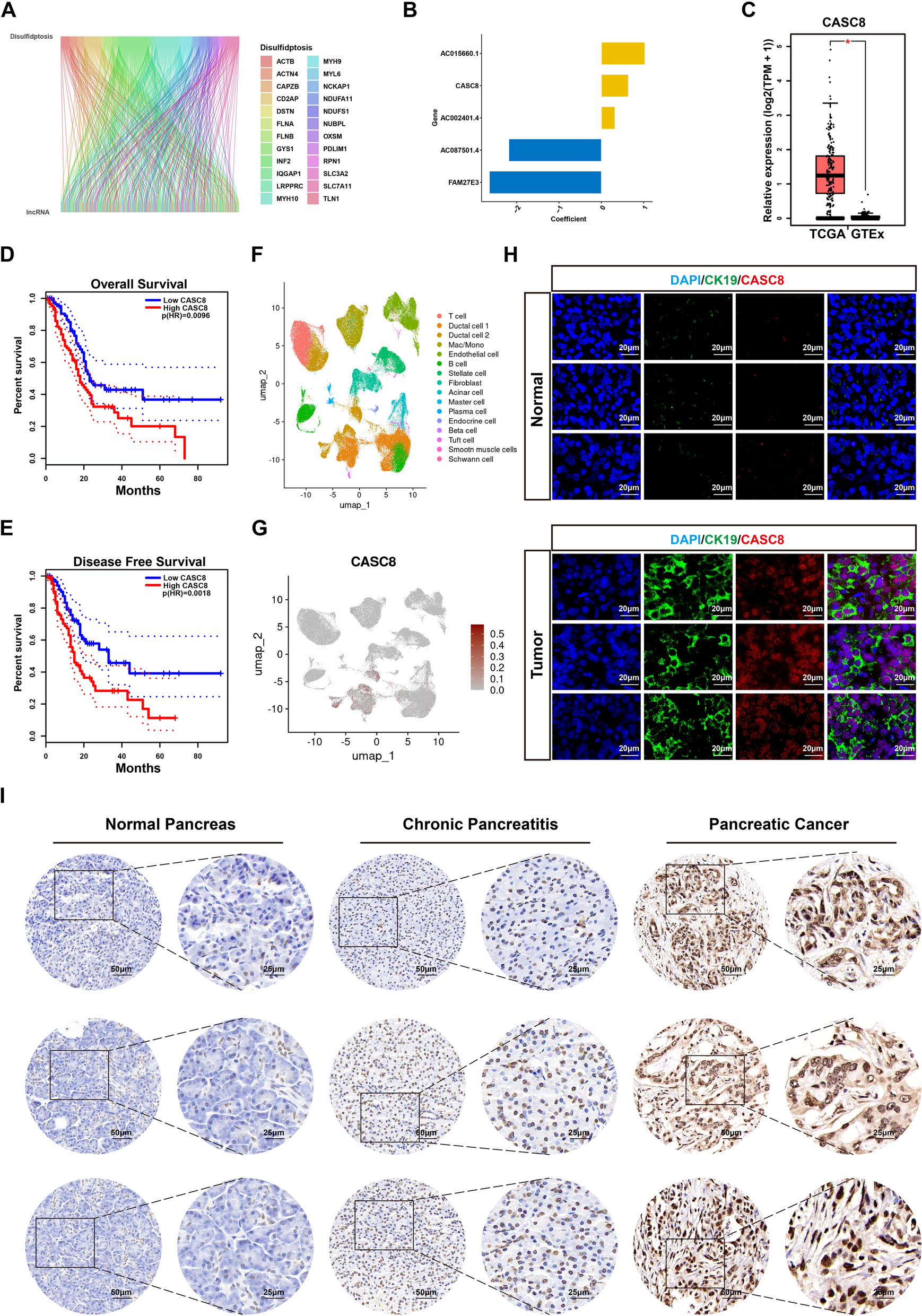
图2
3、CASC8在体外葡萄糖饥饿条件下抑制PDAC细胞的双硫死亡
双硫死亡是代谢应激和葡萄糖饥饿触发的细胞死亡,与蛋白质二硫键形成相关。研究CASC8(双硫死亡相关lncRNA)发现,葡萄糖饥饿下,CASC8敲低使PI阳性死亡细胞显著增加,还原剂可逆转;过表达则减少PI阳性细胞(图3A-G)。荧光染色显示CASC8敲低细胞有F-肌动蛋白收缩等双硫死亡形态(图3H),表明其在调节PDAC细胞双硫死亡中起重要作用。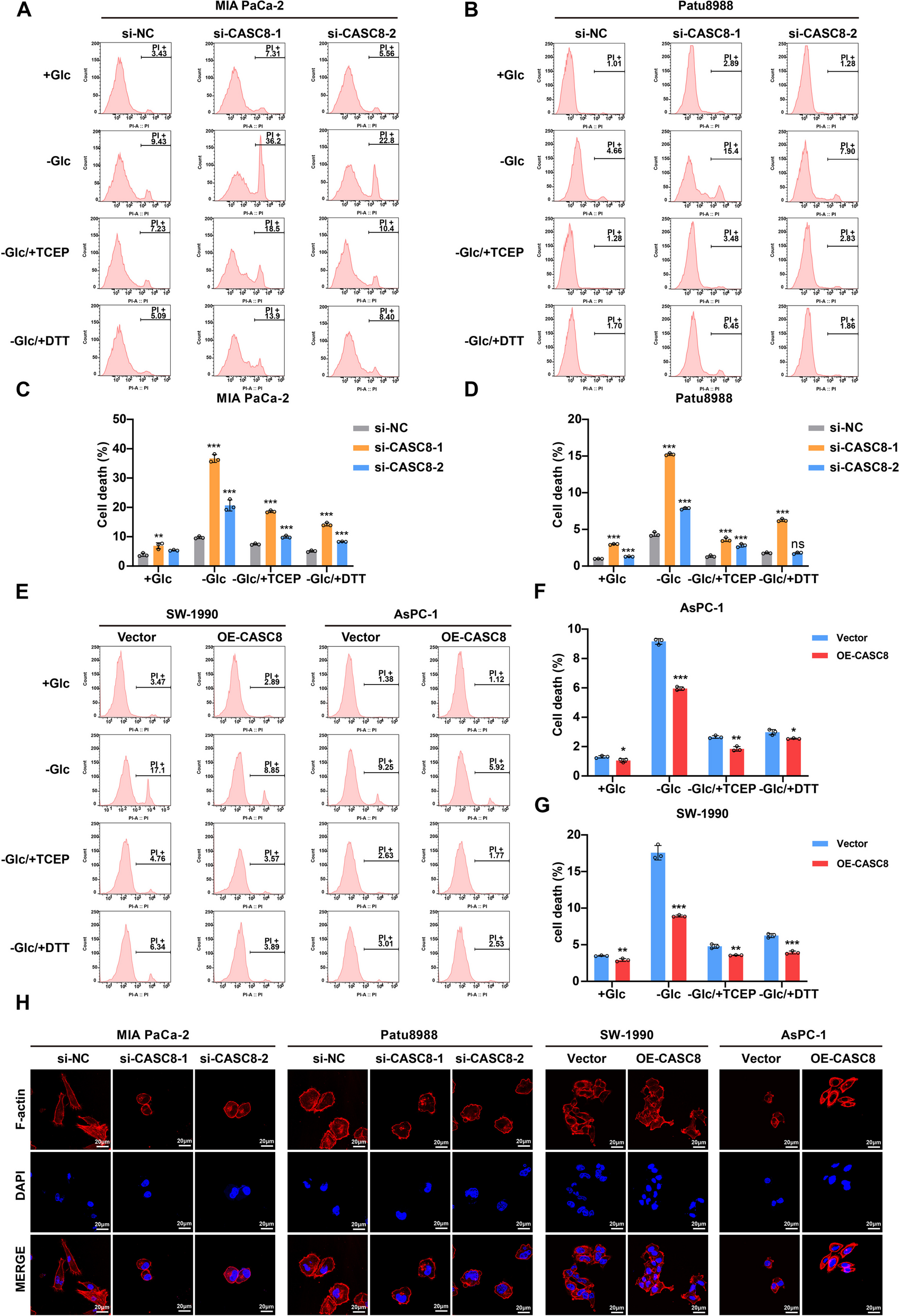
图3
4、CASC8在体内抑制PDAC双硫死亡
为了研究CASC8在体内对双硫死亡的影响,使用慢病毒短发夹RNA(shRNA)构建体建立了稳定的CASC8敲低PDAC细胞。随后,开发了皮下异种移植肿瘤模型。与对照组的异种移植物相比,五只注射了sh-CASC8细胞的小鼠表现出显著更低的肿瘤负荷(P<0.001)(图4A-C)。值得注意的是,用3mg/kg的BAY-876(一种模拟葡萄糖饥饿的GLUT1抑制剂)处理产生了类似的抗肿瘤效果,表明CASC8与体内葡萄糖代谢之间存在潜在联系(P<0.001)。对石蜡包埋的异种移植肿瘤进行了Ki-67的IHC染色、CASC8的CISH以及TUNEL测定(图4D)。为了验证这些发现,进一步采用了原位异种移植模型,将肿瘤细胞植入小鼠胰腺。与皮下模型的结果一致,阴性对照组的五只小鼠与sh-CASC8组相比,发展出明显更大和更重的肿瘤(P=0.0065)。重要的是,在原位模型中用3mg/kg的BAY-876处理维持了这种观察到的肿瘤大小差异(P<0.001)(图4E-F)。同时,IHC结果还表明对照组比sh-CASC8组具有更强的增殖能力(图4G)。总体而言,这些体内发现强烈表明CASC8可以抑制PDAC细胞中的双硫死亡,可能通过调节葡萄糖代谢。
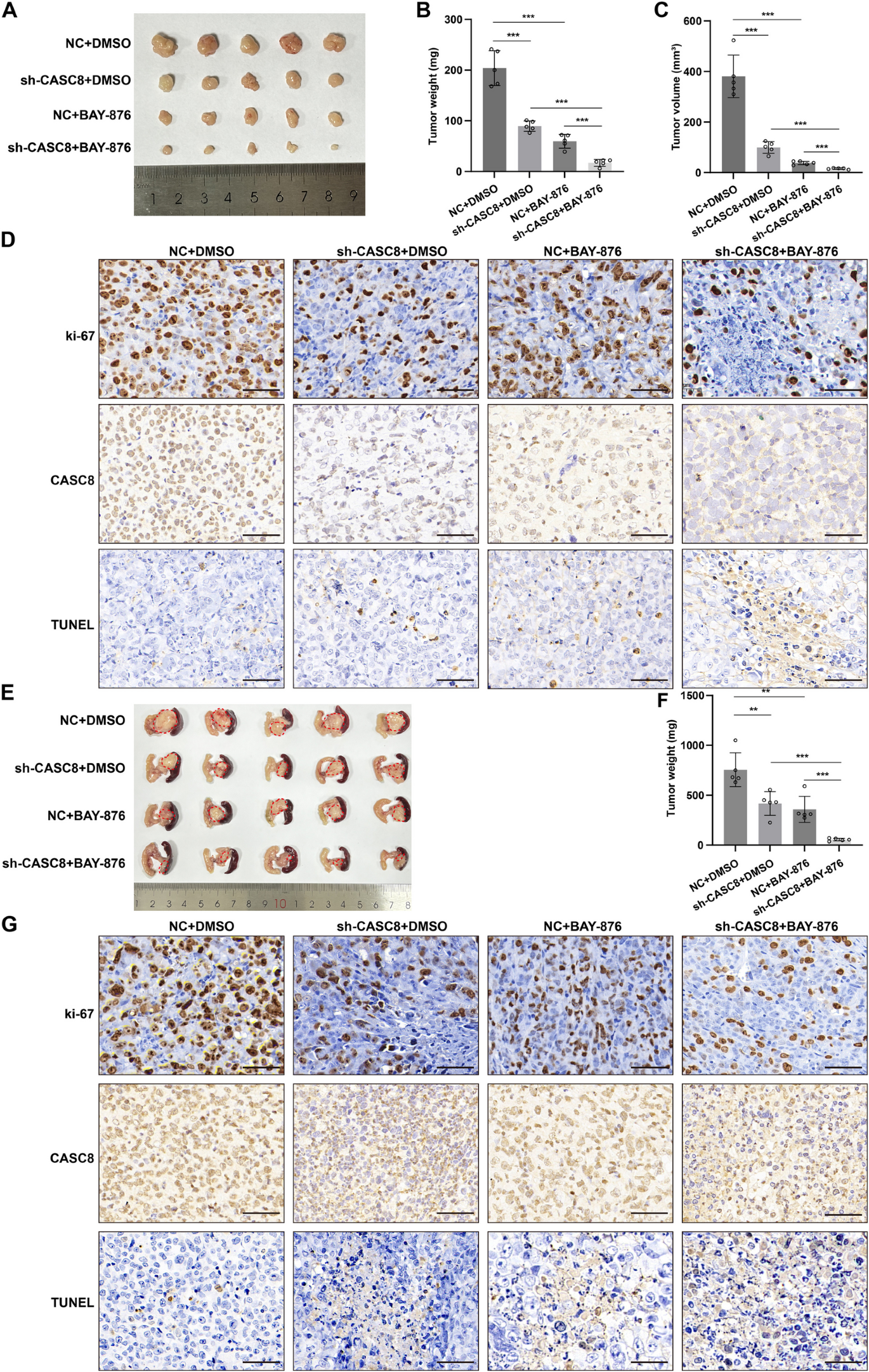
图4
5、CASC8与PDAC细胞中的磷酸戊糖途径相关
为阐明CASC8调控PDAC进展和双硫死亡的机制,对CASC8敲低细胞及对照进行RNA-seq,GO、KEGG和GSEA分析显示对照组基因富集于糖酵解和磷酸戊糖途径(图5A)。qRT-PCR、Western blotting等证实CASC8敲低下调ENO1、GLUT1等,减少GLUT1蛋白(图5B-C)。CASC8敲低还下调磷酸戊糖途径相关基因,增加NADP⁺/NADPH比值,降低葡萄糖摄取,过表达实验结果则相反;代谢组学显示其影响相关代谢物水平,表明CASC8显著影响PDAC细胞的磷酸戊糖途径(图5D-M)。
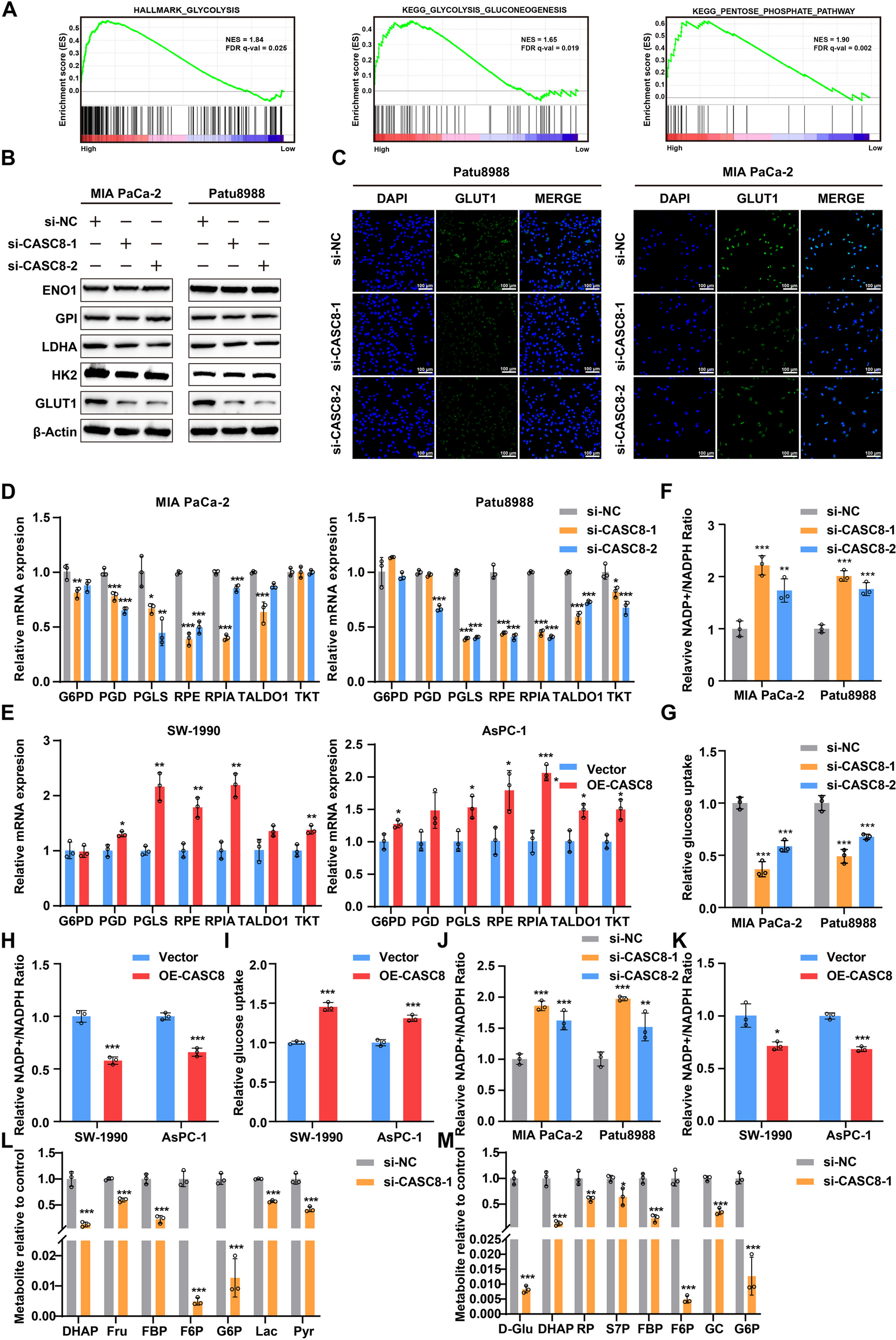
图5
6、CASC8能够结合c-Myc并调节其蛋白稳定性
为阐明CASC8表达增加如何促进磷酸戊糖途径的潜在机制,对TCGA-PAAD数据集进行了GSEA分析。该分析揭示了CASC8表达与c-Myc靶基因表达之间存在显著相关性(图 href="#Fig6">6A)。这一结果通过RNA测序进一步得到证实(图 href="#Fig6">6B)。c-Myc转录因子在调节基本细胞过程中起着关键作用。在肿瘤细胞中,快速增殖和生长通常导致对能量的需求增加。为满足这一需求,肿瘤常表现出c-Myc的过表达或异常激活,进而调节糖酵解和磷酸戊糖途径等葡萄糖代谢途径,为癌细胞提供充足能量。基于这些观察结果,假设CASC8可能与c-Myc蛋白相互作用,可能通过激活下游效应分子来发挥其功能。RNA免疫沉淀(RIP)和共定位实验为这一假设提供了初步支持(图 href="#Fig6">6C-E)。Westernblotting分析进一步揭示,在CASC8敲低后,c-Myc蛋白水平显著降低,而CASC8过表达则导致c-Myc蛋白水平升高,无论是否存在葡萄糖(图 href="#Fig6">6F-I)。为研究蛋白稳定性,用10μg/mL的Cycloheximide(CHX)处理细胞,以抑制蛋白合成六小时。该实验表明,与对照组相比,CASC8敲低细胞的c-Myc降解速率显著增加(图 href="#Fig6">6J-K)。此外,敲低CASC8显著降低了下游c-Myc靶基因的mRNA水平(图 href="#Fig6">6L)。综合这些发现表明,CASC8可以与c-Myc蛋白结合,促进其稳定性,从而激活下游效应分子。
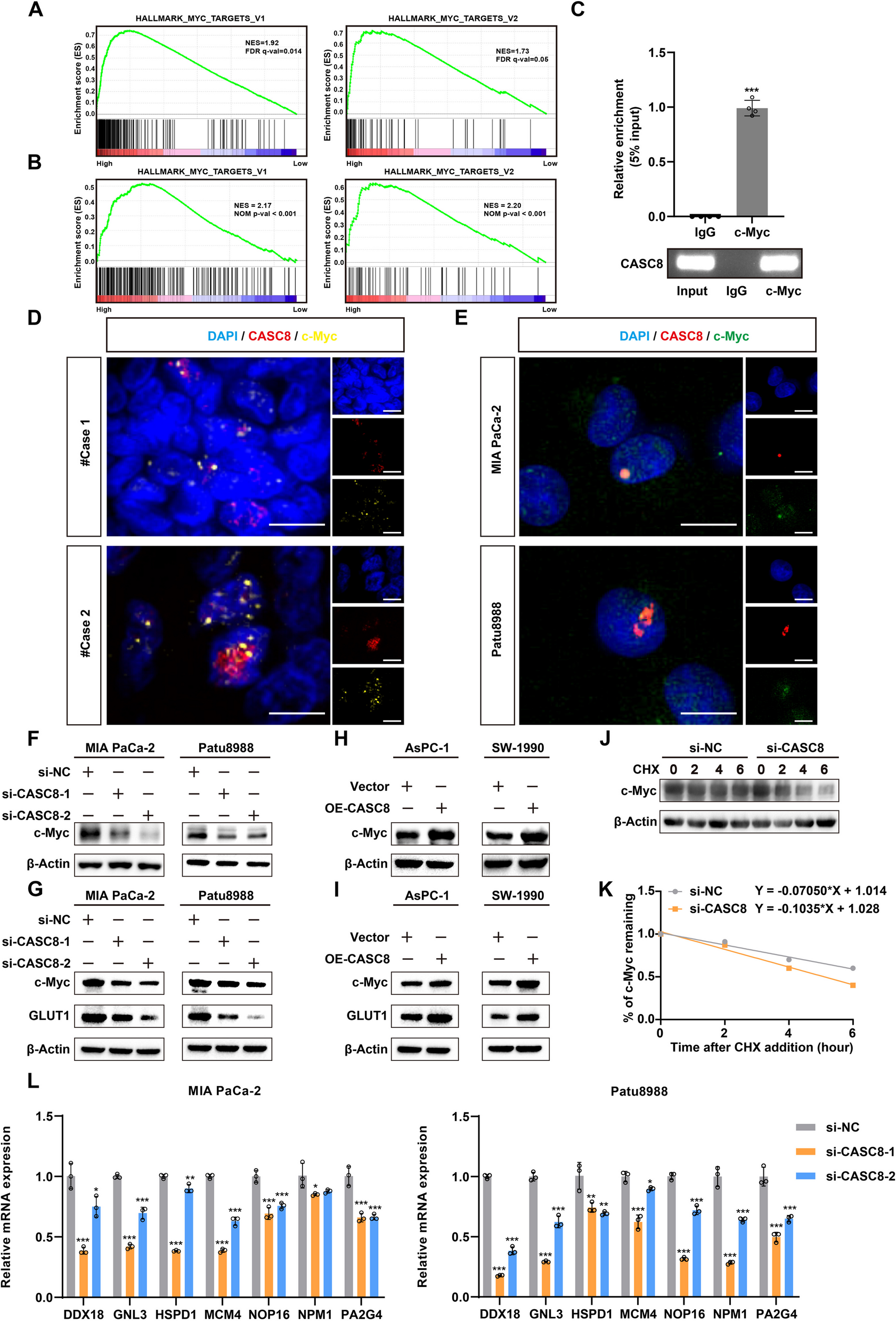
图6
7、CASC8通过调节c-Myc在体外促进PDAC生长和迁移
为探究CASC8与c-Myc在胰腺导管腺癌(PDAC)进展中的功能关系,在CASC8敲低细胞中过表达c-Myc,在CASC8过表达细胞中敲低 c-Myc,蛋白质印迹分析验证了操作效力(图 7A-B)。对不同 PDAC细胞组的相对 NADP+/NADPH 比例和葡萄糖摄取研究显示,CASC8敲低细胞中过表达c-Myc可减弱NADP+/NADPH比例的增加,并挽救葡萄糖摄取的减少(图7C-D);CASC8过表达细胞中敲低c-Myc则效果相反(图7E-F)。葡萄糖饥饿条件下,CASC8敲低细胞中过表达c-Myc显著减少二硫键形成细胞(图7G-I)。这些表明,葡萄糖缺乏时CASC8通过 c-Myc 依赖性机制促进PDAC细胞存活。
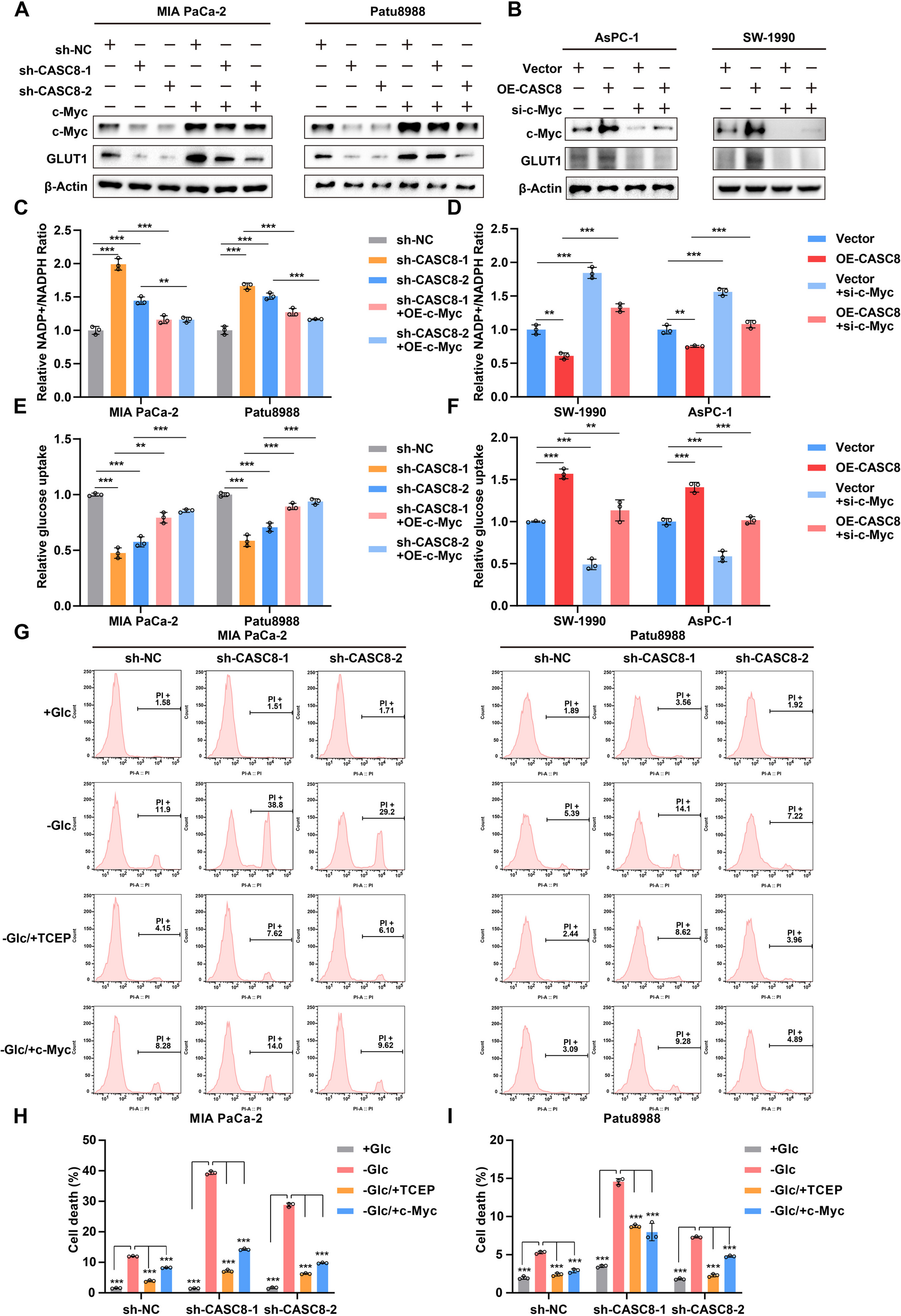
图7
8、CASC8通过c-Myc在体内抑制PDAC二硫键形成
之前体外研究提示CASC8通过c-Myc抑制胰腺导管腺癌(PDAC)的氧化蛋白聚集。为在体内进一步验证c-Myc是CASC8在PDAC氧化蛋白聚集中的关键下游效应因子,采用了皮下异种移植模型。在注射BAY-876后,接种sh-CASC8+c-Myc细胞的五只小鼠肿瘤体积和重量显著增加,与sh-CASC8组相比(图 href="#Fig8">8A-C)。石蜡包埋的异种移植肿瘤进行Ki-67、c-Myc和CISH(CASC8)的免疫组化(IHC)染色,以及TUNEL检测。与sh-CASC8组相比,sh-CASC8+c-Myc组Ki-67阳性细胞比例更高,死亡细胞更少(图 href="#Fig8">8D)。这些结果在原位异种移植模型中得到证实,其中c-Myc过表达导致四只携带CASC8敲低细胞的肿瘤负荷增加(图 href="#Fig8">8E-F)。综合这些体内数据强烈表明,c-Myc作为CASC8调节氧化蛋白聚集的关键下游效应因子。
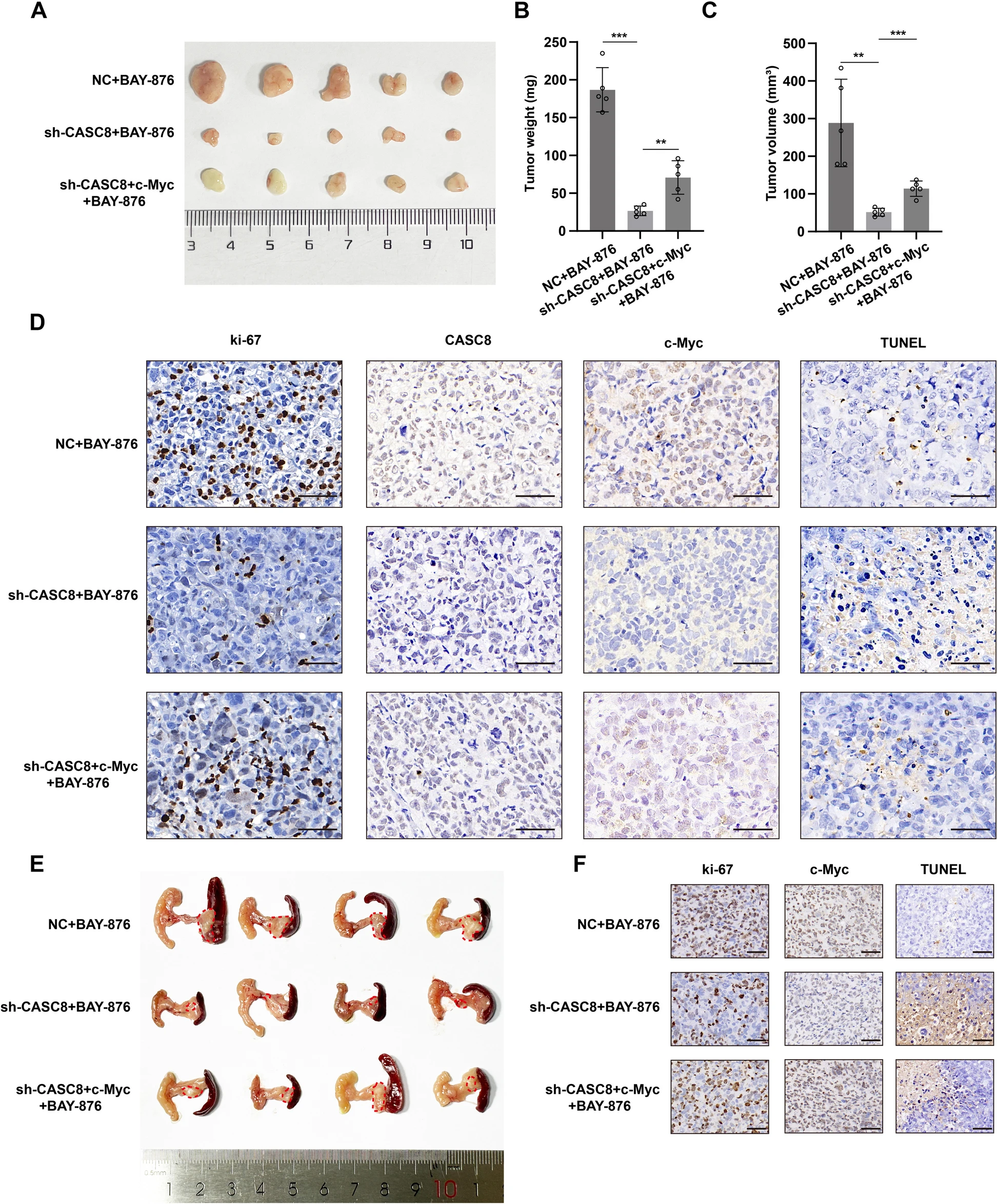
图8
总结:本研究证实胰腺导管腺癌中存在二硫化物应激反应,揭示CASC8高表达与PDAC患者不良预后相关,且CASC8通过与c-Myc结合增强其稳定性,激活戊糖磷酸途径,降低NADP+/NADPH比值,抑制二硫化物应激反应,进而促进PDAC进展。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!