TissueGnostics Asia Pacific Limited(TG亚太)
18 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
TissueGnostics Asia Pacific Limited(TG亚太)
入驻年限:18 年
- 联系人:
市场部
- 所在地区:
北京 丰台区
- 业务范围:
实验室仪器 / 设备、技术服务
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
Tissue Cytometry技术揭示HLA-DR⁺肿瘤细胞导致病毒性肝癌微环境免疫耗竭的作用机制
128 人阅读发布时间:2025-08-12 10:25
肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一,乙型肝炎病毒(HBV)是其主要致病因素。尽管病毒感染在塑造肿瘤微环境(TME)中起关键作用,但 HBV、丙型肝炎病毒(HCV)和非 B 非 C 型(NBNC)相关 HCC 之间的机制差异仍知之甚少。

2025年2月17日,河南省人民医院,郑州大学人民医院及新乡医学院的研究人员在ADVANCED SCIENCE上联合发表题为:HLA-DR+ Tumor Cells Show an Association with a Distinct Immune Microenvironment and CD8+ T-Cell Exhaustion in HBV-Associated Hepatocellular Carcinoma的研究论文,本研究详细描述了 HBV⁺HCC 的 TME,重点关注 HLA-DR⁺肿瘤细胞在促进免疫抑制中的作用。通过整合转录组学、空间和临床分析,揭示了免疫逃逸的新机制,并强调了 HLA-DR⁺肿瘤细胞作为治疗靶点和预后标志物的潜力。
这些发现强调了 HCC 中病因特异性治疗策略的必要性,并强调了理解肿瘤 - 免疫相互作用在开发有效免疫治疗中的重要性。该研究为改善 HCC 患者,特别是 HBV⁺HCC 患者的预后的未来研究奠定了基础。
实验部分
1.应用TissueFAXS Spectra扫描系统:
对 198 例肝癌样本的石蜡包埋组织微阵列(TMAs)进行 mIF 染色,使用 Anti - CD8、Anti - CTLA - 4、Anti - GZMB、Anti - PD - L1、Anti - HLA - DR、Anti - PanCK 等多种抗体标记细胞和分子,染色后利用TissueFAXS Spectra进行高分辨率扫描。以 20× magnification 对染色玻片进行扫描,在 420 至 720 nm 波长区间以 20 nm 间隔捕获荧光光谱,且保持相同曝光时间,从而获取高质量的多色图像数据,为后续分析提供基础。
2.应用StrataQuest分析软件:用于图像的光谱分解和定量分析。基于扫描得到的光谱数据,该软件能够建立光谱库,对多重荧光图像进行分解,完美解决了多重染色中的串色问题,可以得到每一通道的纯净信号,准确识别和区分不同荧光标记的细胞。
同时,计算目标细胞间的距离以及不同表型细胞间的相互邻居数量(最大距离25um),并分析 CD8 + 细胞亚群(如 CD8+CTLA4 + 和 CD8+GZMB + 细胞)与 PanCK+HLA-DR + 肿瘤细胞的空间距离分布。
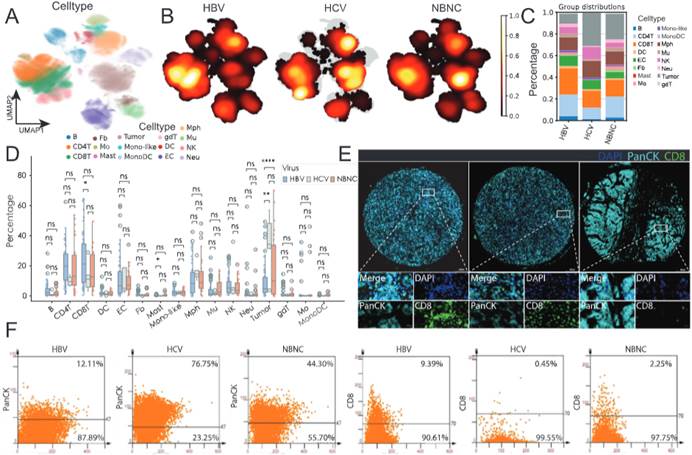
图 1. 乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和非 B 非 C 型(NBNC)相关肝细胞癌(HCC)免疫微环境的特征分析
(D)箱线图比较 HBV、HCV 和 NBNC 患者组间各细胞亚群的频率。使用双侧 Wilcoxon 秩和检验进行两两统计比较,“ns” 表示无显著性。
(E)HBV+(左)、HCV+(中)和 NBNC(右)肿瘤组织微阵列的代表性多重免疫荧光(mIF)图像。PanCK(青色)标记上皮肿瘤细胞,CD8(绿色)标记细胞毒性 T 细胞,DAPI(蓝色)染色细胞核。插图显示放大的肿瘤 - 免疫界面。
(F)从 mIF 数据中量化 PanCK + 肿瘤细胞和 CD8+ T 细胞群体。散点图显示 HBV、HCV 和 NBNC 肿瘤的细胞群比例,百分比反映各组中的细胞分布。
该实验部分应用TissueFAXS Spectra扫描系统和StrataQuest分析软件探究免疫细胞与肿瘤细胞的空间关系:在图 1(F)中,通过对 mIF 数据的量化,展示了 HBV、HCV 和 NBNC 肿瘤中 PanCK + 肿瘤细胞和 CD8+ T 细胞群体的比例,反映出不同组间细胞分布的差异。HBV 相关肝癌(HBV+HCC)中 CD8+ T 细胞比例高于 HCV + 和 NBNC 组,NBNC 组肿瘤细胞纯度更高;HLA - DR + 肿瘤细胞可招募 CD8+ T 细胞,但使这些 T 细胞更易表达 CTLA4,而 GZMB 表达减少,诱导 T 细胞耗竭,从而促进免疫抑制微环境形成。分析 HLA - DR、PD - L1 等蛋白的表达水平,确定它们与免疫抑制微环境形成的关联,研究 HLA - DR + 肿瘤细胞对 CD8+ T 细胞功能表型的影响。
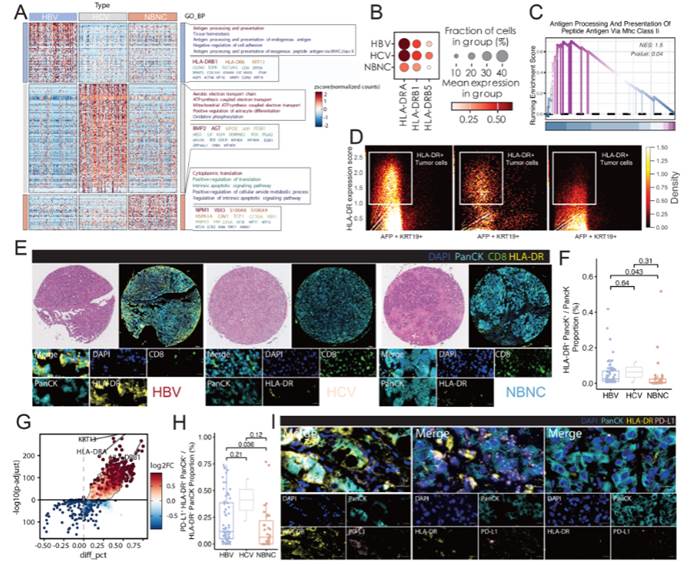
图 2. 与丙型肝炎病毒(HCV)和非 B 非 C 型(NBNC)相比,乙型肝炎病毒(HBV)相关肿瘤中 HLA-DR 表达增强
(E)HBV(左)、HCV(中)和 NBNC(右)患者代表性组织微阵列核心的多重免疫荧光(mIF)图像。图中展示 H&E 染色和荧光通道合并图:DAPI(细胞核,蓝色)、PanCK(肿瘤标志物,青色)、CD8(绿色)和 HLA-DR(黄色)。插图突出显示含有 HLA-DR + 肿瘤细胞的肿瘤区域。(F)量化 HBV、HCV 和 NBNC 组中 HLA-DR+PanCK + 肿瘤细胞占总 PanCK + 细胞的比例。使用 Wilcoxon 秩和检验进行两两比较,精确 P 值标注于图上方。(G)scRNA-seq 比较 HLA-DR + 与 HLA-DR−肿瘤细胞的火山图。HLA-DR + 细胞中显著富集的基因(如 HLA-DRA、HLA-DRB1、KRT13)以红色显示;x 轴为细胞分数差异(diff_pct),y 轴为 - log10 校正 P 值。(H)箱线图量化 HBV、HCV 和 NBNC 队列中 PD-L1+HLA-DR+PanCK + 肿瘤细胞。使用 Wilcoxon 秩和检验进行统计比较,标注 P 值。(I)高倍镜 mIF 图像显示 HLA-DR(黄色)与 PD-L1(品红色)在 PanCK + 肿瘤细胞(青色)内共定位。DAPI(蓝色)标记细胞核,白色箭头指示 HLA-DR+PD-L1 + 双阳性肿瘤细胞,突显通过抗原呈递和检查点信号传导实现免疫逃逸的潜力。
该实验部分应用StrataQuest分析软件揭露蛋白表达水平:依据荧光信号强度等信息,分析得出不同样本中 HLA - DR、PD - L1 等蛋白的表达水平数据。在图 2(F)中,量化了 HBV、HCV 和 NBNC 组中 HLA - DR+PanCK + 肿瘤细胞占总 PanCK + 细胞的比例;图 2(H)箱线图量化了 PD - L1+HLA - DR+PanCK + 肿瘤细胞在不同队列中的情况,反映出不同病因组和不同蛋白表达之间的关系。
应用TissueFAXS Spectra扫描系统进行蛋白共定位成像:通过对 mIF 图像的分析,确定 HLA - DR 与 PD - L1 等蛋白在肿瘤细胞内的共定位情况,如在图 2(I)高倍镜 mIF 图像下,显示 HLA - DR(黄色)与 PD - L1(品红色)在 PanCK + 肿瘤细胞(青色)内共定位,白色箭头指示 HLA - DR+PD - L1 + 双阳性肿瘤细胞,为研究免疫逃逸机制提供依据。

图 4. HLA-DR + 肿瘤细胞对肿瘤微环境和 CD8+ T 细胞动态的影响
(D)条形图量化高、低 HLA-DR 肿瘤中 CD8+ T 细胞的功能状态,包括初始态、T 细胞受体(TCR)信号、干扰素反应、细胞毒性、激活、耗竭和衰老。Wilcoxon 秩和检验显示高 HLA-DR 组中激活、耗竭和细胞毒性特征显著增强(**** p<0.0001)。
(J)箱线图比较乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和非 B 非 C 型(NBNC)组中 CD8+ T 细胞与 HLA-DR + 肿瘤细胞的空间距离。病毒病因组间无显著差异,提示仅 proximity 不能完全解释功能差异。两两比较采用 Wilcoxon 秩和检验。
(K-M)散点图显示 CD8+ T 细胞功能表型(CD8+、GZMB+、CTLA4+)与距 HLA-DR + 肿瘤细胞距离的关系。更短距离与更高 CTLA4 表达和更低 GZMB 表达相关,表明空间关联的免疫耗竭。
该实验部分应用StrataQuest软件测量 CD8+ T 细胞亚群(如 CD8+GZMB + 和 CD8+CTLA4 + 细胞)与 PanCK+HLA - DR + 肿瘤细胞之间的距离,得到细胞间的空间距离数据。在图 4(J)中,通过箱线图比较了 HBV、HCV 和 NBNC 组中 CD8+ T 细胞与 HLA - DR + 肿瘤细胞的空间距离,探究不同病因组间的差异;图 4(K - M)的散点图则展示了 CD8+ T 细胞功能表型(CD8+、GZMB+、CTLA4+)与距 HLA - DR + 肿瘤细胞距离的关系,揭示空间关联的免疫耗竭现象。






