上海富衡生物科技有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
品牌商
上海富衡生物科技有限公司
入驻年限:5 年
- 联系人:
刘胜富
- 所在地区:
上海 闵行区
- 业务范围:
抗体、ELISA 试剂盒、细胞库 / 细胞培养、论文服务、试剂、实验室仪器 / 设备、技术服务、耗材
- 经营模式:
代理商 经销商 生产厂商 科研机构
推荐产品
技术资料/正文
上海富衡 | 人结肠癌细胞HCT-116
995 人阅读发布时间:2025-05-06 09:51
一、HCT-116细胞的生物学特性
HCT-116是结直肠癌研究中最具代表性的细胞模型之一,由M. Brattain团队于1979年从一名48岁男性结肠癌患者的肿瘤组织分离建立。其核心特性包括:
- 形态与遗传特征:贴壁生长,上皮细胞样形态,染色体为近二倍体,遗传稳定性高,适合长期实验。
- 携带KRAS基因第13号密码子点突变(Gly13Asp),这一突变与结直肠癌的增殖和耐药性密切相关。
- 功能特性:在半固体琼脂糖中可形成克隆,裸鼠体内致瘤性显著,能形成上皮样肿瘤结节。
- 表达癌胚抗原(CEA)和角蛋白,同时保留部分肠上皮分化潜能。
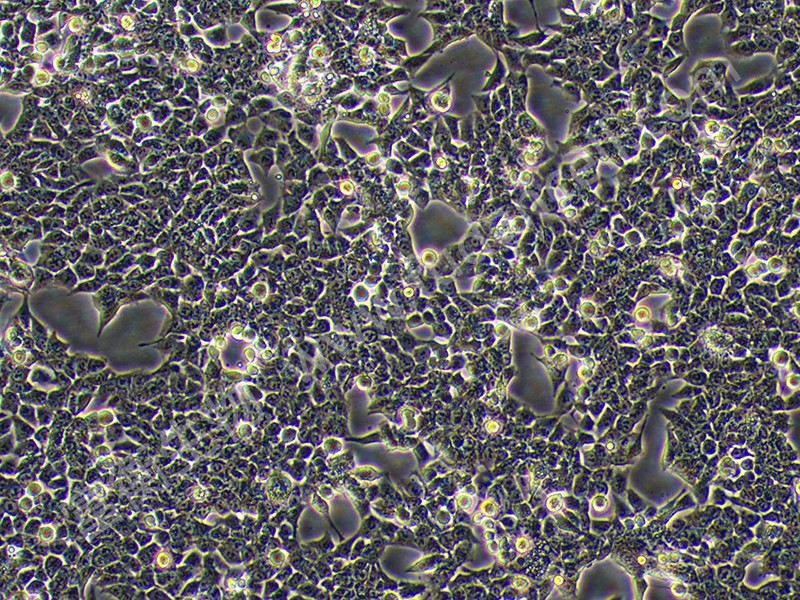
二、HCT-116的标准化培养体系
1. 培养基与传代要点
- 培养基选择:优先使用McCoy’s 5A或DMEM高糖培养基,补充10%胎牛血清(FBS)及1%双抗。更换培养基需谨慎,避免因适应性差异导致细胞死亡。
- 传代操作:消化时间控制在30-60秒(0.25%胰酶),轻柔吹打避免机械损伤,传代比例1:3~1:5。
- 推荐使用细胞刮铲替代胰酶消化,减少细胞聚团风险。
2. 常见问题与对策
- 细胞聚团:消化不彻底或吹打力度过大会导致聚团,需优化消化时间并预冷PBS洗涤。
- 空泡现象:约30%细胞胞质内存在空泡,与血清质量或代谢异常相关,可提高血清浓度至15%-20%改善。
- 增殖缓慢:接种密度需>5×10⁴ cells/cm²,并定期进行STR鉴定以排除遗传漂变。
三、HCT-116在科研中的多维应用
1. 肿瘤机制与信号通路研究
- KRAS突变模型:作为KRAS突变型结直肠癌的经典模型,用于研究MAPK/ERK通路异常激活对肿瘤增殖的影响。
- 耐药性机制:通过构建5-氟尿嘧啶(5-FU)耐药株,揭示药物外排泵(如ABCG2)和自噬途径的调控作用。
2. 药物开发与筛选
- 化疗药物评价:奥沙利铂、紫杉醇等通过诱导DNA损伤或凋亡通路抑制HCT-116增殖,IC50值可作为药效指标。
3. 基因编辑与功能基因组学
- CRISPR-Cas9筛选:利用HCT-116构建全基因组敲除文库,鉴定出SARS-CoV-2病毒复制依赖的宿主因子(如核糖体再循环因子)。
- 表观遗传调控:DNMT抑制剂(5-氮杂胞苷)通过降低DNA甲基化水平恢复抑癌基因表达。
四、HCT-116模型的优势与局限性
1. 核心优势
- 遗传稳定性:近二倍体基因组和低遗传异质性,适合基因编辑和机制研究。
- 高致瘤性:裸鼠皮下成瘤率100%,可模拟体内肿瘤微环境。
2. 局限性及改进方向
- 代谢功能缺陷:细胞色素P450酶活性仅为原代肝细胞的1/100,需通过3D类器官共培养或诱导分化提升。
- 模型单一性:缺乏免疫微环境,可通过构建人源化PDX模型或与免疫细胞共培养增强临床相关性。
五、研究前沿与技术创新
- 类器官与空间组学:结合HCT-116与成纤维细胞构建3D类器官,模拟肠道黏液层和药物渗透动态。
- 单细胞测序技术揭示肿瘤干细胞亚群(CD44⁺/CD133⁺)与化疗耐药性的关联。
- 多组学整合分析:蛋白组-代谢组联合分析发现Insp8基因变体调控能量代谢,影响细胞表型。
HCT-116细胞凭借其遗传稳定性、高致瘤性和可编辑性,已成为结直肠癌研究的“黄金标准”模型。尽管存在代谢功能不足和微环境简化等局限,但其在药物筛选、基因机制解析及病毒宿主互作研究中仍不可替代。未来,通过类器官、人工智能药物设计等技术的融合,HCT-116模型将推动结直肠癌精准治疗迈向新高度。




