- 视频课件
- 讲师介绍
- 视频介绍
讲师介绍
徐明明
视频介绍
讲座介绍
生物制品多以微生物、细胞、动物源或人源细胞等为起始原材料,使用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂,其中以真核细胞(如CHO、SF9)表达的生物制品为主。由于生产用细胞本身可能含有内源性病毒或者生产过程中容易污染病毒,因此,病毒安全性控制是生物制品药品申报时的关键环节。
《中国药典》和ICH Q5A对于生物制品的病毒安全性有明确要求,病毒安全性控制主要包括生产用细胞基质的质量控制和病毒清除验证。为适应生物医药行业快速发展和新生物迭代需求,ICH于2023年11月正式发布了Q5A (R2) 终版内容;2025年版《中国药典》将于10月1日起正式实施。两个主流的法规在生物制品质量控制及病毒安全性评价方面做出了关键修订,对推动生物医药行业发展意义重大。
本次讲座将聚焦生物制品病毒安全性控制最新法规,特邀义翘神州生物安全检测中心的负责人徐明明老师,将与行业同仁共同学习探讨2025版《中国药典》和ICH Q5A (R2) 中关于细胞库检测与病毒清除验证的变更内容,深入分析变更后的要求与国内外申报策略的差异,助力医药行业更好地应对法规更新带来的挑战。
讲座亮点
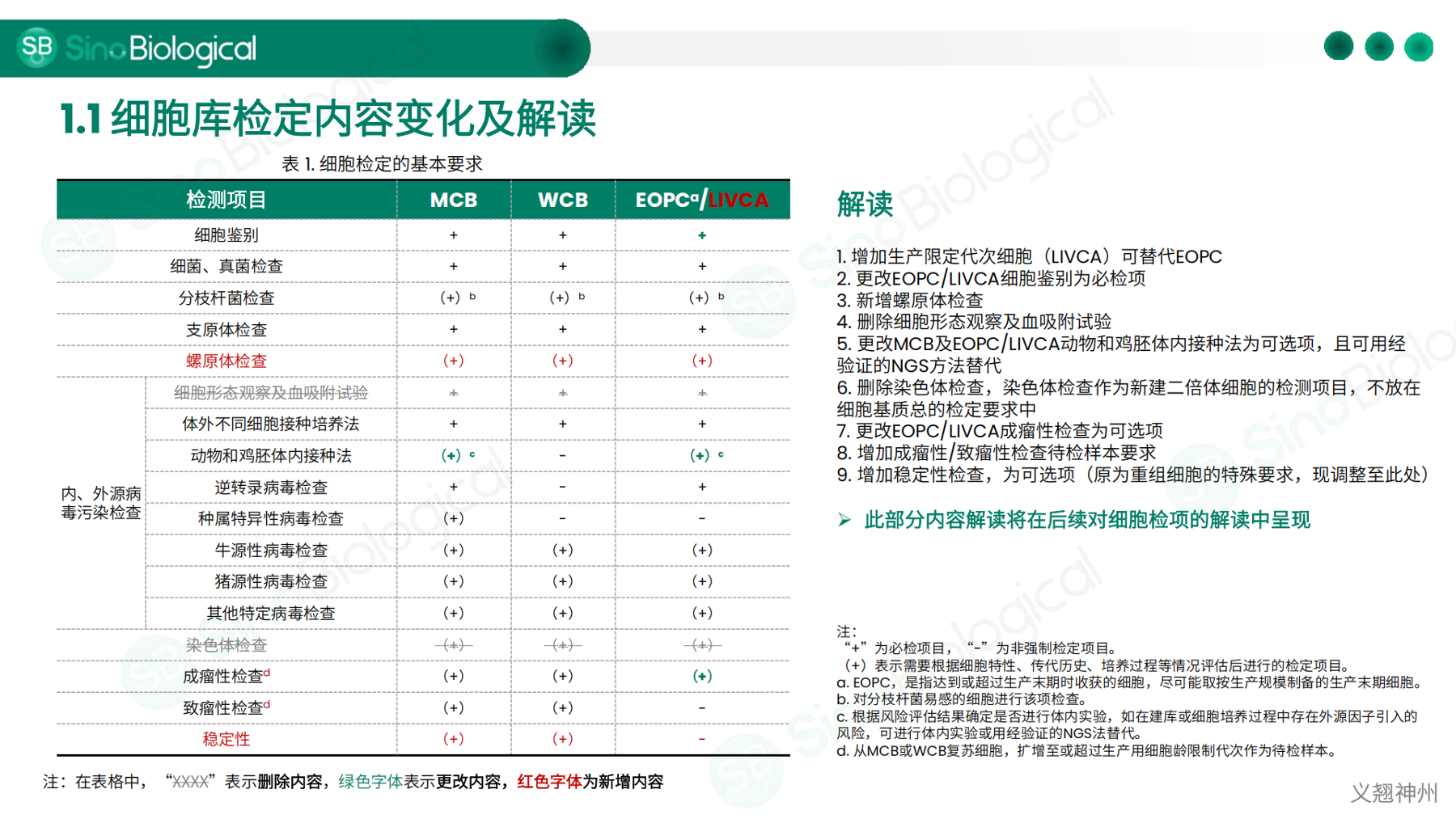
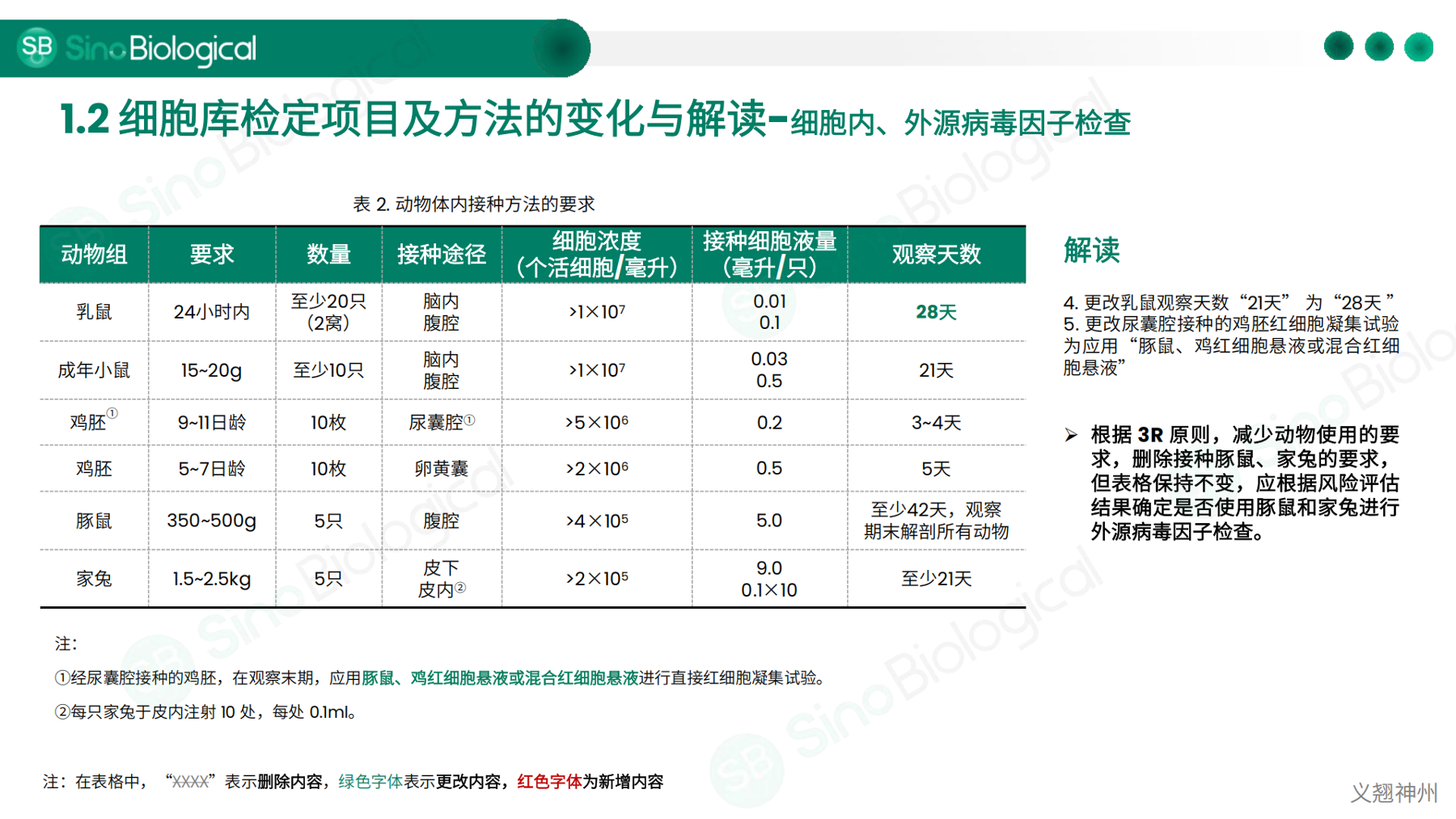
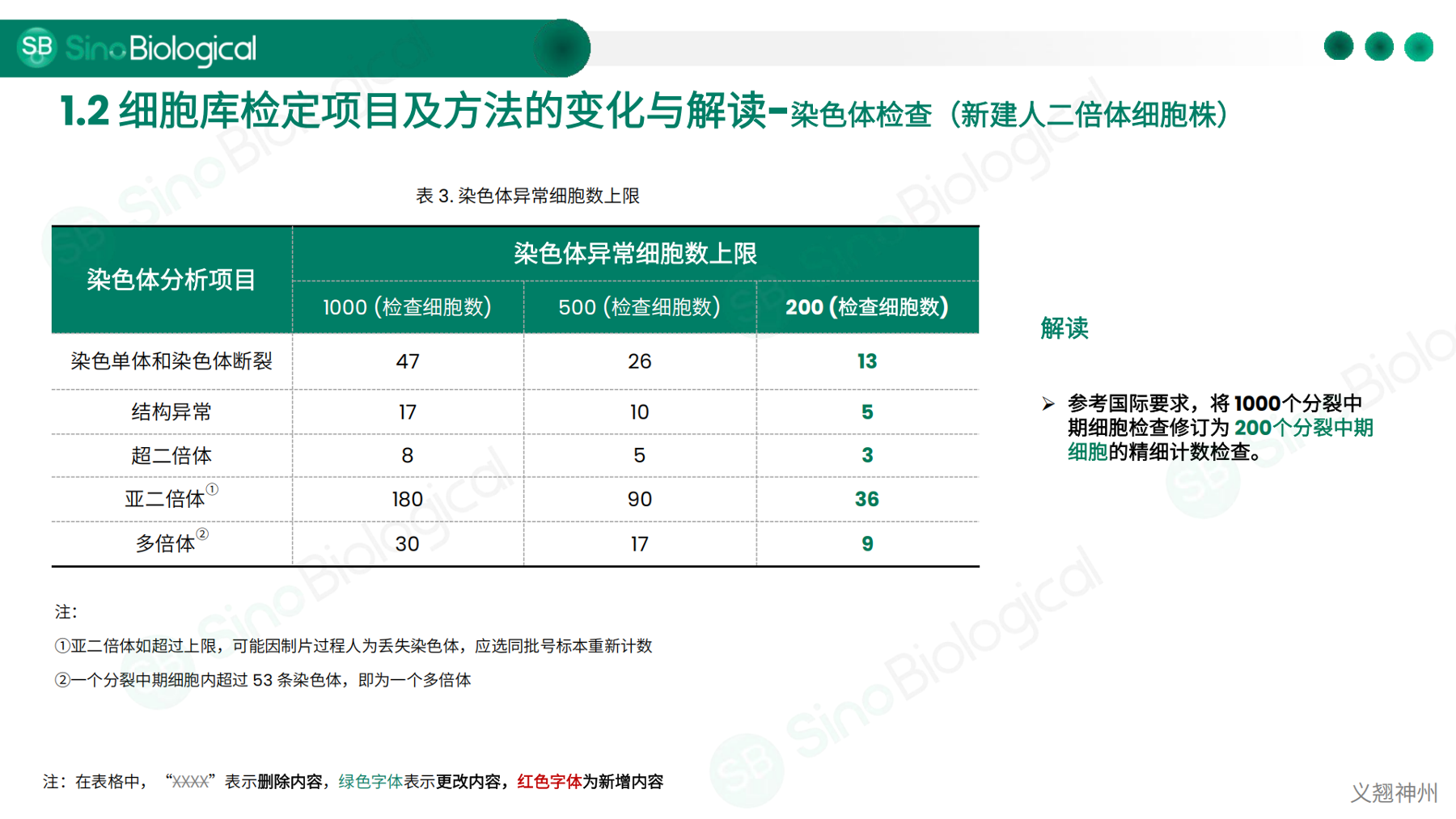
• 2025版《中国药典》中细胞库检测的变更及解读
• ICH Q5A (R2) 与2025版《中国药典》中病毒清除验证的变更及解读
• 病毒安全性检测国内外申报策略的差异分析