Cell Stem Cell:曾安组合作揭示心脏再生关键细胞
2025-11-12 18:00点击次数:23
关键词:在全球范围内,心血管疾病是导致人类死亡的首要原因,其中心肌梗死是最常见且最致命的类型之一。心肌梗死后,大量心肌细胞不可逆死亡,伴随急性炎症反应与成纤维细胞活化,最终形成瘢痕组织,导致心室重构和心功能衰竭。与此形成鲜明对比的是,斑马鱼、蝾螈等脊椎动物,以及出生后短时间内的小鼠心脏,均具备显著的心脏再生能力。例如,新生小鼠在心尖切除后,可通过现存心肌细胞的增殖实现组织结构和泵血功能的完全恢复,但这种能力会在出生后一周内迅速丧失。为何幼年心脏能够再生,而成年心脏失去这一潜能,一直是心脏再生领域亟待解决的核心科学问题。
2025 年 11 月 7 日,国际学术期刊 Cell Stem Cell 在线发表了中国科学院分子细胞科学卓越创新中心 (生物化学与细胞生物学研究所) 曾安研究组与上海市第一人民医院周志刚团队的合作研究成果,题为「Injury-induced Clusterin⁺ cardiomyocytes suppress inflammation and promote regeneration in neonatal and adult hearts by reprogramming macrophages」。
研究鉴定出在心脏损伤后特异诱导的 Clusterin⁺ (Clu⁺) 心肌细胞亚群,并系统阐明了其通过调控巨噬细胞、协调炎症消退与组织修复、激活再生信号的作用机制。基于这一发现,研究团队进一步构建了高表达 CLU 的工程化心脏类器官,并验证其在成年小鼠心肌梗死后的修复与功能恢复中的潜在应用价值,为缺血性心脏病的再生治疗提供了新的研究思路与技术方向。

单细胞多组学结合双重重组酶遗传示踪鉴定心脏再生关键亚群
在解析新生小鼠心脏再生机制的过程中,研究团队利用单细胞与空间转录组技术,对不同发育阶段心脏损伤模型进行了系统比较。结果显示,尽管大多数心脏细胞类型在不同阶段均可检测到,但 Clu⁺ 心肌细胞几乎仅在具备再生能力的新生期 (P1) 心脏中富集,而在 P8 及成年心脏中极为罕见。
空间分布分析显示,Clu⁺ 心肌细胞主要位于损伤边缘区域,构建出有利于组织修复的再生微环境。通过遗传谱系追踪进一步验证发现,Clu⁺ 心肌细胞仅在新生期损伤后诱导产生,而在未损伤或 P8 心脏模型中几乎无法检测到。双重组酶介导的细胞消融结果证实,Clu⁺ 心肌细胞对幼年期心脏再生是必须的。结果表明该细胞群是新生心脏中由损伤激活的再生特异性心肌细胞亚群。
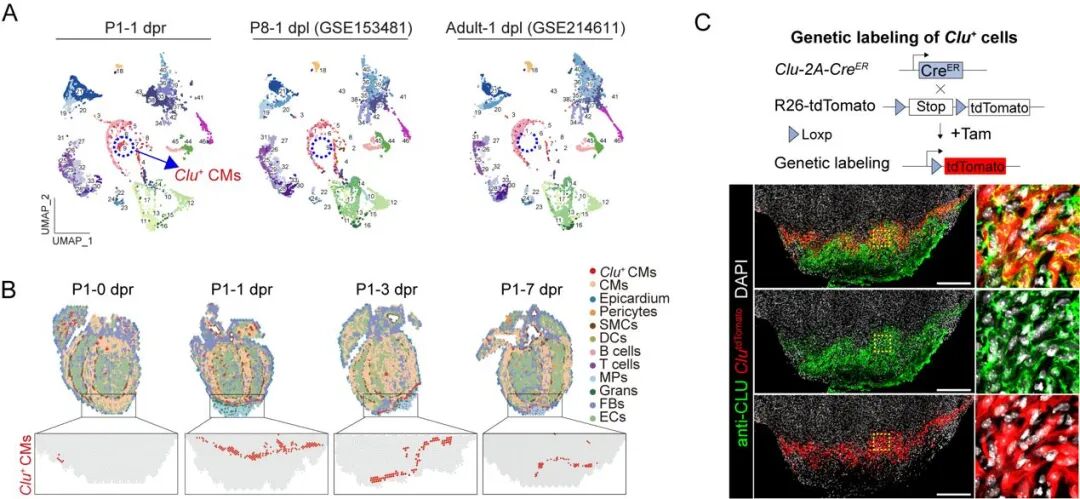
时空多组学结合遗传谱系示踪鉴定心脏再生关键亚群
再生关键因子 CLU 的功能验证
研究团队利用体内功能筛选体系,确认 CLU 是 Clu⁺ 心肌细胞介导心脏修复的关键效应分子。在心肌细胞特异性 Clu 基因敲除小鼠中,Clu 缺失并不影响正常发育下的心脏结构和功能,但在新生期损伤后会显著抑制心肌细胞增殖、增加凋亡和纤维化,从而损害心功能恢复,提示 CLU 对新生期心肌修复不可或缺。相反,在诱导性 Clu 过表达模型中,无论是 P8 小鼠还是成年心肌梗死模型,Clu 激活均能显著增强心肌细胞增殖、减少瘢痕形成并改善射血分数 (EF) 与缩短分数 (FS) 等指标。磁共振成像结果显示,Clu 激活能够有效缓解心室扩张与室壁变薄趋势,使心功能恢复接近正常水平。这些结果说明,CLU 是新生心脏再生的重要调控因子,其外源激活可促进成年心脏的再生潜能。
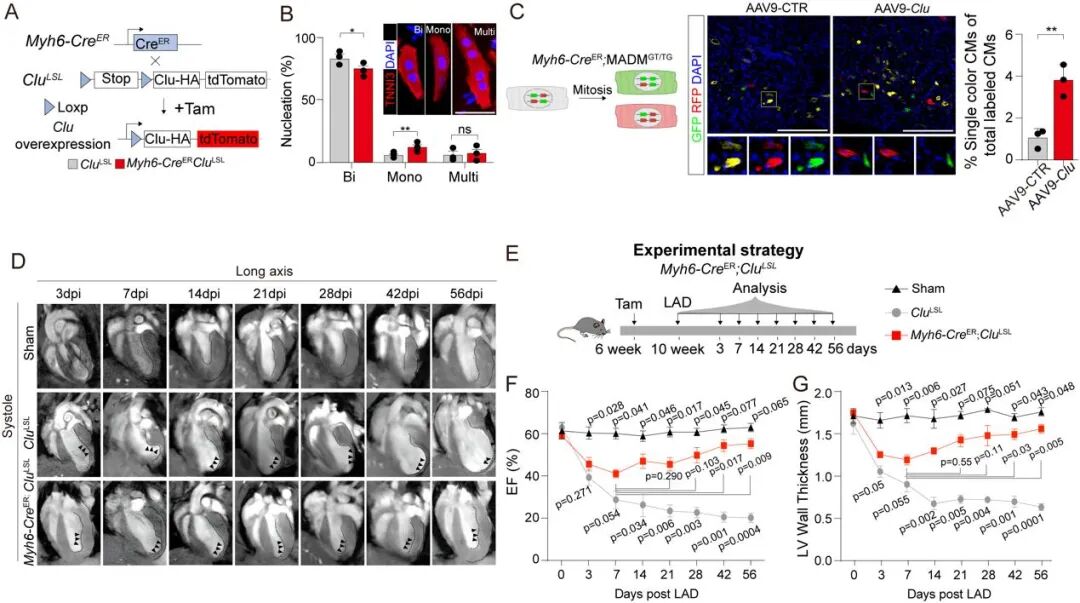
Clu 过表达促进心肌细胞增殖并改善心脏功能
CLU 重塑再生免疫微环境驱动心脏修复
机制研究显示,CLU 通过调节巨噬细胞的代谢状态与分泌模式,促使其由促炎表型向抗炎/修复型转变,从而支持心肌细胞的再生。单细胞测序结果表明,Clu 过表达可扩增抗炎巨噬细胞群体,减少炎性亚群,并呈现出与新生期心脏再生阶段一致的转录特征。进一步的转录组与功能分析发现,CLU 诱导的巨噬细胞显著上调骨形态发生蛋白 BMP2 的分泌,而 BMP2 通过心肌细胞受体 BMPR1A,促进心肌细胞进入增殖周期。这些结果表明,CLU 通过诱导巨噬细胞极化并调控其 BMP2 分泌,形成促增殖的免疫 – 再生轴,有助于实现心脏组织的修复。
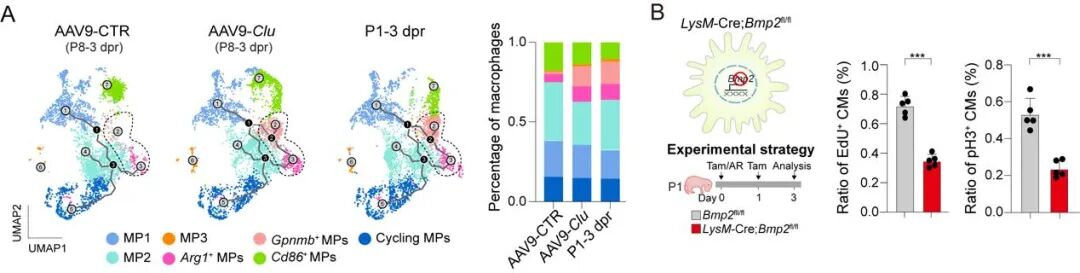
Clu 过表达重塑心梗区域免疫微环境
工程化心脏类器官的再生治疗潜力
临床相关性分析显示,心肌梗死患者血清 CLU 水平显著下降,并与心功能受损程度密切相关。为探索临床转化路径,研究团队构建了人胚胎干细胞来源的心脏类器官,并诱导其高表达 CLU。将这些工程化的 CLU⁺ 类器官移植至急性心肌梗死小鼠的损伤边缘区后,类器官能够稳定存活并与宿主组织整合。功能评估显示,CLU⁺ 类器官显著促进心肌细胞增殖,改善心脏收缩功能,并营造抗炎修复的微环境。该结果提示,基于 CLU 调控机制的工程化心脏类器官在缺血性心脏病再生治疗中具有良好的应用潜力。
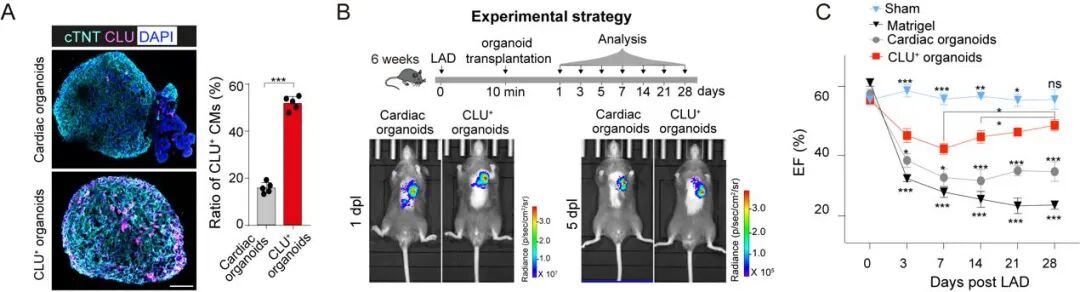
工程化人源心脏类器官的移植促进心梗后功能恢复
综上所述,本研究通过多组学与功能实验相结合,解析了新生心脏再生过程中由损伤诱导的 Clu⁺ 心肌细胞的特征及作用机制,揭示了其通过免疫重塑驱动心肌修复的分子通路。同时,研究结果证明该通路在成年心脏中具备可塑性,为未来开发促进心脏再生的干预策略提供了理论依据。利用 CLU⁺ 工程化类器官实现功能修复的成果,展示了将基础机制转化为潜在临床应用的可行路径,为心梗后心脏功能重建提供了新的研究方向。目前,相关研究正向临床前验证阶段推进。
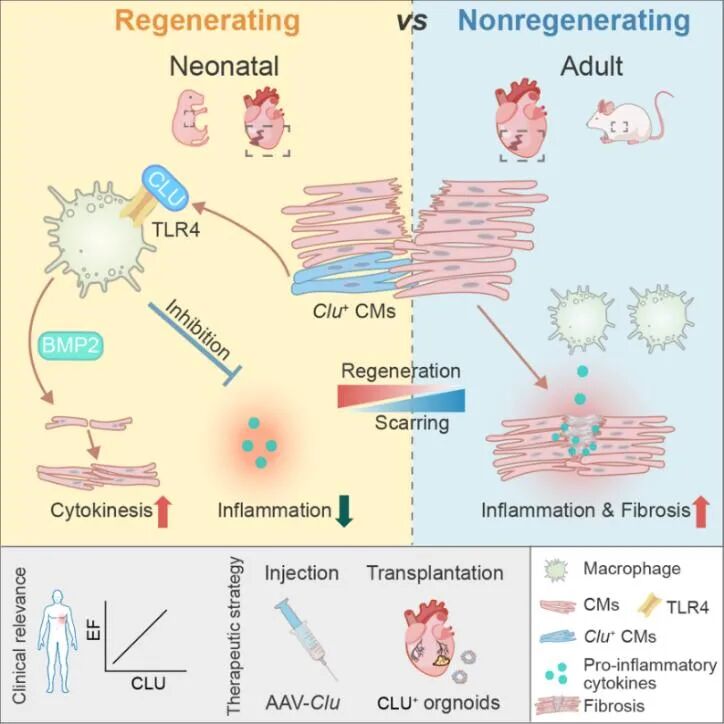 Clu⁺ 心肌细胞亚群促进心脏再生的机制模式图
Clu⁺ 心肌细胞亚群促进心脏再生的机制模式图
中国科学院分子细胞科学卓越创新中心范磊博士后、博士研究生唐琦、博士研究生王钰童为该论文的共同第一作者。中国科学院分子细胞科学卓越创新中心曾安研究员和上海交通大学医学院附属第一人民医院周志刚副主任医师为该论文的共同通讯作者。该项研究工作得到了科技部重点研发、国家自然科学基金、中国科学院战略性先导科技专项、上海市科学技术委员会、生物医学峰基金等资助;并得到了分子细胞科学卓越创新中心细胞生物学技术平台、化学生物学技术平台、动物实验技术平台和斑马鱼等平台的支持。

曾安组长期从事器官再生的细胞和分子机制研究。近年来,其研究成果以第一作者或通讯作者 (含共同) 发表在 Cell、Nature Genetics、Cell Stem Cell、Cell Research 等国际高水平学术期刊。研究组长期招收具有组织再生、免疫学、细胞或干细胞生物学、心血管疾病、生物化学及生物信息学等研究背景的优秀博士后,并提供良好的科研条件、经费支持与交叉学科学术发展环境
(联系邮箱:azeng@sibcb.ac.cn)。
原文链接:
https://www.cell.com/cell-stem-cell/abstract/S1934-5909(25)00376-5
来源:论道心血管
如需代发文章宣传、新闻稿、招聘等,请后台回复【学术】添加小编
我们长期为科研用户提供前沿资讯、实验方法、选品推荐等服务,并且组建了 70 多个不同领域的专业交流群,覆盖神经科学、肿瘤免疫、基因编辑、外泌体、类器官等领域,定期分享实验干货、文献解读等活动。
添加实验菌企微,回复【】中的序号,即可领取对应的资料包哦~
【2401】论文写作干货资料(100 页)
【2402】国内重点实验室分子生物学实验方法汇总(60 页)
【2403】2024 最新最全影响因子(20000+ 期刊目录)
【2404】免疫学信号通路手册
【2405】PCR 实验 protocol 汇总
【2406】免疫荧光实验 protocol 合集
【2407】细胞培养手册
【2408】蛋白纯化实验手册
【2501】染色体分析方法汇总
【2502】国自然中标标书模板
【2503】WB 实验详解及常见问题解答
【2504】DeepSeek 论文写作常用口令
【2505】中国科学院期刊分区表(2025 年最新版)
【2506】期刊影响因子(2025 年最新版)
【2507】130 种实验室常用试剂配制方法(附全套资料)
【2508】常见信号通路
【2509】限制性核酸内切酶大全