Wb小白求助各位大佬 肠occludin
dxy_25nzo3v5
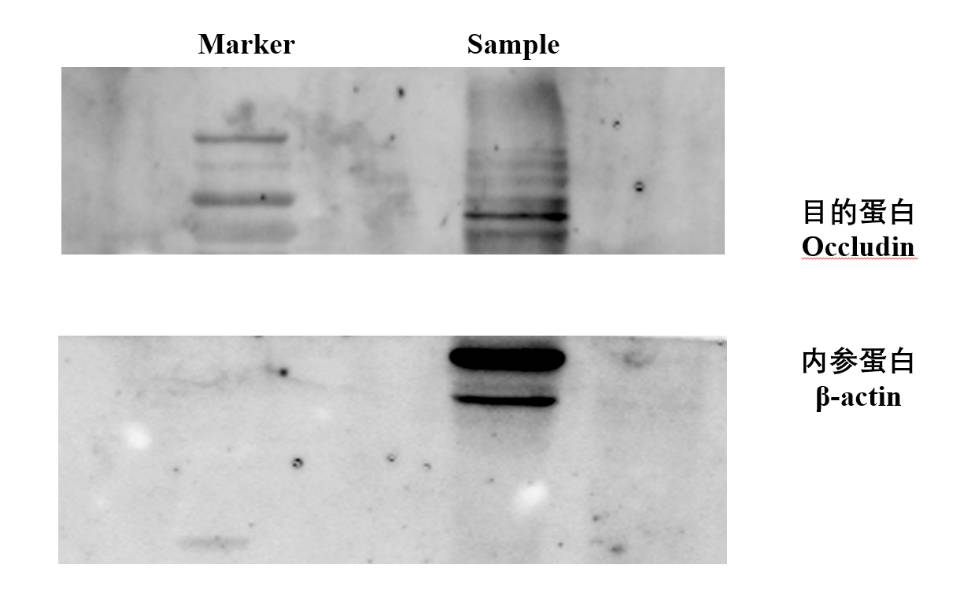
第一次做WB,大佬们求指点
目的蛋白,肠组织occludin,转膜300mA,1h,封闭2h,一抗孵育12h,二抗孵育2h,一抗稀释1:1000,内参1:2000,二抗稀释1:5000。一抗稀释用的5%脱脂奶TBST,二抗用的TBST孵育。
- 1、肠组织上清黄的正常吗?测出来浓度14ug/ul。难道我剪的时候要洗一下吗?里面有脂肪和粘液?到底怎么剪怎么处理合适呢。
- 2、如果目的蛋白条带这个是拖尾吗?还是别的?条带如果因为是蛋白降解,是因为提取过程中吗?我用的沸水煮,我是不是应该温度低点?或者超声产热导致的?
- 3、跑胶的时候,marker挺齐的,你们是转膜前就把目的内参切开了,就是切胶,还是转完膜切胶啊?我的目的和内参离得好近,不太好乱切,你们用的剪刀还是小刀,我的剪的好歪
- 4、封闭的时候你们1还是2小时,我用的2小时,是太久了吗?转速这时候应该快还是慢呢?我的摇床是左右像跷跷板那种,有用这种的吗,你们转速多少啊!!
- 5、一抗孵育,有的说室温晃半小时再4°静置过夜,过夜后再室温晃0.5h,回收一抗,有必要这两个室温0.5h吗?我用的5%奶tbdt稀释的,合适吗
- 6、二抗孵育,转速你们是多少啊,我孵育了两小时?太久吗?
- 7、显色液你们放在小盒子里吗!!我放小盒子配AB液的时候,用体积8ml都不够,你们怎么放的,一次10ml好浪费啊,我一瓶才12.5ml救命!!
- 8、显色的时候,你们放膜是在润饰的状态下放的吗,我有气泡!!!放的时候!!救命啊!!
- 9、曝光时间几秒和几分钟我都试了,我不知道怎么判断哪个时间是合适的,他们都有条带显示
分享
1 个回答
dxy_18063lu9
有帮助
请问你跑出来了吗??用什么参数?条带怎么样?
相关产品推荐

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin Protein (HA1 Subunit) (His Tag)
¥4520

4h快速WB即用型全流程试剂盒(WB检测试剂盒)(Western Blot Kit)
¥320

iBind(Flex) 蛋白质免疫印迹处理系统
询价

Cytochrome c 兔多抗(WB,IHC-P,ICC/IF)
¥999

Influenza A H15N2 (A/Australian shelduck/Western Australia/1756/1983) Hemagglutinin / HA Protein (His Tag)
¥4520
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序



