分子实验
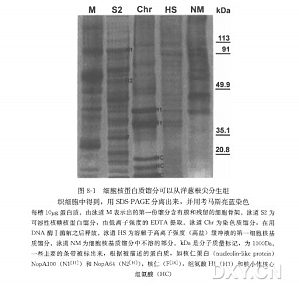
在所有活细胞中质膜(PM )作为细胞质和环境之间的界面而存在,并且是最复杂的和分化程度最高的膜之一。由于其中许多蛋白质参与了细胞的基本职能如细胞信号传递、渗透调节、营养和代谢,因此膜蛋白的鉴定和功能分析(无论是外在或内在的)是一个至关重要的挑战。分离 PM 的方法依据有机体、组织、细胞类型的不同而改变。本章主要是通过两相分离系统从拟南齐微粒体膜中分离 PM,主要运用不同膜具有不同的表面特性,质膜蛋白不能跨越脂质双层,并且经过双向电泳能很好复原。相比之下,跨膜蛋白质的复性首先需要从可溶性蛋白中除去质膜部分,要么是细胞内的污染物,或功能相关的蛋白质,其次是具体溶解方案的使用。本章介绍分离质膜的方案是基于膜的碱处理来溶解疏水性蛋白只增加它们在双向电泳凝胶中的复原性。高度疏水的水通道蛋白用于检测方案中相关物质。
植物细胞壁是植物细胞具有高动态和化学活性的组分。细胞壁主要成分是多糖类,以及约占细胞壁体积 10% 的蛋白质。这些蛋白质很难以高纯度从碳水化合物复合体基质中分离。基质不仅固着了蛋白质而且是后续 2-DE 分析的污染物。成熟植物组织由于形成了包含酚类混合物的次级细胞壁给分离工作带来了更大的挑战。本章将讨论细胞壁中蛋白质的提取并且介绍一种从紫花苜蓿茎中分离细胞壁蛋白质的具体方法。包括研磨裂解细胞的方法,把细胞质蛋白和小分子污染物去除的多种洗溱方法包括水和有机溶剂的方法以及两种不同的盐抽提的方法。其中盐抽提的方法能够从紫花苜蓿茎的细胞壁中获得高浓度的细胞壁蛋白质片段。经过商业纯化试剂盒处理后,蛋白质提取物进行高质量和高分辨率的 2-DE 分离,从而能够通过质谱的方法较容易地得到鉴定。
亚细胞组分如细胞核的蛋白质组的完整性很大程度上由纯化过程中是否将其他细胞污染物从分离到的组分中除去决定。从植物中分离高纯度的细胞核是一个困难的任务。尽管如此,通过一系列的分离步骤,人们已经能够纯化细胞核。最初,人们利用 2.0 mol/L 蔗糖密度梯度离心或 Percoll 密度梯度离心的方法从水稻悬浮细胞中分离细胞核。Morre 和 Anderson 报道了的一种改进的蔗糖密度梯度离心方法。该方法被证明能从水稻悬浮细胞中更加快速有效地提取核。细胞核是平均直径约 20 μm 的均匀球体。核蛋白使用裂解缓冲液或 SDS 样品缓冲液由纯化后的核中制备得到。核蛋白的纯度通过使用抗组蛋白 H1 抗体的 Western 杂交分析来评估。抗组蛋白 H1 抗体是一种核蛋白的特异抗体。我们在核组分中发现组蛋白 H1,但上清液中没有。这说明制备产物富含核蛋白。
核蛋白的分离和提取促进了植物蛋白质组学的研究。这项技术依赖亚细胞分离,用其可以鉴别出一个亚细胞器的蛋白质组,这项技术也被用于细胞核。核蛋白质分离方法是根据在不同离子强度的缓冲液中蛋白质溶解度不同而提出的。这套物理标准,配合着某些步骤中其他试剂的使用,如去垢剂或酶,产生出的分离成分在功能上也得到了验证。这套方法可以出产 5 份馏分,第 1 份馏分中含有和核膜及细胞骨架相关的蛋白质。第 2 份馏分可以溶于低离子强度浓度,含有活跃于核 RNA 代谢的核糖核蛋白。在增加离子强度和用脱氧核糖核酸酶酶解之后,会产生染色质馏分。最后,将得到有关核基质的第 4 份和第 5 份馏分,它们会分别以溶解在高盐浓度溶液中或者以沉淀的形式存在,这种沉淀只有在超声波条件下,7 mol/L 尿素中溶解。这种方法有着宽泛的适应性,可以应用于基因组未测序的植物中。总之,利用本章中讲述的提取方法的功能性标准可得到有价值的、有用的信息。
植物细胞线粒体执行着一系列重要的生化过程。其中最重要的就是通过三羧酸循环(TCA)氧化降解有机酸的反应。这一反应过程中发生了一系列经由电子传递链的电子传递反应,同时生成 ATP。除此之外,线粒体还具有许多其他重要的功能,如核酸、氨基酸、脂质及维生素等有机化合物的合成,从胞质中通过其膜上蛋白复合体输入蛋白质及代谢物,感受细胞外信号(如氧化环境),影响植物细胞的程序性死亡等。线粒体含有自身的遗传物质DNA,因此,其内也能发生转录和反应等生化过程。要想全面准确地阐明线粒体的产生、功能及其与细胞核之间的信号交换机制,就必须对线粒体的蛋白质构成有比较详细的了解。分离线粒体并对分析其蛋白质组在线粒体发育和应答外界环境信号过程中的变化的工作已有进行。本章主要提供一种从植物不同组织中分离线粒体,并对线粒体进行保存和纯度测定的方法。同时,提供了对线粒体膜结构以及基质内可溶性蛋白质进行分级分离的方法。最后所得的样品适合于进行线粒体蛋白质组分析。
本章介绍了一种简单实用的大规模分离纯化叶绿体的方法。本方法的优点是产量高、污染低并且蛋白质的降解少。分离出来的叶绿体样品适用于进行蛋白质组分析。
在这一章内,我们将介绍一种从木材形成的组织(分化中的次生木质部)中提取总蛋白的方案。这套方案被用于一系列的阔叶植物( 橡树和白杨)和针叶植物(松树)的植物器官(根、叶、花粉、芽、花、形成层和韧皮部)。蛋白质首先在液氮中用 TCA-丙酮方法从粉末状组织中提取出来溶解在缓冲液中。2D凝胶实验结果可参见:http://cbi.labri.fr/outils/protic/index.php.
众所周知,高等植物体内木质部和初皮部的维管负责长距离运输营养小分子。但是人们并没有预计到这两种运输汁液中也存在蛋白质,对于这些蛋白质的功能没有深入地研究。本章中将要描述如何从木质部和初皮部的汁液中提取及提纯蛋白质进行蛋白质组学分析。
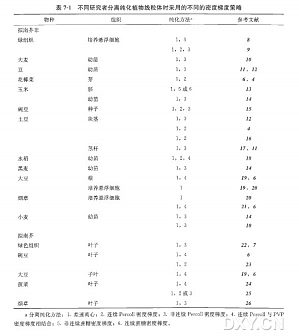
种子中可能含有不同的成分,像淀粉和多糖,它们会严重降低蛋白质的提取量。谷类植物种子中的蛋白质据其溶解性通常分为 4 类:白蛋白(albumin) 、球蛋白 (globulin) 、醇溶蛋白(prolamin) 和谷蛋白(glutelin) ,它们可以分别提取出来。本章描述一种从绿色种子或未成熟的谷类植物子粒中提取蛋白质的方法。改良了多个步骤以提取以下蛋白质:① 所有的贮藏蛋白质 ( 大部分的醇溶蛋白和谷蛋白);② 用盐缓冲液提取白蛋白-球蛋白;③ 使用相分配法提取两性蛋白质;④ 强力吸附于或含于种子胚乳淀粉粒的蛋白质。这些方法已经成功应用于双向电泳和蛋白质组学分析。
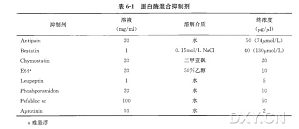
蛋白质提取除了经典的三氯乙酸(TCA )/丙酮沉淀方法外,另一个可行的方法是苯酚提取法,该方法可以从富含多糖、脂质和酚类化合物的植物组织中有效地获得蛋白质,并去除非蛋白质成分。本章提出一种改良的实验方法,可用于双向电泳(2-DE) 和进一步的蛋白质组学研究。苯酚提取之后,蛋白质在甲醇中和乙酸铵一起沉淀,沉淀重悬于等电聚焦缓冲液(isoelectric focusing buffer) ,电泳前用改良的 BradfordA ssay 方法测定蛋白质浓度。 成功使用这个方案的关键点有两个:① 在第一步中使样品保持低温状态;② 在离心后小心转移到苯酚层。
本章我们介绍一种适用于各种植物组织全蛋白抽提的高效方法。该方法利用三氯乙酸和含有巯基乙醇的丙酮在沉淀蛋白质的同时使其变性。同时,我们还将介绍分别在进行经典的 IEF 电泳或用IPG 胶条电泳之前的蛋白质溶解方法。整个过程简单易行,但在操作过程中必须注意以下两点:① 抽提必须在低温下进行;② 蛋白质溶解过程应在 22~25℃ 条件下进行以免尿素沉淀。
转基因风险评估对于相关的法规、通告和准则的决策过程起着重要作用。转基因风险评估最基本的作用之一是确保安全处理和控制转基因生物;另一个作用是评估对环境和人类健康存在的任何潜在影响。风险评估应该在科学的基础上回答所有“如果”情况下的影响因素。本章提供给广大科研人员有益的指南,帮助他们开展转基因生物风险评估工作。尽管我们参考的是英国和欧盟的法规,但是考虑到的基本原则和要点,适用于大部分国家。
随着转基因技术体系的发展,异源基因转入植物基因组已成为可能,这为植物育种家拓展遗传资源提供了一条新途径。转基因作物田间试验的设计与管理因目的不同而异。育种家分析转基因作物的基因型和表现型的稳定性,记录田间条件转基因纯合个体数的变化,并运用回交法将转化导入的基因转育到新受体基因型等。育种家还需要扩繁转基因作物,以获取足够的种子数量,分析有关性状,检验转基因系的田间表现、比较转基因材料与受体亲本之间的差异。在品种登记和释放之前,还需要开展品种的特异性、一致性和稳定性田间测定( 即DUS测定)及栽培与利用评估试验( 即 VCU试验)。转基因作物田间试验还包括一项特殊要求,即评估可能的环境风险。依据欧盟对转基因高等植物环境释放的2003/701/EC [ 1 ] 条例,特别注意监测转基因作物在大田环境下花粉的存活力和传播能力、基因转移的可能性、导入序列的表达产物的作用、基因型与表现型的不稳定性可能出现的有害效应等。
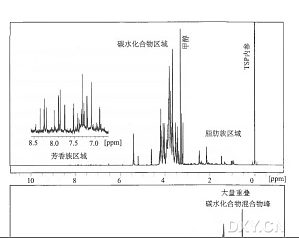
现代 “代谢组学”方法可用于自动比较大量样本中一些结构不一的化合物含量。该技术非常适合于筛选植物群体,包括发现转基因引起的非预期效应。目前已有几种可用于实质等同性分析的代谢组学方法。我们开发了一种利用[ 1H ] -NMR 指纹识别筛选植物的代谢组学方法,并利用它分析田间生长的转基因小麦的实质等同性。本文以研究来源于试验田的小麦所加工的面粉为例,描述了该方法的原理和细节。本文重点描述了下游数据处理和通过多变量分析对光谱进行比较,以此来评估在自然环境引起的变异为背景的转基因所导致的代谢组变化。
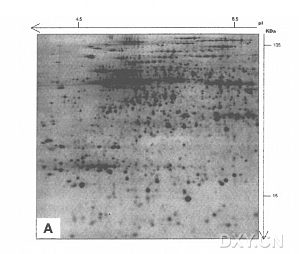
小麦作为全球主要农作物之一,被加工成一系列食品供消费者消费。因此,确定转基因技术对小麦的影响(预期的和非预期的),以及转基因品系与常规育种品系是否实质等同,具有十分重要的意义。蛋白质组学分析是解决这些问题的途径之一。双向聚丙烯酰胺凝肢电泳(2D-PAGE) 仍然是蛋白质组学研究中最广泛使用的方法,然而众所周知,它在不同实验室难以重复。因此本文介绍的是在我们实验室开发的分析小麦谷粒蛋白的标准操作程序,可确保双向电泳蛋白质组学研究的可重复性。
在西欧,转基因作物想获批商业生产,需要向监管部门提供它们与常规育种作物实质等同性的证明。建立转基因作物与常规育种作物实质等同性的途径之一就是比较两者发育过程的籽粒和其他组织的转录产物特征,以发现任何非预期转基因效应。本章提出了在转录水平上比较小麦籽粒和叶片材料的详细方法,并以胚乳特异启动子控制的外源谷蛋白基因转化系的研究为例,阐述研究的方法。结果表明,这些转基因系转入的基因,包括那些编码标记基因,对内源基因的表达没有任何显著的预料之外的影响,因此,转基因植物与其供体亲本是实质性等同的。
继玉米和水稻转基因成功之后,现已开发了高效的小麦 、大麦和燕麦转基因方法。本章对这三种作物转基因研究现状进行了叙述 ,并运用田间试验数据资料和专利文献,评述了未来转基因材料开发与利用的前景,分析了转基因作物的一些农艺性状 ,还讨论了其在生物燃料和生物制药等领域的研究拓展与机遇。
在过去 30 年中,荧光染色体分析技术促进了人们对基因组构造的了解,并加深了对 DNA 的组织结构及染色体进化的认知。通过荧光染色,即便小型染色体也可以检出,并且可以获知其组分、形态结构及进行染色体计数,可以确认物种、选系和单株的染色体非整倍性及多倍性,包括杂交或组培及遗传转化导致的染色体变异。
在过去的 25 年里,转基因植株中外源基因插入模式和位点的研究,极大地有助于人们认识植物核基因组中外源基因的整合、表达和稳定遗传的机理。同时,分子鉴定对于转基因作物的安全评估也是一个必要的步骤。因此,本章主要介绍通过根癌农杆菌介导转化,或外源 DNA 直接转化方法所获得转基因禾谷类作物和牧草中,外源基因插入模式和位点数目的标准分析流程及鉴定方法。基因组中外源基因的数目和分布情况,主要通过遗传研究、PCR 和 Southern 分析相结合的方法进行鉴定。但是,仅仅依靠这些方法,并不足以完全掌握外源基因在植物中的分布情况,如要进行精确鉴定,还需借助其他试验方法的综合分析。本章并未对这些额外方法进行详细描述,仅提供相关书籍以供读者参阅。
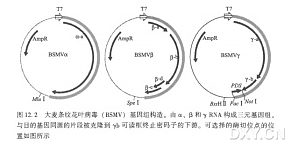
通过转录后水平基因沉默(PTGS) 使内源基因下调表达是鉴定植物基因功能的一把钥匙。在植物、真菌和动物界不同的物种中已经发现许多基于 RNA 水平的沉默机制,如转录后水平基因沉默、共抑制、基因压制和 RNA 干扰(RNAi ) 。其中,RNAi是最令人感兴趣的发现之一。它是一种由双链 RNA ( dsRNA) 引发的、具有序列特异性的基因沉默机制,将与目的基因序列同源的双链 RNA 导入体内,可引起该基因编码的 mRNA 降解。用改造的病毒侵染植物也能诱导 RNA 沉默,称之为病毒诱导的基因沉默(VIGS) 。与插入突变相比,这些新兴的反向遗传学方法为在大麦和小麦等谷物物种中挖掘功能基因和操控基因的表达提供了更有力的实验工具。本章介绍如何在大麦和小麦中运用 RNAi 和 VIGS 技术研究基因的功能,包括该过程涉及的分子机制及常用的材料和方法,如载体、接种过程和沉默表型分析。