细胞转染技术
1.确定抗生素作用的最佳浓度: 不同的细胞株对各种抗生素有不同的敏感性,因此在筛选前要做预试验,确定抗生素对所选择细胞的最低作用浓度。 ①提前 24 小时在 96 孔板或 24 孔板中接种细胞 8 孔,接种量以第二天长成 25%单层为宜,置 CO2 孵箱中 37℃培养过夜。 ② 将培养液换成含抗生素的培养基, 抗生素浓度按梯度递增0(50 100 200 400 600 ...
磷酸钙共沉淀 将氯化钙,RNA(或DNA)和磷酸缓冲液混合,沉淀形成包含DNA且极小的不溶的磷酸钙颗粒。磷酸钙-DNA复合物粘附到细胞膜并通过胞饮进入目的细胞的细胞质。沉淀物的大小和质量对于磷酸钙转染的成功至关重要。在实验中使用的每种试剂都必须小心校准,保证质量,因为甚至偏离最优条件十分之一个pH都会导致磷酸钙转染的失败。
转染 ,是将外源性基因导入细胞内的一种专门技术。随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。转染大致可分为物理介导、化学介导和生物介导三类途径。
详细描述了进行成年小鼠趾短屈肌和骨间肌纤维DNA转染时的体内电穿孔术。要想有较高的转染效率,必须严格按照要求的步骤进行。
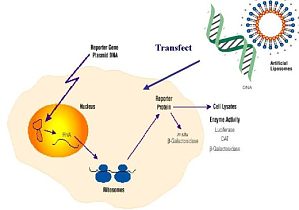
瞬时转染分析研究的步骤 1.瞬时转染分析法 目前有很多功能性分析方法用于研究转录调控,最常用的方法是瞬时转染分析法。该方法是通过一定的转染程序将含目的调控区的质粒导人培养细胞。在典型情况下,调控区调控“报告基因”的转录。报告基因是在mRNA和蛋白质的水平上都易于被正确检测到的基因。产生的质粒在培养细胞中转录后,在特定时刻测定从报告基因上合成的mRNA或蛋白质,以评价调控区的活性。人们 ...
Note: This protocol has been optimized for Cos-1 cells. Successful transfection of each cell type requires optimization of the basic protocol. Variables to consider for optimization include but are no ...
德国明斯特的马普分子生物医学研究所汉斯·舒勒领导的一个研究小组成功地利用分子机理,使实验鼠细胞的“复位”过程变得更加有效,如果这项最新成果能应用于人类,对患者自身干细胞的修复将迈出重要的一步。这项研究成果刊登在最新一期的《细胞》杂志上。
细胞转染方法包括DEAE-葡聚糖法, 磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic 颗粒传递法 (基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表。
利用冰冷的CaCl2 制备competent cells以传统方法进行质体的转形。 仪器用具:37℃培养箱;42℃水浴;冰浴 药品试剂: 0.1 M CaCl2置冰浴中 2 M glucose: 取18 g glucose溶于水中,并调体积至50 mL,无菌过滤,分装后置 -20℃贮存。 2 M Mg2+: 取20.3 g MgCl2 · 6H2O及24.65 g MgSO4 &mi ...
取80 mL SOB培养基装入250 mL灭过菌的三角瓶。 另取1 mL SOB加于微量离心管中。由SOB固体培养基上选8 个约2~3 mm大小的单一菌落接入1mL SOB中,震荡将菌体打散后,加入80 mL SOB中,于37℃震荡培养约2~3h,直至细胞数约为4~7×107/mL.
文章作者介绍了一种基于脂质体的高效siRNA转染方法。利用该protocol,可以在CCE细胞达到98%的转染效率,在D3细胞达到80%的转染效率,并且对干细胞的形态没有影响。
DEAE-葡聚糖介导的转染,其原理还不清楚,可能是通过内吞噬作用而使DNA转导进入细胞核,此法只适合暂时转染实验,转染效率与DEAE-葡聚糖浓度以及细胞与 DNA/DEAE-葡聚糖混合液接触时间的长短很有关系,可采用较高浓度的DEAE-葡聚糖(1g/L)作用较短时间(30分钟-1.5小时),又可用较低浓度(250g/L)的DEAE-葡聚糖作用较长时间(8小时)。 方法如下: (1)接种鼠L成纤维细 ...
脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy, Propyl]-n, n,n-Trimethylammonium Chloride(DOTMA)和Dioleoyl photidye-thanolamine(DOPE)的混合物[1:1(w/w)]。它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。
核酸以磷酸钙-DNA共沉淀物的形式出现时,可使DNA附在细胞表面,利于细胞吞入摄取,或通过细胞膜脂相收缩时裂开的空隙进入细胞内,进入细胞的DNA仅有1%~5 %可以进入细胞核中,其中仅有不到1%的DNA可以与细胞DNA整合,在细胞中进行稳定表达,基因转导的频率大约为10-4,这项技术能用于任何DNA导入哺乳类动物进行暂时性表达或长期转化的研究。此方法对于贴壁细胞转染是最常用并首选的方法。 1、配液 ...
学习和掌握外源基因导入真核细胞的主要方法——脂质体介导的转染。了解外源基因进入的一般性方法,观测外源蛋白的表达(绿色荧光蛋白),为染色准备实验材料。上图所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和病毒介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入……
各种转染方法比较:DEAE-葡聚糖法、磷酸钙法、阳离子脂质体法、阳离子聚合物、病毒介导法、Biolistic颗粒传递法(基因枪粒子轰击法)、显微注射法、电穿孔法。
一些真核蛋白在原核宿主细胞中的表达不但行之有效而且成本低廉,然而许多在细菌中合成的真核蛋白或因折叠方式不正确,或因折叠效率低下,结果使得蛋白活性低或无活性。不仅如此,真核生物蛋白的活性往往需要翻译后加工,例如二硫键的精确形成、糖基化、磷酸化、寡聚体的形成或者由特异性蛋白酶进行的裂解等等,而这些加工原核细胞则无能为力。需要表达具有生物学功能的膜蛋白或分泌性蛋白,例如位于细胞膜表面的受体或细胞外的激素 ...
alimama_pid="mm_10043573_137377_1822161"; alimama_titlecolor="FF9900"; alimama_descolor ="552c55"; alimama_bgcolor="f7f7f7"; alimama_bordercolor="f7f ...
脂质体(lipofectin regeant,LR)试剂是阳离子脂质体(DOTMA)和(DOPE)的混合物[1:1(w/w)]。它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。
alimama_pid="mm_10043573_137377_1822161"; alimama_titlecolor="FF9900"; alimama_descolor ="552c55"; alimama_bgcolor="f7f7f7"; alimama_bordercolor="f7f7f7"; alimama_linkcolor="552c55"; ...