更多资讯
Evident 产品专家经验分享
Evident 产品专家经验分享
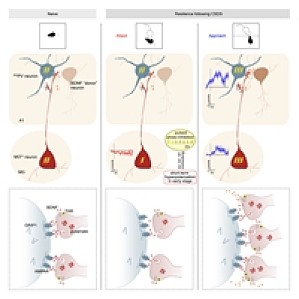
研究背景「应激」是抑郁症发病的主要原因,然而,当面对应激和创伤时,并不是所有人都将发展为抑郁症,甚至有些抑郁症患者能够「自复原」,提示机体存在对抗负性应激的能力,称为「心理韧性」。「心理韧性」是指机体以健康的方式从应激、创伤或长期逆境中恢复的能力。阐释「心理韧性」的生物学机制可能为精神疾病防治开辟新途径。研究内容与结果2023 年 3 月 30 日,琶洲实验室朱心红教授研究团队在 Cell 在线发表题为 A thalamic-primary auditory cortex circuit mediates resilience to stress 的研究成果[1]。该工作发现了面对应激时,抑郁非易感小鼠内侧膝状体谷氨酸能神经元形成超极化,引起初级听皮层的 PV(parvalbumin)神经元一方面启动内源性稳态机制维持其兴奋性,另一方面,促进相邻的兴奋性神经元释放脑源性营养因子,作用于内侧膝状体投射神经元的末梢,从而增强丘脑—皮层环路功能对抗应激;抑郁易感小鼠缺乏类似的「韧性」机制。该研究为阐释内源性「心理韧性」机理提供了新思路。研究人员首先基于经典的抑郁模型---社会失败模型(Chr
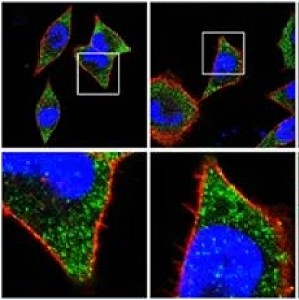
本文作者:陈小青 博士华东师范大学化学与分子工程学院研究背景异质性是细胞膜生物物理化学最重要的特性之一。细胞膜上富含胆固醇/鞘脂的高度动态的结构域,被称为脂筏。脂筏充当信号分子组装平台,参与多种信号转导过程。然而,由于脂筏高度动态特性,成像技术难以对活细胞上脂筏实时成像,因而脂筏动态组装过程与下游信号通路间的难以建立定量关联。近期,华东师范大学李迪教授团队与中国科学院上海有机化学研究所生物与化学交叉研究中心葛一凡副研究员合作,提出利用局域温度变化扰动细胞膜功能域分布的策略[1]。作者利用 DNA 折纸技术制备了兼具高空间分辨和化学分辨的光热响应分子工具,通过近红外激光操纵局部脂质环境温度来扰动脂筏的相分离程度(图 1)。相关研究工作以「高空间分辨热操纵细胞膜异质性改变细胞迁移及信号通路(High Spatial-resolved Heat Manipulating Membrane Heterogeneity Alters Cellular Migration and Signaling)」为题,发表在Proceedings of the National Academy of Sci
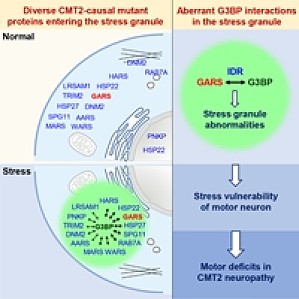
本文作者:崔琴琴浙江大学脑科学与脑医学学院白戈课题组腓骨肌萎缩症(Charcot-Marie-Tooth neuropathies,CMT)是一组临床上常见的周围神经遗传病,发病率约为 1/2500。根据致病基因的不同, CMT 可分为几十种不同的亚型。就 CMT 患者总数而言,在全国范围内是一个非常庞大的数字,然而具体到某些亚型的患者数量却非常稀少,因此 CMT 被收录到国家《第一批罕见病名录》。研究背景长久以来令人困惑的是,这几十种 CMT 致病蛋白在细胞中的定位和生理功能各异,似乎没有任何明显的共性,然而这些突变蛋白却会导致 CMT 患者表现出非常相似的临床症状。这个被称之为「疾病遗传异质性」的谜团长期以来一直困扰着广大神经科学家和临床工作者。有没有可能不同的致病蛋白最后通过一个「殊途同归」的共同机制引发相似症状?在过去几十年的研究中,领域内逐渐形成了一个共识:大多数神经系统疾病的发生都是遗传因子和环境应激因子共同作用的结果 [1, 2]。当细胞面临各种不良环境刺激时(如营养缺乏、高温、辐射等),细胞内一个重要的应激机制就是形成应激颗粒(Stress granule,SG),SG
如何注明获取图像时所使用的显微镜:系统配置中可能涉及大量的显微镜组件,在提及成像方法时,考虑到诸如荧光或相衬等许多成像技术需要使用多个专门的组件来实现其最终结果,情况就变得更加复杂。显微图像所应涵盖的细节清单,通常,在注明显微镜配置时,可能需要包含以下信息:显微镜的型号和制造商物镜放大倍数和数值孔径一定要注明是否为专业物镜,如相衬型,或是否使用油作为浸镜介质观察方法的细节,如明场或荧光。 如果使用荧光,请注明使用的滤镜/照明装置的波长和制造商。成像检测器(通常为相机)的型号采集所用的成像软件环境条件或处理,如培养或气体控制鸣谢机构工作人员或纳入作者署名:大多数情况下,一个研究项目从构思到发表需要多人参与。对实验设计的开发有贡献,为研究者定制了分析工具,以供研究中使用的情况,则应考虑将他们加入您的作者名单。成像机构和其他显微镜专家可以为您提供帮助,甚至指导实验者如何注明信息,帮助提供任何仪器资助方面的信息,并就其首选的信息标注方法为实验者提供指导。
实验室关闭、计划休假或突发紧急情况都可能会让您放下手头的研究。以下是重返实验室启动和展开试验的四步指南1. 为设备接通电源以错误的方式为设备接通电源可能会对系统性能造成负面影响。以下为需要遵循的一些通用准则:首先启动 PC 计算机:打开系统所有硬件:根据系统情况不同,可能需要特别注意打开硬件的顺序。比如说,在打开触控屏 TPC 之前必须先接通奥林巴斯系统控制器 CBH 电源。有关具体说明,请参阅手册。启动软件:如果在软件启动过程中遇到错误,请与产品技术人员咨询。2. 准备成像设备接通电源后,需要花一些时间适当准备、放置和调平样品才能进行成像。准备样品首先,选择适当的盖玻片。盖玻片应为 1.5 或 0.17 毫米厚(170 微米)。配合盖玻片使用的奥林巴斯物镜需要合适的厚度才能获得良好的图像质量。如果盖玻片太厚或太薄,可能会出现光学伪影。务必检查盖玻片的厚度,并使用标准载玻片。某些应用可以使用塑料载玻片。但对于荧光成像而言,塑料具有自发荧光特性。它会在蓝色和绿色通道(有时在红色通道)中产生明显的背景。另外在成像之前清洁盖玻片和载玻片也非常重要。比较好用的清洁溶液为蒸馏水稀释的 70% 乙
荧光成像需要维持一个微妙的平衡。一方面需要采集足够强的信号,这可以通过延长曝光时间或增强激发光实现。另一方面,需要通过缩短激发时间和降低激发光强度来最大限度降低样品条件下的光毒性。探索如何利用显微镜相机实现这一平衡的最佳方法。使用直方图直方图可以帮助确定理想的曝光时间。直方图就是反映信号强度分布的图。直方图的X轴代表信号强度。数据分布范围为零到相机最大信号强度。每个 X 值对应的直方图高度代表了该信号强度下的像素数量,如下图 1 所示。图 1:图像的直方图。(a)原始图像,(b)原始图像中每个像素的信号强度,(c)根据原始图像得到的直方图直方图的形状和分布可以帮助我们判断当前的曝光时间是否合适。在大多数荧光成像情况下,多数像素为没有信号的深色背景,这会导致直方分布图在背景强度附近出现峰值。如果直方图过于集中于低信号区域,则说明曝光时间太短(图 2,中)。如果其在最大信号处出现陡壁,则说明信号值已达到饱和(图 2,右)。这种情况下,可以降低激发光强度或缩短曝光时间。图 2:正常曝光(左),曝光不足(中)和在黄色标记处曝光过度(右)的直方图。让显示动态范围与数据动态范围匹配某些图像采集软件
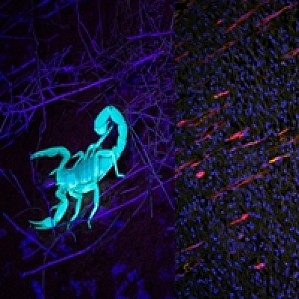
生物学自发荧光定义是自发荧光是生物结构天然发出的光,是广泛存在于细胞和组织中的一种现象。这种现象由内源性分子组成成份呈现的荧光能力引起。与染色剂和染料中使用的经过设计的荧光染料一样,自发荧光分子通常包含多环碳氢化合物,具有可被入射光子激发的离域电子。自发荧光分子在受到入射光刺激后,会显示出对有效振动弛豫的耐受。因此,多余的能量会作为一个新光子被发射出去,与激发的光子相比,这种光子能量比降低,波长升高。目前已知,有少数内源性分子(如甲壳素),在紫外线刺激下会发出荧光(见图 1,左)。然而,与研究者在实验室看到的经过设计的荧光染料相比,许多自发荧光体不太可能被入射光子激发。经过设计的造影剂的浓度同样可以在台式染色方案中进行调整,以限制或加强荧光信号,但天然自发荧光始终受生物浓度限制。图 1. 活体样品中的自发荧光示例。左图:紫外线(UV)刺激下蝎子的自发荧光。右图:外伤后 10 天的大鼠皮肤恢复图像,显示新血管在表皮层向伤口切口垂直生长。蓝色(DAPI):细胞核。橙色(自发荧光):皮肤组织。红色(CD31):血管。使用奥林巴斯BX51宽场荧光显微镜和 DP71 相机拍摄的图像。图像由中国中
实现活细胞成像自动化以及简化任务对于达到实验目标至关重要。这里介绍 4 个需要留意的技巧:1. 让标本在温暖、稳定的环境中保持健康状态活细胞成像过程中最大挑战之一就是如何在温暖舒适的培养箱之外确保样品健康并能够在显微镜下表现正常。可以利用能够为细胞提供稳定温度、湿度和 CO 2 密度的显微镜专用载物台上式培养箱或封闭式培养箱确保您的标本环境尽可能适宜。另外可以加热物镜,否则其作为寒冷的接触源可能会损害样品的健康。注意,微孔板外围区域可能存在比中心区域更高的环境波动风险,因此务必使用中心区域的孔,并避免使用边缘附近的孔影响稳定性。比如说,使用的是 96 孔板(12×8 孔),就只使用中心的 60 孔(10×6 孔)进行实验。图 1.载物台上式培养箱2.通过创造稳定的环境温度改善聚焦效果需要考虑的因素是室内温度,细微的温度变化也会影响到成像性能。显微镜的环境温度稳定性对于活细胞的高倍率观察尤其重要。由于高数值孔径观察的景深较浅,因此即使温度变化造成很小的Z漂移,系统也可能会因此离焦。为了优化环境条件,开始实验之前请确保打开空调并保持室温稳定。另外为了提高稳定性,还要避免气流从空调直接吹向显
1. 观察更多样品倒置显微镜载物台采用诸如 160×110 mm 尺寸 K 接口的通用底座标准,可以选择用于处理各种样品的载物台插件。这样可以观察多个培养皿或多个载玻片,可以同时进行实验,节省大量时间。这种方法减少了用于更换标本和设置常规实验的时间。图1.通过用在显微镜载物台上放三个培养皿取代放置一个培养皿,可以缩短用于实验准备和设置优化的时间,继而缩短了在实验室停留的时间2. 加快速度接下来就是优化图像采集速度。通常拖慢图像采集速度的瓶颈是滤色片或荧光镜组的机械切换过程,可以尝试以下方法:优化图像采集顺序:如果采集 Z 序列图像时的Z轴移动速度快于荧光滤色片的更换速度,则应现在一个荧光通道采集Z序列图像后,再转到下一荧光通道的方式进行(图 2,中间)。结合使用多通滤色镜组和 LED 光源:一些显微镜技术无需权衡取舍就能够实现某些改进。LED 光源和多通滤色片组合就是其中之一。尽管每个通道的单通专用滤色片通常是防止荧光串色的理想解决方案,但最新 LED 光源足够锐利的光谱可以避免串色并具备快速波长切换功能。这可以利用多通滤色片的优势缩短图像采集时间。使用多通滤色片的一个技巧是,尽可能使
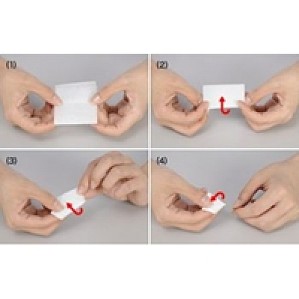
1. 使用后立即将油清除干净。干燥的油很难从物镜上清除,而且容易附着灰尘、污垢、指纹和其他污染颗粒物。少量灰尘会影响图像质量,并导致产生诸如阴影或雾之类的光学问题。随着时间的推移干燥后的油会导致物镜性能下降。因此,建议在使用后立即将浸没油从物镜上清除。2. 使用目镜检查物镜上的灰尘。物镜通常尺寸很小,很难发现镜头上的灰尘。只需从显微镜上取下目镜,然后将其朝向物镜进行检查即可,就可以透过目镜放大任何需要清洁的灰尘。如果手边有放大镜,也可以使用放大镜。有时候物镜在显微镜上固定得过紧,无法取下进行检查和清洁。在这种情况下,可以将物镜调整到能够轻松清洁的角度。3. 使用吹气球清除灰尘。在检查完透镜之后,开始清洁过程。第一步,使用吹气球清除物镜上的所有灰尘或颗粒物,但不要碰到物镜。4. 用擦镜纸折叠成一个点。拿出一张新的擦镜纸,将其折叠出一个点。注意,折叠擦镜纸的方法与物镜大小有关。对于大尺寸物镜,只需将擦镜纸缠绕在手指上就可以,便可以轻松擦拭整个透镜表面。这样的折叠只需四步即可完成,如下图所示:很多物镜尺寸较小,若手指太大而无法擦拭透镜表面,只需用擦镜纸叠成三角形就可获得一个擦拭点。注意,务必
1. 标本尺寸是多少?奥林巴斯显微镜物镜具备从 1.25 倍至 150 倍的放大倍率范围。这是为应用选择最佳物镜时所要考虑的第一个参数。该参数结合目镜放大倍率就可以确定显微镜的整体放大倍率。2. 所要观察标本中最小特征是什么?显微镜物镜第二个重要的参数是数值孔径(NA)。数值孔径用于衡量其汇聚光线的能力。是用以确定分辨率、焦深和图像亮度的重要因素。具有较大数值孔径的物镜可以汇聚更大范围的光线,从而生成更明亮、更高分辨率的图像。数值孔径对于观察非常精细的结构或在荧光观察过程中检测弱信号也很重要。在确定哪种显微镜物镜可以分辨标本的最小特征时,就需要考虑数值孔径。在权衡选项利弊时,请记住数值孔径范围在 0.04 至 1.7 之间。3. 图像视场和景深要求是什么?视场数或视场直径是光学显微镜中视场的直径,以毫米为单位,并在中间像平面测量。现代平场复消色差透镜和其他专用平场物镜通常具有 22 到 26.5 毫米(与广角目镜组合使用时或会更大)的可用视场。物镜的景深即在图像锐度不发生明显变化情况下的物镜轴向聚焦范围。该值从低数值孔径物镜到高数值孔径物镜变化很大;通常随着数值孔径的增加而减小。4.
光学显微镜三百多年前,人类已经使用光学显微镜观察肉眼无法分辨的微观物体。1662 年,英国物理学家罗伯特·胡克使用自制的显微镜观察软木切片,发现其在放大后呈现出类似修道院单人居室的微观结构-细胞。这是人类历史上第一次观察到细胞。3 年后,胡克出版了首部关于显微镜的著作——《显微图谱》,书中包含大量绘制精美的动、植物机体微观结构图像,开创了科学界利用图画方式进行交流的先河。《显微图谱》的出版使人们意识到微观世界和宏观世界一样丰富多彩,其中有许多未知的奥秘等待着被探索。同一时期,荷兰商人列文虎克(Antoni van Leeuwenhoek,1632—1723 年)制造出当时“最强”的光学显微镜,可实现 300 倍放大率,并持续「称霸」一个多世纪。1676 年春天,列文虎克用显微镜观察雨水发现水中有很多在活动的小生命,并给英国皇家学会寄去了包含这些发现的信件,其中有这样一段话:「我判断,即使把一百个这些小动物撑开摆在一起,也不会超过一颗粗沙子的长度;如果这是真的,那么一百万个这些活物也不够一颗粗沙粒的体积这」。段文字中的「小动物」,就是我们现在熟知的细菌。这是人类首次发现活体细菌,由此开创
1、1590·1920显微镜国产化的漫漫长路显微镜最早由荷兰眼镜制造商父子的发明。此后,英国和德国对显微镜做了进一步的改进。明治时期日本的显微镜通常作为放大镜生产销售的。但其性能逊色于欧洲的显微镜,因此当时从事细菌学研究的科学家不得不依靠昂贵的进口产品。奥林巴斯创始人山下长(Takeshi Yamashita)梦想有一天能够在日本制造出高水准的显微镜。他于 1919 年成立了一家公司,并开始为实现自己的梦想而奋斗。这也标志着山下长 13 年不懈努力的起点。2、1931从单目镜配置转为双目镜配置奥林巴斯在 20 世纪 20 年代中期之前就已经打造出完整的显微镜产品系列。从 1930 年开始,整合更多的功能:方便在观察视野内寻找样品的机械载物台可以用双眼观察的双目观察筒(让观察更加舒适)通过开发复消色差物镜改善光学性能改善聚光镜性能提升拍摄便利性统一镜臂设计3、1946推出 G 系列第二次世界大战期间,为了避免战争造成破坏,奥林巴斯的显微镜和相机工厂迁至长野县。在战后的混乱中,奥林巴斯面临诸多难题。公司设在长野县的伊那工厂(该工厂取代了设在公司总部且在战争中遭到破坏的 Hatagaya 工
挑战pH沉淀反应,常受pH值控制,也是非常经典的化学合成反应,应用非常广泛。此类反应通常在反应釜中进行,反应结束后,液体须与生成的沉淀物(通常为混悬物)分离。但如何实现快速分离?方案沉淀物生成后,继续保持搅拌状态,对混悬液进行过滤和洗涤。如下图所示的实验装置反应釜+过滤模块即可实现反应、过滤流程化。通过反应釜底部出料阀,颗粒状的悬浮液和反应溶液均可直接排入至过滤模块,如图示布氏漏斗和抽滤瓶,并借助真空泵抽滤,快速完成 ...
如今本子多难中不必多说,很多新人想取取经,但经验和智慧不是三言两语能说清楚的,更多的还是具体问题具体分析。这里分享的一些经验更具有普适性,如果都能在写本子过程中一一关照到,想必可以大幅提升中标概率。标书能中标主要是“硬实力”和“软实力”的结合。硬实力就是指标书所具备的不可改变的素质。比如研究方向,研究内容,前期工作/研究背景。这些东西没法编造,是什么就是什么。而这些硬实力中,研究背景又是很能决定一个标书中标与否的关键 ...
离心机的配平原则其主要目的是让转子的转动具有均衡的力学、热力学及表面质量,同时避免产生可能得振动,使设备在高速运行时具有良好的稳定性。
1、摇床的安全转速保护是什么意思?超过设定转速和最高转速时,仪器都会停止,重启瞬间按住时间按钮旋转转速按钮2、摇床是可以用在 CO2 培养箱中吗?可以,但是得看培养箱设置环境,可能会影响使用寿命,湿度最好不要超过 80%3、混匀仪的偏心距是多少?偏心距和周转直径是一样的4、DLAB 的哪款摇床属于脱色摇床?DLAB 全系列摇床均可以做脱色反应,但应用最多的是翘板摇床(-R 系列)。
摇床应用于细胞培养、发酵、分子杂交、蛋白印迹及各类生物化学反应,广泛应用于医学、生物学、分子学、制药、食品、环境等行业。摇床分类一般来说,根据摇床的运动方式来分,可以分为圆周摇床、线性摇床、翘板摇床、三维摇床。圆周摇床圆周摇床通过圆周运动的方式,提供高效的振荡混匀,适配各种培养皿,锥形瓶和培养瓶等;主要应用于细菌重悬、溶解性研究、细菌及酵母培养、提取洗脱过程、诊断检测、杂交、通用混匀、印迹&洗脱等应用等;适合单次混匀较多的样品,样品上下对流效果比较好,浓度较为均匀。线性摇床线性摇床通过往复运动的方式,线性振动筛更具有攻击性;广泛应用于各种电泳凝胶的固定、考马斯蓝染色、脱色时的振荡晃动、硝酸银染色的固定、染色、显影等;适合单次混匀较少的样品,样品与空气接触面积大,使其非常适合萃取等应用。翘板摇床翘板摇床可在样品中产生波浪运动,提供温和的混匀效果;应用于电泳凝胶染色/脱色样品洗涤、酶联免疫吸附(ELISA)洗脱、酶促免疫检测、蛋白合成、杂交印迹/洗脱、免疫沉淀、蛋白免疫印迹(Western Blot)等,同时可用于细胞培养及细胞膜转移,且可放入低温及恒温箱中使用。三维摇床3D 运动