原理
借助 gentleMACS 灌流技术,可在 gentleMACS Octo 八通道带加热全自动组织解离器上完成小鼠心脏的原位灌流。灌流过程中,心脏灌流试剂盒中的酶组合降解细胞外基质,破坏组织完整性。随后将灌流后的心脏转入 gentleMACS C 管,经短暂机械解离,即可得到高活性的单细胞悬液。最后通过 MACS SmartStrainer 100 μm 过滤,去除残余组织块,所得细胞可立即用于下游实验(分选、培养、功能/分子分析)。
材料与仪器
材料:小鼠新鲜心脏
试剂:
小鼠心脏灌流试剂盒(130-134-266)
MACS BSA 缓冲液 (130-091-376)
肌球蛋白Ⅱ抑制剂,如 2,3-丁二酮单肟 (BDM)
(可选)MACS 组织保存液(130-100-008)
仪器与耗材:
gentleMACS Octo 八通道带加热全自动组织解离器(130-134-029)
gentleMACS 灌流套筒(gentleMACS Perfusion Sleeve,130-128-752)
gentleMACS 灌流管 2(gentleMACS Perfusers 2,130-134-803)
gentleMACS C 管(130-093-237)
MACS SmartStrainer 细胞滤筛,100 μm (130-098-463)
细长玻璃 Pasteur 吸管(230 mm)、一次性吸液泵
恒温水浴锅、冷却离心机
6 cm 培养皿,15 mL / 50 mL 离心管,眼科手术器械
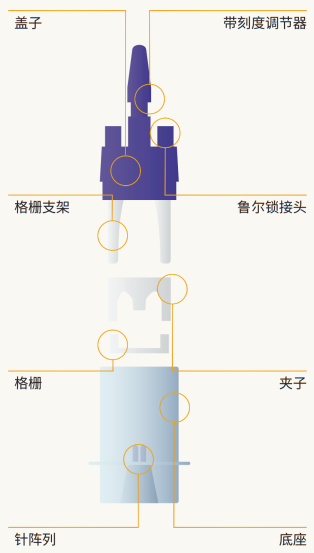
Perfusers 2 结构示意图如图所示,详细组装操作可点击下方图片查看视频教学
步骤
1. 试剂配制:
所有体积均以单次灌流计算;如需多次,按比例放大。
(1)复溶缓冲液(Reconstitution Buffer)
取 500 μL Buffer H (20×) + 9.5 mL 无菌水 → 10 mL
加入 1 μL Reagent C,混匀备用。
注:Buffer H(20×)易滋生细菌,建议无菌分装。首次使用前,请将 Buffer H(20×)置于 37 °C 预热至少 45 分钟,且使用前充分摇匀 Buffer H(20×)。
(2)酶复溶
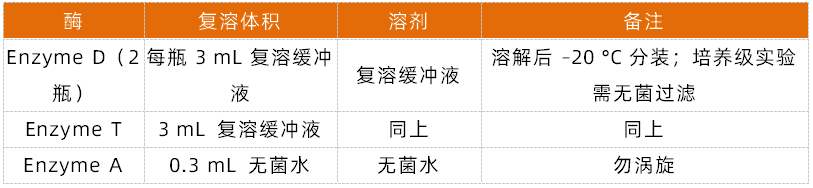
所有复溶酶液 –20 °C 保存 6 个月,使用前轻柔颠倒混匀。
(3)缓冲液体系

BDM 配制:0.2 g BDM + 4 mL Buffer H (1×),37 °C 水浴 10–20 min,每 5 min 摇晃一次,直至完全溶解。
(4)酶消化混合液(Enzyme Digestion Mix,现配现用)
一个单位灌流用量:6 mL 预热的 Equilibration Buffer + 200 μL Enzyme D + 65 μL Enzyme T + 10 μL Enzyme A,轻柔颠倒混匀,避免气泡。
2. 心脏灌流解离
(1)全程建议不间断操作。如需短暂转运,至少完成步骤 1–10(心脏结扎并离体),然后置于 4 °C MACS 组织保存液 + Reagent E (1:200) 中运输;延迟处理会降低细胞得率与活性。仅完整小鼠心脏可灌流,操作前切勿损伤心脏。
(2)gentleMACS Perfuser 2 已预设好小鼠心脏灌注参数。
若调节器(adjuster)位置被误调,可按以下方法复位:
2.1. 顺时针旋到底(最低位);
2.2. 稍回旋,使调节器刻度上的「5」对准箭头;
2.3. 再逆时针旋转 720°(两圈)即可。
▲ 在连接 gentleMACS Perfuser 2 之前,请确认已将 常规 gentleMACS 套筒 更换为 灌注专用套筒(Perfusion Sleeve)
(3)仪器准备
3.1 水浴 37 °C 预热;离心机预冷至 4 °C。
3.2 预热:Pre-digestion Buffer、两管 Equilibration Buffer 于 37 °C 预热。
3.3 将 Perfuser 2 的底座+ 盖子-夹子-格栅组件安装于 Perfusion Sleeve,确保调节器在正确位置。
3.4 将一个加热模块 Heating Unit 置于安装好 perfuser 2 的解离通道上(安装加热模块时,切勿在未安装盖子的情况下将底座装到通道上,否则可能导致加热单元故障。)。
3.5 用 Luer 头吸管将 8 mL 预热 Pre-digestion Buffer 转入 Perfuser 2。
3.6 启动 gentleMACS 程序 37C_m_HPK_1(步骤见下表)。
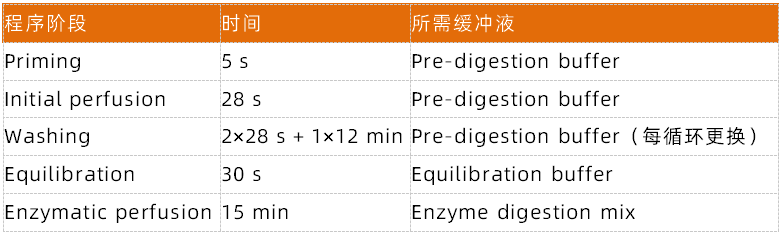
注:缓冲需液更换, 程序每阶段后会暂停;用细长玻璃吸管 + 吸液泵手动吸弃旧液,再加新液,点击 Resume 继续。
(4)心脏手术与安装
4.1 取下盖子-夹子-格栅组件,置于 6 cm 培养皿。
4.2 剪约 15 cm 手术线,打一环,环径略大于心脏。
4.3 安乐死:遵守 AVMA 指南(30–70 % CO₂)。开胸,固定肋骨,剥离心包。
4.4 将线圈套过心脏,用弯镊将其置于心房后方,轻提心脏,拉紧线结结扎,剪去多余线头。
4.5 将心脏置于格栅中央,左右心室分别朝向格栅两侧。
4.6 压下夹子,使心脏固定于 grid 与夹具之间。
4.7 将盖子-夹子-格栅组件重新装回 Perfuser 2 底座。
4.8 缓慢逆时针旋转盖子直至「▼」对准底座「▼」,lid 下沉。
4.9 顺时针旋紧,使「▼」对准「▲」,锁定 Perfuser 2。
4.10 点击Resume继续Initial perfusion;立即逆时针旋转调节器一整圈(约 360°)。
4.11 Washing阶段:程序自动暂停 3 次,每次手动吸弃旧液,加入 8 mL 新鲜 Pre-digestion Buffer,再 Resume。
4.12 最后一次洗涤后,吸弃 Pre-digestion Buffer,加入 8 mL Equilibration Buffer。
4.13 Resume → Equilibration 30 s。
4.14 Equilibration 期间,按前文配制酶消化混合液 Enzyme Digestion Mix(6 mL)。
4.15 Equilibration 结束后,吸弃缓冲液,加入 6 mL 酶消化混合液。
4.16 Resume → Enzymatic perfusion 15 min。
▲ 程序结束后勿丢弃该酶消化混合液,后续步骤需再次使用。
3. 组织转移与机械解离
(1)取下加热模块,连同 Perfuser 2 一并取下。
(2)旋开盖子,将盖子-夹子-格栅组件置于培养皿。
(3)将前面步骤从底座中收集的用过的酶消化混合液倒入 gentleMACS C 管(留作后续解离液),弃底座。
(4)用镊子推起夹子,将心脏从格栅移至培养皿。
(5)丢弃盖子及夹子-格栅组件。
(6)去除心脏上缝线,将心脏转入装有用过的酶消化混合液的 C 管。
(7)拧紧 C 管盖子,将其倒置插入 gentleMACS 解离通道中
▲此处确保通道安装的是常规的套筒(Sleeve)而不是灌流套筒(Perfusion Sleeve)
(8)运行程序 HPK_CR_1(以孵育为主,极少旋转)。
▲ 手动机械法解离会降低细胞得率及活性。
4. 过滤、收集与终止
(1)取 15 mL 离心管置冰上,顶部放 100 μm 细胞滤筛。
(2)程序结束后取下 C 管。
(3)开盖,将细胞悬液转移至滤网,避免产生气泡。
(4)用 4 mL Stop Buffer冲洗 C 管,一并倒入滤筛。
(5)4 °C,140 × g,离心 1 min,完全弃上清(上清可进一步富集非实质细胞)。
(6)轻弹管壁使沉淀松散。
(7)用 5 mL Stop Buffer 重悬细胞,轻柔颠倒混匀。
(8)置于冰上,立即进行下游实验。
来源:丁香实验