相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 保存条件:
-20
- 保质期:
3年
- 英文名:
pLVX-IRES-Puro
- 库存:
2ug
- 供应商:
酶研生物
- 规格:
2ug
已经提出过许多方法用于从细菌中提纯质粒DNA,这些方法都含有以下3个步骤:
细菌培养物的生长。
细菌的收获和裂解
质粒DNA的纯化。
二、质粒DNA的小量制备
细菌的收获和裂解
收获
碱裂解法
煮沸裂解
质粒DNA小量制备的问题与对策
质粒DNA的小量制备可采用下述的碱裂解法或煮沸法
(一)细菌的收获和裂解
1.收获
1)将2ml含相应抗生素的LB加入到容量为15ml 并通气良好(不盖紧)的试管中,然后接入一单菌落,于30℃剧烈振摇下培养过夜。
2)将1.5ml培养物倒入微量离心管中,用微量离心机于4℃以12000g离心30秒,将剩余的培养物贮存于4℃。
3)吸去培养液,使细菌沉淀尽可能干燥。除去上清的简便方法是用一次性使用的吸头与真空管道相连,轻缓抽吸,并用吸头接触液面。当液体从管中吸出时,尽可能使吸头远离细菌沉淀,然后继续用吸头通过抽真空除去附于管壁的液滴。
2.碱裂解法
1)将细菌沉淀,所得重悬于100μl用冰预冷的溶液I中,剧烈振荡。
溶液I
50mmol/L葡萄糖
25mmol/L Tris.Cl(pH8.0)
10mmol/LEDTA(pH8.0)
溶液I可成批配制,每瓶约100ml,在10lbf/in2(6.895×104Pa)高压下蒸气灭菌15分钟,贮存于4℃。须确使细菌沉淀在溶液I中完全分散,将两个微量离心管的管底部互相接触震荡,可使沉淀迅速分散。
2)加200μl新配制的溶液Ⅱ。
溶液Ⅱ
0.2mol/L NaOH(临用前用10mol/L贮存液现用现稀释)
1%SDS
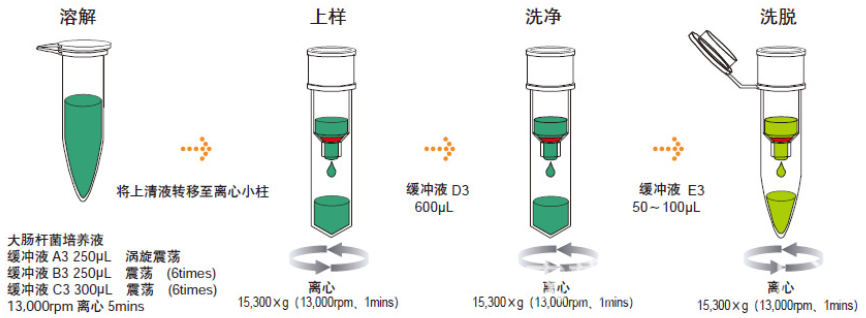
盖紧管口,快速颠倒离心管5次,以混合内容物。应确保离心管的整个内表面
均与溶液Ⅱ接触。不要振荡,将离心管放置于冰上。pLVX-IRES-Puro载体/pLVX-IRES-Puro质粒图谱/pLVX-IRES-Puro序列
3)加150μl用冰预冷的溶液Ⅲ
溶液Ⅲ
5mol/L乙酸钾 60ml
冰乙酸 11.5ml
水 28.5ml
所配成的溶液对钾是3mol/L,对乙酸根是5mol/L。
盖紧管口,将管倒置后和地振荡10秒钟溶液Ⅲ在粘稠的细菌裂解物中分散均匀,之后
将管置于冰上3-5分钟。
4)用微量离心机于4℃12 000g离心5分种,将上清转移到另一离心管中。
5)可做可不做:加等量酚:氯念,振荡混匀,用微量离心机于4 ℃以12000g离心2分钟,将上清转移到另一良心管中。有些工作者认为不必用酚:氯仿进行抽提,然而由于一些未知的原因,省略这一步,往往会得到可耐受限制酶切反应的DNA。
6)用2倍休积的乙醇于室温沉淀双锭DNA。振荡混合,于室温放置2分钟。
7)用微量离心机于4℃以12 000g离心5分钟。
8)小心吸去上清液,将离心管倒置于一张纸巾上,以使所有液体流出。再将附于管壁的液滴除尽。除去上清的简便方法是用一次性使用的吸头与真空管道相连,并用吸头接触液面。当液体从管中吸出时,尽量使吸头远离核酸沉淀,然后继续用吸头通过抽真空除去附于管壁的液滴。
9)用1ml70%乙醇于4℃洗涤双链DNA沉淀,按步骤8)所术方法去掉上清,在空气中使核酸沉淀干燥10分钟。
i.此法制备的高拷贝数质粒(如Xf3或pUC),其产量一般约为:每毫升原细菌培养物3-5μg。
ii.如果要通过限制酶切割反应来分析DNA,可取1μl DNA溶液加到另一含8μl水的微量离心管内,加1μl 10×限制酶缓冲液和1单位所需限制酶,在适宜温育1-2小时。将剩余的DNA贮存于-20℃。
pLVX-IRES-Puro载体/pLVX-IRES-Puro质粒图谱/pLVX-IRES-Puro序列
iii.此方法按适当比例放大可适用于100ml细菌培养物:
(二)质粒DNA小量制备的问题与对策
裂解和煮佛法都极其可靠,重复性也很好,而且一般没有会么麻烦。多年来,在我们实验室中日常使用这两种方法的过程中,只碰到过两个问题:
1)有些工作者首次进行小量制备时,有时会发现质粒DNA不能被限制酶所切割,这几乎总是由于从细菌沉淀或从核酸沉淀中去除所有上清液时注意得不够。大多数情况下,用酚:氯仿对溶液进行抽提可以去除小量备物中的杂质。如果总是依然存在,可用离心柱层析注纯化DNA。
2)在十分偶然的情况下,个别小时制备物会出现无质粒DNA的现象。这几乎肯定是由于核酸沉淀颗粒已同乙醇一起被弃去。
(二)细菌的收获和裂解
1.收获
1)用合适转头于4℃以4000转/分离心15分钟,弃上清,敞开离心管口并倒置离心管使上清全部流尽。
2)将细菌沉淀重悬于100ml用冰预冷的STE中。
STE
0.1mol/L NaCl
10mmol/L Tris.Cl(pH8.0)
1mmol/L EDTA(pH8.0)
2)按步骤1)所述方法离心,以收集细菌细胞。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验型质粒 (3)必需具备一个以上的酶切位点,有选择的余地; (4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位 Ampr(试一试)。 (5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、G418)等等。 无论选用哪种载体,首先都要获得载体分子,然后采用适当的限制酶将载体 DNA 进行切割,获得线性载体分子,以便于与目的基因片段进行连接。 如何阅读质粒图谱 第一步:首先看 Ori 的位置,了解质粒的类型(原核/真核
实验原理 TP53 是重要的抑癌基因。在多种肿瘤中都能发现 TP53 基因突变及功能丧失。我们将针对 TP53 基因设计的靶点构建到 pCas9/gRNA1 载体,转染 293T 细胞,构建了 TP53 基因敲除 293T 细胞系。 1、本实验基因敲除原理:pCas9/gRNA1 载体表达 gRNA 和 Cas9 蛋白。将靶点序列克隆到 pCas9/gRNA1 载体上,gRNA 将诱导 Cas9 蛋白对靶点 DNA 进行切割,造成 DNA 断裂。细胞通过邻端连接
pMBP-P 大肠杆菌质粒 Amp 分泌表达,His和MBP标签,带凝血酶位点 pMal-C2x 大肠杆菌质粒 Amp 表达MBP标签蛋白,原核表达载体 pMal-P2x 大肠杆菌质粒 Amp pMal-P
 技术资料
技术资料