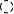相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
大量
- 英文名:
Hieff NGS MaxUp DNA Library Prep Kit for Illumina®
- 保质期:
有效期1年
- 供应商:
翌圣生物科技(上海)股份有限公司
- 保存条件:
-20℃保存
- 规格:
24T
| 产品名称 | 产品编号 | 规格 | 储存 | 价格(元) |
| Hieff NGSTM MaxUp DNA Library Prep Kit for Illumina® | 12201ES08 | 8 libraries | -20℃ | 1726.00 |
| Hieff NGSTM MaxUp DNA Library Prep Kit for Illumina® | 12201ES24 | 24 libraries | -20℃ | 4626.00 |
| Hieff NGSTM MaxUp DNA Library Prep Kit for Illumina® | 12201ES96 | 96 libraries | -20℃ | 16626.00 |
产品描述
Hieff NGSTM MaxUp DNA Library Prep Kit for Illumina®是针对Illumina®高通量测序平台专业开发设计的新一代建库试剂盒。可以将50 ng –400 ng的Input DNA构建为高输出量的测序文库,建库过程简单、快速。本产品采用高质量的酶学组成,改进型接头连接技术,以及具有强扩增效率的高保真酶,显著提高文库转化率与扩增效率,可应用于常规动植物基因组、微生物基因组、FFPE、cfDNA、ChIP DNA等样本,助力获得优异的测序数据。- 适用50 ng –400 ng所有DNA样本,包含cfDNA、FFPE等
- 业界领先的文库转化率,高达60%
- 多样本验证可获得优异的文库与测序数据
- 严格的批次性能与稳定性质控
产品组分
|
组分编号与名称 |
12201ES08 |
12201ES24 |
12201ES96 |
||
|
12201-A |
|
Endprep Buffer 2.0 |
48 μL |
144 μL |
576 μL |
|
12201-B |
|
Endprep Enzyme |
32 μL |
96 μL |
384 μL |
|
12201-C |
|
Ligation Enhancer |
240 μL |
720 μL |
3×960 μL |
|
12201-D |
|
Novel T4 DNA Ligase |
40 μL |
120 μL |
480 μL |
|
12201-E |
|
Canace® Pro Amplification Mix |
200 μL |
600 μL |
4×600 μL |
|
12201-F |
|
Primer Mix |
40 μL |
120 μL |
480 μL |
运输与保存方法
冰袋运输。所有组分-20°C保存,有效期1年。注意事项
一、关于操作1. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
2. 请于使用前将试剂盒各组分置于室温解冻。解冻后上下颠倒数次充分混匀,短暂离心后置于冰上待用。
3. 配制各步骤反应液时推荐使用移液器吹打混匀或轻轻振荡,剧烈振荡可能会造成文库产出下降。
4. 为避免样品交叉污染,推荐使用带滤芯的枪头,吸取不同样品时请更换枪头。
5. 推荐在带热盖的PCR仪中进行各步骤反应,使用前应预热PCR仪至反应温度附近。
6. PCR产物因操作不当极容易产生气溶胶污染,进而影响实验结果准确性。推荐将PCR反应体系配制区和PCR产物纯化检测区进行强制性的物理隔离;使用专用的移液器等设备;并定时对各实验区域进行清洁(使用0.5%次NaClO3或10%漂白剂进行擦拭清理),以保证实验环境的洁净度。
二、关于DNA片段化
1. 本试剂盒中兼容机械法及酶切法片段化的DNA。
2. 本试剂盒兼推荐使用50 ng –400 ng Input DNA。应尽可能使用A260/A280 = 1.8-2.0的高质量Input DNA。
3. Input DNA特指投入末端修复/dA尾添加步骤中的DNA。
4. Input DNA制备过程中带入的高浓度金属离子螯合剂或其他盐,可能会影响末端修复/dA尾添加步骤反应效率,建议DNA片段化后进行磁珠纯化或分选。当使用机械法进行DNA片段化且产物不进行纯化或长度分选而直接建库时,请将DNA稀释在TE Buffer中进行片段化,请勿在灭菌超纯水中进行。当使用酶切法进行片段化且产物不进行纯化或长度分选而直接建库时,请确认Stop Buffer中不包含过量的金属离子螯合剂。如条件不满足,可先将片段化产物纯化或长度分选后溶于TE buffer或灭菌超纯水中(≤50 μL),再进行文库构建。
三、关于接头连接(Adapter Ligation)
1.本试剂盒建议使用通用型短接头,需要通过PCR扩增获得完整的测序文库。针对Illumina 测序平台,Yeasen提供单端96种Index Primer和双端384种Index Primer。单端96种Index Primer:Cat#12611,Hieff NGSTM 96 Single Index Primers Kit for Illumina®,Set 1(48种); Cat#12612,Hieff NGSTM 96 Single Index Primers Kit for Illumina®, Set 2(48种)。双端384种Index Primer:Cat#12613,Hieff NGSTM 384 Dual Index Primers Kit for Illumina®,Set 1(96种); Cat#12614,Hieff NGSTM 384 Dual Index Primers Kit for Illumina®,Set 2(96种)。客户可根据实验需要灵活选择。
2. Adapter的质量和使用浓度直接影响连接效率及文库产量。Adapter用量过高可能会产生较多Adapter Dimer;用量较低可能会影响连接效率及文库产量。表1列举了使用本试剂盒,不同Input DNA量推荐的Adapter使用量。
表1 50 ng –400 ng Input DNA推荐的Adapter使用量
| Input DNA | Adapter : Input DNA摩尔比 | 推荐Adapter(15 μM)使用量 |
| 400 ng | 30:1 | 3.5 μL |
| 300 ng | 40:1 | 3.5 μL |
| 200 ng | 60:1 | 3.5 μL |
| 100 ng | 100:1 | 3.0 μL |
| 50 ng | 100:1 | 1.5 μL |
四、关于磁珠纯化与分选(Bead-based Clean Up and Size Selection)
1. DNA片段长度分选步骤可选择在末端修复/dA尾添加之前,或接头连接后,或文库扩增后进行。
2. 当Input DNA质量≥50 ng,您可选择在接头连接后分选;如Input DNA质量<50 ng,建议您在文库扩增后进行分选。
3. Ligation Enhancer中包含高浓度的PEG,会对双轮磁珠分选产生显著影响。因此,如在接头连接后进行长度分选,必须先进行纯化步骤,再进行双轮分选步骤;如在末端修复/dA尾添加之前或文库扩增后进行长度分选,可直接进行双轮磁珠分选步骤。
4. 磁珠使用前应先平衡至室温,否则会导致得率下降、分选效果不佳。
5. 磁珠每次使用前都应充分振荡混匀或使用移液器上下吹打充分混匀。
6. 转移上清时,请勿吸取磁珠,即使微量残留都将影响后续文库质量。
7. 磁珠漂洗使用的80%乙醇应现用现配,否则将影响回收效率。
8. 进行长度分选时,初始样品体积应尽量≥100 μL,不足时请用超纯水补齐。以防因样品体积太小导致移液误差增大。
9. 产物洗脱前应将磁珠置于室温干燥。干燥不充分容易造成乙醇残留影响后续反应;过分干燥又会导致磁珠开裂进而降低纯化得率。通常情况下,室温干燥3-5 min足以让磁珠充分干燥。
10. DNA纯化或长度分选产物如需保存,可使用TE Buffer洗脱,产物可于4°C可保存1-2周,-20°C可保存1个月。
五、关于文库扩增(Library Amplification)
1. 是否需要进行文库扩增取决于Input DNA量、Adapter是否为完整长度、应用需要等因素。如使用非完整长度Adapter,必须进行这一步骤。如使用完整长度Adapter,当Input DNA<200 ng时,推荐进行文库扩增;当Input DNA≥200 ng或者不需要进行文库扩增时,可不进行文库扩增。
2. 文库扩增步骤需要严格控制扩增循环数。循环数不足,将导致文库产量低;循环数过多,又将导致文库偏好性增加、重复度增加、嵌合产物增加、扩增突变积累等多种不良后果。表2列举了使用本试剂盒,获得1 μg文库的推荐循环数。
表2 50 ng –400 ng Input DNA获得1 μg产物扩增循环数推荐表
| Input DNA(ng) | Number of cycles required to generate 1 μg |
| 400 ng | 4 - 5 |
| 300 ng | 5 - 6 |
| 200 ng | 5 - 6 |
| 100 ng | 6 - 7 |
| 50 ng | 7 - 8 |
六、关于文库质检(Library Quality Analysis)
1. 通常情况下,构建好的文库可通过长度分布检测和浓度检测来进行质量评价。
2. 文库浓度检测可使用:基于双链DNA荧光染料的方法,如Qubit®、PicoGreen®等;基于qPCR绝对定量的方法。
3. 文库浓度检测不可使用:基于光谱检测的方法,如NanoDrop®等。
4. 推荐使用qPCR方法进行文库浓度检测:Qubit®、PicoGreen®等基于双链DNA荧光染料的浓度测定方法时,无法有效区分单端连接Adapter的产物、两端均未连接Adapter的产物以及其他不完整双链结构产物;qPCR绝对定量基于PCR扩增原理,仅定量样品中两端Adapter完整的文库(即可测序文库),可排除单端或双端都不连接Adapter的不可测序文库的干扰。
5. 文库长度分布检测,可通过Agilent Bioanalyzer 2100等基于毛细管电泳或微控流原理的设备进行检测。
使用方法
一、自备材料1. 纯化磁珠:Cat#12601,Hieff NGSTM DNA Selection Beads或Cat#A63880,AMPure XP Beads或其他等效产品。
2. DNA质控:Agilent Technologies 2100 Bioanalyzer或其他等效产品。
3. DNA Adapter及扩增引物:推荐使用Yeasen单端96种Index Primer试剂盒或双端384种Index Primer试剂盒。单端96种Index Primer:Cat#12611,Hieff NGSTM 96 Single Index Primers Kit for Illumina®,Set 1(48种); Cat#12612,Hieff NGSTM 96 Single Index Primers Kit for Illumina®, Set 2(48种)。双端384种Index Primer:Cat#12613,Hieff NGSTM 384 Dual Index Primers Kit for Illumina®,Set 1(96种); Cat#12614,Hieff NGSTM 384 Dual Index Primers Kit for Illumina®,Set 2(96种)。
4. 其他材料:无水乙醇、灭菌超纯水、TE Buffer(10 mM Tris-HCl,pH 8.0-8.5+0.1 mM EDTA)、低吸附EP管、PCR管、磁力架、PCR仪等。

图1 MaxUp DNA建库试剂盒操作流程
三、操作步骤
3.1 末端修复/dA尾添加(End Preparation/dA-Taling)
该步骤将Input DNA末端补平,并进行5’端磷酸化和3’端加dA尾。
1. 将表3中各试剂解冻后,颠倒混匀,置于冰上备用。
2. 于无菌PCR管中配制表3所示反应体系。
表3 末端修复/dA尾添加反应体系
| 名称 | 体积(μL) |
| Fragmented DNA | x |
| Endprep Buffer | 6 |
| Endprep Enzyme | 4 |
| ddH2O | Up to 60 μL |
4. 将上述PCR管置于PCR仪,设置表4所示反应程序,进行末端修复/dA尾添加反应。
表4 末端修复/dA尾添加反应程序
| 温度 | 时间 |
| 热盖105°C | On |
| 30°C | 20 min |
| 72°C | 20 min |
| 4°C | Hold |
该步骤将3.1步骤的产物末端连接特定的Illumina®接头。
1. 根据Input DNA量按表1选择合适Adapter用量。
2. 将表5中各试剂解冻后颠倒混匀,置于冰上备用。
3. 于3.1步骤PCR管中配制表5所示反应体系。
表5 Adapter Ligation体系
| 名称 | 体积(μL) |
| dA-tailed DNA(3.1步骤产物) | 60 |
| Ligation Enhancer | 30* |
| Quick T4 DNA Ligase | 5 |
| DNA Adapter | x** |
| ddH2O | 5-x |
**本公司接头浓度(Cat#12611;Cat#12612;Cat#12613;Cat#12614)与常规商业化试剂盒一致,皆为15 μmol/L。请根据注意事项三中的提示,计算接头用量。
4. 使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液收集至管底。
5. 将PCR管置于PCR仪中,设置表6所示反应程序,进行接头连接反应:
表6 Adapter Ligation反应程序
| 温度 | 时间 |
| 热盖 | Off |
| 20°C | 15 min |
| 4°C | Hold |
3.3 连接产物磁珠纯化(Post Ligation Clean Up)
该步骤使用磁珠对3.2步骤的产物进行纯化或分选。纯化可除去未连接的Adapter或Adapter Dimer等无效产物,分选可筛选特定长度的DNA片段以符合测序需要。
3.3.1 纯化操作步骤:
1. 准备工作:将Hieff NGSTM DNA Selection Beads磁珠由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3. 吸取80 μL Hieff NGSTM DNA Selection Beads(0.8×,Beads:DNA=0.8:1)至Adapter Ligation产物中,室温孵育5 min。
4. 将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5 min),小心移除上清。
5. 保持PCR管始终置于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec后,小心移除上清。
6. 重复步骤5,总计漂洗两次。
7. 保持PCR管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂(不超过5 min)。
8. 将PCR管从磁力架中取出,进行洗脱:
1)如产物无需进行片段分选,直接加入21 μL ddH2O,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置5 min。【注:如纯化产物如需保存,可使用TE Buffer洗脱】。将PCR管短暂离心并置于磁力架中静置,待溶液澄清后(约5 min),小心移取20 μL上清至新PCR管中,切勿触碰磁珠。
2)如产物需进行双轮分选,加入102 μL ddH2O,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置5 min。
【注:如纯化产物如需保存,可使用TE Buffer洗脱】。将PCR管短暂离心并置于磁力架中静置,待溶液澄清后(约5 min),小心移取100 μL上清至新PCR管中,切勿触碰磁珠。
3.3.2 双轮分选操作步骤:
1. 准备工作:将Hieff NGSTM DNA Selection Beads磁珠由冰箱中取出,室温平衡约30 min。配制80%乙醇。
2. 请涡旋振荡或充分颠倒磁珠以保证混匀。
3. 根据DNA片段长度要求,参考表7向上述100 μL DNA上清中加入第一轮分选磁珠,涡旋混匀或移液器吹打10次混匀。
表7 磁珠文库分选推荐比例
| DNA文库插入片段大小(峰值,bp) | ~ 200 | ~ 300 | ~ 400 | ~500 | |
| 短接头连接之后分选 | 第一轮体积比 | 0.82× | 0.72× | 0.62× | 0.58× |
| 第二轮体积比 | 0.2× | 0.15× | 0.15× | 0.1× | |
| 完整接头连接之后分选或文库扩增之后分选 | 第一轮体积比 | 0.78× | 0.68× | 0.58× | 0.55× |
| 第二轮体积比 | 0.15× | 0.15× | 0.15× | 0.15× | |
4. 室温孵育5 min。
5. 将PCR管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心转移上清到干净的离心管中。
6. 参考表7向上清中加入第二轮分选磁珠。
7. 涡旋混匀或移液器吹打10次混匀,室温静置5 min。
8. 将PCR管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心移除上清。
9. 保持PCR管始终处于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec,小心移除上清。
10. 重复步骤9。
11. 保持PCR管始终处于磁力架中,开盖干燥磁珠至刚刚出现龟裂(约5 min)。
12. 将PCR管从磁力架中取出,加入适量21 μL ddH2O,涡旋振荡或使用移液器轻轻吹打充分混匀,室温静置5 min。
13. 将PCR管短暂离心并置于磁力架中分离磁珠和液体。待溶液澄清后(约5 min),小心转移20 μL上清至干净的管中。
3.4 文库扩增(Library Amplification)
该步骤将对纯化或长度分选后的接头连接产物进行PCR扩增富集。
1. 将表8中试剂解冻后颠倒混匀,置于冰上备用。
2. 于无菌PCR管中配制表8所示反应体系。
表8 PCR扩增反应体系
| 名称 | 体积(μL) |
| 2× Super CanaceTMⅡHigh-Fidelity Mix | 25 |
| Universal Primer | 2.5 |
| Index Primer | 2.5 |
| Adapter Ligated DNA(3.3步骤产物) | 20 |
3. 使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液收集至管底。
4. 将PCR管置于PCR仪中,设置表9所示反应程序,进行PCR扩增。
表9 PCR扩增反应程序
| 温度 | 时间 | 循环数 |
| 98°C | 1 min | 1 |
| 98°C | 10 sec | 参照注意事项中表2 |
| 60°C | 30 sec | |
| 72°C | 30 sec | |
| 72°C | 5 min | 1 |
| 4°C | Hold | - |
同3.3.1步骤中纯化操作步骤。使用Hieff NGSTM DNA Selection Beads(0.9×,Beads:DNA=0.9:1)纯化文库扩增产物。
如需分选,操作方法同3.3.2双轮分选步骤(纯化步骤可省略)。
3.6 文库质量控制
通常情况下,构建好的文库可通过浓度检测和长度 分布检测来进行质量评价,具体请参见注意事项六。
3.7 参考实例
使用Hieff NGSTM MaxUp DNA Library Prep Kit for Illumina®对100 ng FFPE样本建库(未分选),结果使用Agilent 2100 DNA 1000 Chip进行检测。
相关产品:
| 建库试剂盒 | 产品编号 | 规格 |
| Hieff NGS™ MaxUp II DNA Library Prep Kit for Illumina® | 12200ES24/96 | 24/96 T |
| Hieff NGS™ OnePot DNA Library Prep Kit for Illumina® | 12203ES24/96 | 24/96 T |
| Hieff NGS™ Fast Tagment DNA Library Prep Kit for Illumina® | 12206ES24/96 | 24/96 T |
| Hieff NGS™ MaxUp Dual-Mode mRNA Library Prep Kit for Illumina® | 12301ES24/96 | 24/96 T |
| 文库构建磁珠 | 产品编号 | 规格 |
| Hieff NGS™ cfDNA Clean Beads(100~200bp) | 12599ES08/56 | 5/60 mL |
| Hieff NGS™ Smarter DNA Clean beads (50bp以上) | 12600ES08/56/75 | 5/60/450 mL |
| Hieff NGS™ DNA Selection Beads(Superior AMPure XP alternative) | 12601ES08/56/75 | 5/60/450 mL |
| Hieff NGS™ RNA Cleaner | 12602ES08/56/75 | 5/60/450 mL |
| Hieff NGS™ mRNA Isolation Master Kit | 12603ES24/96 | 24/96 T |
| 建库接头 | 产品编号 | 规格 |
| Hieff NGSTM Complete Adapter Kit for Illumina®, Set 1 | 12615ES04/16 | 12×4/12×16 T |
| Hieff NGSTM Complete Adapter Kit for Illumina®, Set 2 | 12616ES04/16 | 12×4/12×16 T |
| Hieff NGSTM Complete Adapter Kit for Illumina®, Set 3 | 12617ES04/16 | 12×4/12×16 T |
| Hieff NGSTM Complete Adapter Kit for Illumina®, Set 4 | 12618ES04/16 | 12×4/12×16 T |
| Hieff NGSTM Tagment Index Kit for Illumina®, (96 Index) | 12610ES96 | 96 T |
| 建库模块 | 产品编号 | 规格 |
| Hieff NGSTM Fast-Pace DNA Fragmentation Reagent | 12609ES50 | 50 T |
| Hieff NGSTM Fast-Pace End Repair/dA-Tailing Module | 12608ES24/96 | 24/96 T |
| 2×Super CanaceTM High-Fidelity Mix for Library Amplification | 12620ES24/96 | 24/96 T |
| Hieff NGSTM Dual-Mode cDNA Synthesis Kit | 12250ES24/96 | 24/96 T |
| 文库定量 | 产品编号 | 规格 |
| Hieff NGSTM Library Quantification Kit for Illumina®, qPCR Master Mix | 12302ES05 | 500 T |
| Hieff NGSTM Library Quantification Kit for Illumina®, DNA Standard (1-6) | 12307ES09 | 6×96 μL |
| dsDNA HS Assay Kit for Qubit® | 12640ES60/76 | 100/500 T |
| 多重PCR | 产品编号 | 规格 |
| HieffTM Multiplex PCR Kit | 12279ES50/76 | 100/500 T |
| HieffTM Multiplex PCR Master Mix | 12280ES50/76 | 50 /200 T |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验-HCl, pH8.5。DNA 洗脱溶液,室温密闭贮存。二、简介总RNA 和基因组DNA 同步纯化试剂盒是为从生物样品中同步纯化总RNA 和基因组DNA 设计的,可从≤1×107 动物细胞、100mg 动物组织或5×107 酵母菌中提取多至150μg RNA 和20μg DNA。本试剂盒采用全新的相分离技术分离、纯化RNA 和DNA,结合silica 膜选择性吸附DNA 的原理,达到快速、同步纯化RNA 和基因组DNA 的目的。本试剂盒纯化的总RNA 分子完整、纯度高,适合用于NorthernBlot、RT
• 以96孔板方式,从同一个细胞或组织样本中同时纯化基因组 DNA和总RNA • 处理 96 个样本,只需不到60 分钟 • 从同一样本中纯化高品质的基因组DNA和总RNA • 96孔板方式,高效的操作流程 • 高度标准化的操作流程 • 高重复性的DNA和RNA产量 Product description The AllPrep DNA/RNA 96 Kit is well suited for high
以下操作按照天根产品 DP322 口腔拭子基因组 DNA 提取试剂盒的说明书进行,所有反应现象仅适用于该产品及本文所标明的样本量。如使用其它操作流程或产品,样本量不同可能现象与本文有所差异。实验准备:1. 口拭子2. 移液器及配套无菌枪头(200 μl ,1ml),2 ml离心管3. 无水乙醇4. 涡旋振荡器,金属浴/水浴,台式离心机注意:为了保证样本不被食物或者饮料污染,取样前 30 min内请勿进食和饮水。实验准备-试剂盒准备:使用前先在漂洗液PW和GD中加入无水乙醇,加入体积请参照瓶
 技术资料
技术资料需要更多技术资料 索取更多技术资料