相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 保存条件:
避免反复冻融。2-8°C不超过一个月,-80°C不超过12个月
- 保质期:
1年
- 英文名:
Recombinant Lamin A/C (LMNA)
- 库存:
30
- 供应商:
联迈生物
- 规格:
10µg/50µg/200µg/1mg/1g
| 来源 | 原核表达 |
| 宿主 | E.coli |
| 内毒素水平 | <1.0EU/µg(LAL法测定) |
| 亚细胞定位 | n/a |
| 片段与标签 | N-terminal His Tag |
| 缓冲液成份 | 磷酸盐缓冲液(pH7.4,含有 0.01% SKL, 1mM DTT, 5% Trehalose和Proclin300.) |
| 性状 | 冻干粉 |
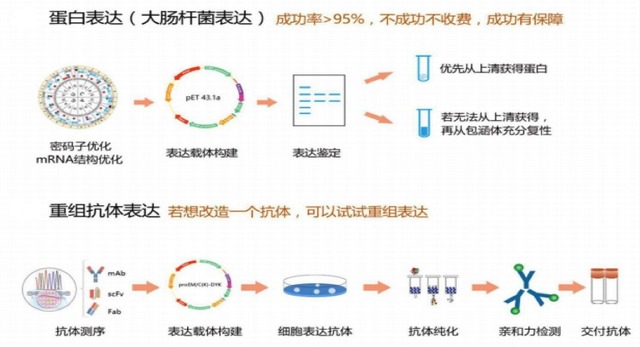
原理:
蛋白质的翻译效率很大程度上跟翻译起始效率有关,因此mRNA的5'端必须得很好翻译,最好不要有复杂的二级结构;通过PCR的方法在基因的5‘端引入简并序列,构建克隆,挑选多个克隆,诱导表达之,SDS-PAGE电泳检测表达量的高低,挑选高表达克隆进行测序。
实验步骤:
1.设计目的重组蛋白质的N端10-15个氨基酸的简并序列。
2.引物合成上述简并序列,同时设计合成目的基因反向引物。
3.PCR扩展目的基因,这样在目的基因的5‘端就引入了兼并序列,同时不改变氨基酸序列。
4.双酶切,插入到目标载体。
5.转化。
6.挑选多个克隆(比如100-200个)到1.5ml EP管,直接诱导表达(记得带上为改造克隆菌株的对照)。
7.SDS-PAGE检测。
8.挑选高表达的多个克隆,测序。
重组蛋白的特性
Immune tech的重组蛋白分为冻干粉和溶液态两种保存形式,原核细胞表达的重组蛋白为冻干粉状态,真核细胞表达的重组蛋白为溶液态保存,这样使得重组蛋白非常稳定,在-80℃条件下可保存数年。冻干粉在使用前需进行溶解,其中溶解的方法非常关键,因为溶解不好会降低蛋白的效用。溶液态保存的重组蛋白在冻融稀释使用过程中也需要仔细注意,这些都是用户在实际应用中经常遇到的问题。
(1)原核细胞表达的重组蛋白。Immune tech大肠杆菌表达的冻干重组蛋白,已经从包涵体中提纯,添加了蛋白保护剂,使用过滤后的无菌水作为复溶剂即可,复溶冻干蛋白100 μg,用86 μl的超纯水,轻轻摇晃使蛋白溶解,再用移液枪的枪头轻吹几下即可完全溶解,一定不能使用涡旋仪进行快速振荡或剧烈摇晃。
(2)真核细胞表达的重组蛋白。有活性的蛋白质不仅要转录和翻译,还要进行翻译后的加工,使得蛋白质的空间折叠方式维持正常,所以重组蛋白必须在真核细胞中进行,如哺乳动物细胞能够识别和去除基因中的内含子,对翻译后的蛋白质进行加工,这样表达的蛋白质具有生物活性。我们用溶液态来保存,保持了其良好的活性和稳定性。
(3)重组蛋白的保护剂。在冻干和储存过程中常用的保护剂或稳定剂有糖类,多元醇,聚合物,表面活性剂,某些蛋白和氨基酸等。我们通常加8%(质量比体积)的海藻糖和甘露醇作为冻干保护剂。海藻糖可明显阻止蛋白质二级结构改变以及冻干过程中蛋白质的伸展和聚集,甘露醇也是一种普遍应用的冻干保护剂和填充剂。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验Nature 解读:David R. Liu 等通过体内碱基编辑实现治疗小鼠Hutchinson-Gilford早衰综合征
Hutchinson-Gilford 早衰综合症(HGPS 或早衰症)通常是由编码核纤层蛋白 A 的基因 LMNA 中 C・G 基因突变为 T・A(c.1824 C> T;p.G608G)引起的。这种突变导致 RNA 错剪,产生早老素(progerin)。早老素是一种有毒蛋白,可引起快速衰老,导致早衰儿童的寿命大约只有 14 岁。尽管治疗早衰的策略例如全面抑制蛋白质法尼基化(farnesylation)可为患者带来益处,但尚没有报道可以直接逆转 HGPS 突变的方法。2021 年 1 月
分子按功能可分为3个部分(见图1):第一部分为信号肽(图1中S),含36个氨基酸,在蛋白质分泌中起作用;第二部分为免疫球蛋白Fc段结合区(图1中E,D,A,B,C),共含291个氨基酸,按顺序分为E、D、A、B、C共 5个结构域,每个结构域都能与Fc段特异结合;第三部分为胞壁结合区(图1中X),含182个氨基酸,与金黄色葡萄球菌胞壁的肽聚糖共价结合。 蛋白A的功能是由其分子中第二部分(E,D,A,B,C)决定的,信号肽第一部分(S)在蛋白的分泌过程中被剪切掉,而约占分子的2/5大小的第三部分(X
因为短的肽标签对目标蛋白的结构影响最小,而大的亲和标签可能限制重组蛋白的折叠,影响蛋白质的生物学功能。(2)亲和标签对蛋白质稳定性的影响,亲和标签的加入是否会影响到目标蛋白的正确折叠,是促进目标蛋白的可溶性,还是容易形成包涵体,会不会造成氨基酸C和N端破坏,使目的蛋白表达不完全。(3)亲和标签所融合的位置,亲和标签可以加在N端,可以加在C端,也进行串联。多数情况下蛋白质的N端区域对蛋白质的功能不是太重要,所以在N端进行融合标签的融合常常能保留蛋白质的生物学功能。由于N端DNA序列对蛋白质的转录
 技术资料
技术资料暂无技术资料 索取技术资料





