相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 库存:
9999
- 供应商:
武汉科昊佳生物科技有限公司
- 英文名:
UltraGRO-PURE Cell Culture Supplement
- 规格:
50mL/100mL/500mL
| 规格: | 50mL | 产品价格: | ¥2376.0 |
|---|---|---|---|
| 规格: | 100mL | 产品价格: | ¥4224.0 |
| 规格: | 500mL | 产品价格: | ¥16896.0 |
HELIOS 人血小板裂解物-PURE(细胞培养级)
| 名称 | 品牌 | 货号 | 规格 | 储存 |
| 人血小板裂解物-PURE(细胞培养级) UltraGRO-PURE Cell Culture Supplement |
HELIOS | HPCHXCRL05 | 50mL | -20℃ |
| HPCHXCRL10 | 100mL | |||
| HPCHXCRL50 | 500mL |
一、产品概述
HELIOS 人血小板裂解物-PURE(细胞培养级)是一款经过严格工艺处理的高质量细胞培养添加剂,源自健康人血小板,通过可控的裂解过程释放血小板中丰富的生长因子、细胞因子、黏附蛋白及其他营养成分。本产品旨在为多种哺乳动物细胞(尤其是间充质干细胞、内皮细胞、上皮细胞等原代细胞及干细胞)的体外培养提供优异的营养支持,有效替代传统胎牛血清(FBS),降低异种蛋白污染风险,提高细胞培养的安全性和一致性。
二、产品特性
▶无动物成分/血清替代品
▶用5%的UltraGRO1M-PURE替代高达20%的胎牛血清
▶在原代分离和扩增培养中性能更好
▶缩短种群倍增时间(20~30小时)
▶低成本的低成本选择产生
▶没有粘附因子需要
▶Lot到批次一致性
▶不需要肝素
三、产品的性能展示
1.缩短hMSCs的倍增时间和提高增殖能力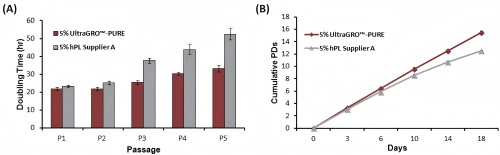
图1:UltraGROTM-PURE对人间充质干细胞生长的性能。(A)将UltraGRO“M-PURE培养的人骨髓间充质干细胞(hBM-MSCs)与人血小板裂解物供应商a的倍增时间和(B)累积数量翻倍。两种培养基补充剂与基础培养基的浓度为5%。(N=3)
2.保持多谱系分化的潜力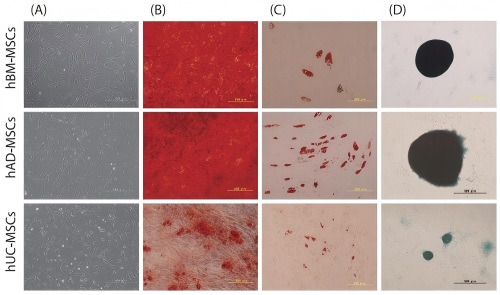
图2:在UltraGRO-PURE中培养的来自骨髓(BM)、脂肪组织(AD)和脐带(UC)的人间充质干细胞的特征。(A)细胞形态在5.100倍放大时呈纺锤形形态。(B)人骨髓间充质干细胞随后可分化为成骨细胞(茜素红染色),200倍放大;(C)脂肪细胞(油红O染色),200倍放大;(D)软骨细胞(阿利新蓝染色),100倍放大。
3.用5% UltraGROTM-PURE替代20%胎牛血清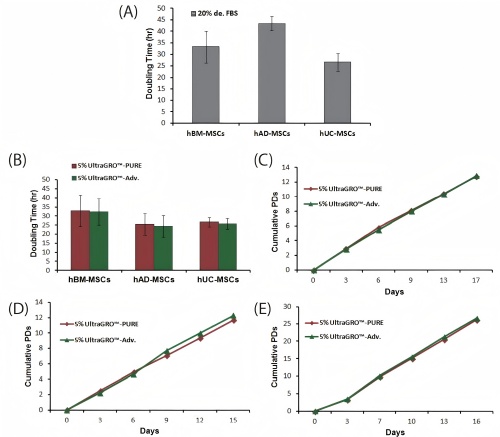
图3:UltraGROTM-PURE对来自骨髓(BM)、脂肪组织(AD)和脐带(UC)生长的人间充质干细胞的性能。(A)20%定义的胎牛血清培养或(B)UltraGROTM-PURE培养的人间充质干细胞5代的平均倍增时间。(C)UltraGROTM-PURE培养的hBM-MSCs、(D) hAD-MSCs和(E)hUC-MSCs的累积数量加倍与UltraGROTM-Adv相当,作为纤维蛋白原耗尽的hPL产物的参考。(N=3)
4.维持细胞表面表型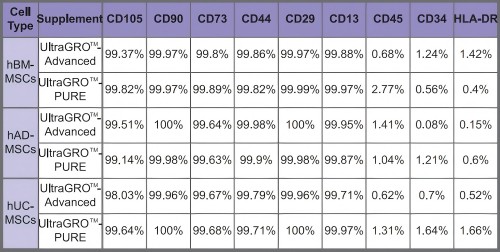
图4:在UltraGROTM-PURE中培养5代的人BM-、AD-和UC-MSC显示了MSC表面标记物的特征性表达。UltraGROTM-Adv.is作为纤维蛋白原缺失hPL产物的参考。
四、质量控制标准
1.外观:黄色至浅黄色液体
2.总蛋白:4.0 - 8.0 g/dL
3.内毒素:≤ 10 EU/mL
4.无菌性:通过
5.支原体:阴性。
6.pH:测试。
7.渗透压:测试。
8.性能测试:测试和记录
五、适用范围
用于人类体外组织和细胞培养加工应用。
六、重要信息
1.不溶性颗粒可能会在解冻的 UltraGRO 中形成™-纯正。已发表的研究表明,颗粒不会改变产品的性能。
2.不溶性颗粒可能会在解冻的 UltraGRO 中形成™-PURE,建议在3,400 xg下离心3~5分钟。
3.在 UltraGRO 之后过滤完成介质(例如 5%)™-PURE在基础介质中稀释,不会影响UltraGRO™-PURE补充细胞培养性能。然而,0.22微米过滤不推荐用于100% UltraGRO™-纯净浓缩物,因为这可能会减少5%的UltraGRO™-纯细胞培养性能。
4.应避免反复的冻融循环,因为它们会导致不可溶性沉淀物的增加,从而导致 UltraGRO 的潜在减少™-纯粹的表演。
七、MSC培养条件
1.媒体:完全培养基由基础培养基(例如α-MEM或其他支持性培养基)和UltraGRO-PURE组成。
2.培养类型:粘附
3.培养容器:细胞培养板、T型瓶、G-Rex培养瓶、细胞培养袋、旋转瓶或垂直轮式生物反应器温度范围:36℃至38℃
4.培养箱环境:湿度为4~6%的CO加湿环境,确保培养容器中实现适当的气体交换。
八、使用说明
1. UltraGRO™-PURE在典型的细胞培养介质中,即含有2mM L-谷氨酰胺的最终浓缩物的α-MEM中,以5%(v/v)的浓度显示MSC的最佳生长。
2. 我们建议将MSCs的接种量控制在每平方厘米约3×103~ 6×103个细胞。
3.UltraGRO™-PURE已经被纤维蛋白原耗尽,并且在细胞培养液中不需要添加肝素。
九、准备工作
1.试剂解冻:将HELIOS人血小板裂解物-PURE从-20℃或-80℃冰箱中取出,置于2-8℃冰箱中缓慢解冻(建议过夜解冻),或在室温下快速解冻(需不断轻轻混匀)。解冻过程中避免剧烈震荡。
2.基础培养基准备:准备适合目标细胞培养的基础培养基(如DMEM、MEM、α-MEM、RPMI-1640等),并根据需要添加谷氨酰胺、抗生素(如青霉素/链霉素)等常规添加剂(注意:部分敏感细胞系可能对某些抗生素敏感,需根据情况调整)。
3.无菌操作环境:在超净工作台内进行所有操作,确保无菌环境,避免污染。
十、培养基配制步骤
1.确定添加比例:根据目标细胞类型及培养经验,确定HELIOS人血小板裂解物-PURE在完全培养基中的最佳添加体积百分比。通常推荐添加比例为5%-15%(v/v),具体比例需用户根据细胞特性进行预实验优化(建议设置不同浓度梯度,如5%、10%、15%等,评估细胞增殖、形态等指标以确定最佳浓度)。
2.混合均匀:在无菌条件下,将计算好体积的HELIOS人血小板裂解物-PURE缓慢加入到预热或室温的基础培养基中,边加边轻轻混匀,避免产生气泡。
3.分装与储存:配制好的完全培养基可分装保存于2-8℃冰箱中,建议在1-2周内使用完毕,以保证其最佳活性。避免反复冻融完全培养基。
十一、细胞培养操作建议
1.细胞复苏与接种:按照常规细胞复苏方法复苏冻存细胞,用含HELIOS人血小板裂解物-PURE的完全培养基重悬细胞,调整细胞密度后接种于培养器皿中,置于37℃、5% CO₂的细胞培养箱中培养。
2.细胞换液:根据细胞生长情况,通常每2-3天更换一次完全培养基。换液时,弃去旧培养基,用PBS或无血清培养基轻轻洗涤细胞1-2次,然后加入新鲜的含HELIOS人血小板裂解物-PURE的完全培养基。
3.细胞传代:当细胞生长至汇合度达到70%-90%时进行传代。弃去旧培养基,用胰蛋白酶或其他合适的消化液消化细胞,终止消化后离心收集细胞,用完全培养基重悬并按适当比例接种到新的培养器皿中。
4.细胞冻存:如需冻存细胞,可使用含HELIOS人血小板裂解物-PURE的冻存液(通常在完全培养基基础上添加10%-20% DMSO),按常规冻存程序进行。
十二、常见问题及解决方案
1.细胞增殖缓慢:
检查添加比例是否过低,可适当提高HELIOS人血小板裂解物-PURE的浓度。
确认细胞接种密度是否适宜,调整接种密度。
检查培养箱温度、CO₂浓度、湿度等环境参数是否正常。
排查基础培养基是否过期或配制不当。
2.细胞形态异常:
可能是添加比例过高或细胞对产品不适应,可降低添加比例或尝试逐步适应法(如从低浓度开始,逐步提高比例)。
检查是否存在污染,如支原体污染可能导致细胞形态改变。
确认解冻过程是否规范,避免因反复冻融导致产品活性下降。
3.培养基出现沉淀:
可能是由于低温储存导致部分蛋白析出,可将培养基置于37℃水浴中轻轻摇晃,观察沉淀是否溶解。若溶解,通常不影响使用;若沉淀不溶解,可能是产品质量问题,建议停止使用。
4.批次间差异:
尽管产品经过严格质量控制,但不同批次间仍可能存在细微差异。建议在更换新批次产品时,进行小范围预实验,验证其适用性。
十三、储存与运输
UltraGRO™-PURE在需要之前冷冻储存最稳定。建议储存温度为-20°C。湿冷冻UltraGRO™-使用前将产品置于37°C水浴中纯净。一次UltraGRO™-PURE解冻后,建议当天完全使用完成的培养基制备(例如5%),或将其分成一次性用量,并在-20°C下储存未使用的用量。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验1. Scalable Manufacturing of Human Mesenchymal Stromal Cells in the Vertical-Wheel Bioreactor System: An Experimental and Economic Approach.
de Sousa Pinto D, Bandeiras C, de Almeida Fuzeta M, Rodrigues CAV, Jung S, Hashimura Y, Tseng RJ, Milligan W, Lee B, Ferreira FC, Lobato da Silva C, Cabral JMS. Biotechnol J. 2019 Aug;14(8):e1800716. doi: 10.1002/biot.201800716
2. A fully-closed and automated hollow fiber bioreactor for clinical-grade manufacturing of human mesenchymal stem/stromal cells.
Amanda Mizukami, Mario Soares de Abreu Neto, Francisco Moreira, Ana Fernandes-Platzgummer, Yi-Feng Huang, William Milligan, Joaquim M. S. Cabral, Claudia L. da Silva, Dimas T. Covas, Kamilla Swiech. Stem Cell Rev. 2018;14(1):141-143. doi: 10.1007/ s12015-017-9787-4.
3. Transplantation routes affect the efficacy of human umbilical cord mesenchymal stem cells in a rat GDM model.
Dan Wu, Shan Zou, Haibin Chen, Xiaoyan Li, Yetao Xu, Qing Zuo, Yi Pan, Shi-Wen Jiang, Hung Huang Lizhou Sun. Clin Chim Acta. 2017;475:137-146. doi: 10.1016/j.cca.2017.10.013.
4. Integrated culture platform based on a human platelet lysate supplement for the isolation and scalable manufacturing of umbilical cord matrix-derived mesenchymal stem/stromal cells.
de Soure AM, Fernandes-Platzgummer A, Moreira F, Lilaia C, Liu SH, Ku CP, et al. J Tissue Eng Regen Med; 2017;11(5):1630-1640.
5. Human Platelet Lysate versus Fetal Calf Serum: These Supplements Do Not Select for Different Mesenchymal Stromal Cells.
Eduardo Fernandez-Rebollo, Birgit Mentrup, Regina Ebert, Julia Franzen, Giulio Abagnale, Torsten Sieben, Alina Ostrowska, Per Hoffmann, Pierre-François Roux, Björn Rath, Michele Goodhardt, Jean-Marc Lemaitre, Oliver Bischof, Franz Jakob & Wolfgang Wagner. Sci Rep. 2017 Jul 11;7(1):5132. doi: 10.1038/s41598-017-05207-1
6. Long-Term Expansion in Platelet Lysate Increases Growth of Peripheral Blood-Derived Endothelial-Colony Forming Cells and Their Growth Factor-Induced Sprouting Capacity.
Tasev D, van Wijhe MH, Weijers EM, van Hinsbergh VWM, Koolwijk P. PLoS One. 2015;10(6):e0129935
7. Evaluation of human platelet lysate versus fetal bovine serum for culture of mesenchymal stromal cells.
Hemeda H, Giebel B, Wagner W. Cytotherapy. 2014;16(2):170-80.
8. Human platelet lysate is a feasible candidate to replace fetal calf serum as medium supplement for blood vascular and lymphatic endothelial cells.
Cytotherapy. Hofbauer P, Riedl S, Witzeneder K, Hildner F, Wolbank S, Groeger M, et al. 2014;16(9):1238-44.
9. Human Wharton’s Jelly Mesenchymal Stem Cells Plasticity Augments Scar-Free Skin Wound Healing with Hair Growth.
Sabapathy V, Sundaram B, V M S, Mankuzhy P, Kumar S. PLoS One. 2014; 9(4):e93726.
10. The effect of platelet lysate fibrinogen on the functionality of MSCs in immunotherapy.
Copland IB, Garcia MA, Waller EK, Roback JD, Galipeau J. Biomaterials. 2013;34(32) : 7840-50.
11. Human platelet lysate stimulates high-passage and senescent human multipotent mesenchymal stromal cell growth and rejuvenation in vitro.
Griffiths S, Baraniak PR, Copland IB, Nerem RM, McDevitt TC. Cytotherapy. 2013; 15(12):1469-83.
12. Pooled human platelet lysate versus fetal bovine serum-investigating the proliferation rate, chromosome stability and angiogenic potential of human adipose tissue-derived stem cells intended for clinical use.
Trojahn Kølle SF, Oliveri RS, Glovinski PV, Kirchhoff M, Mathiasen AB, Elberg JJ, et al. Cytotherapy. 2013; 15(9):1086-97.
13. Manufacturing mesenchymal stromal cells for phase I clinical trials.
Hanley PJ, Mei Z, da Graca Cabreira-Hansen M, Klis M, Li W, Zhao Y, Durett AG, Zheng X, Wang Y, Gee AP, Horwitz EM. Cytotherapy. 2013;15(4):416-22.
14. Human platelets lysate as a promising growth-stimulating additive for culturing of stem cells and other cell types.
Shanskii YD, Sergeeva NS, Sviridova IK, Kirakozov MS, Kirsanova VA, Akhmedova SA, et al. Bull Exp Biol Med. 2013; 156(1):146-51.
15. Human platelet lysate as a fetal bovine serum substitute improves human adipose-derived stromal cell culture for future cardiac repair applications.
Naaijkens BA, Niessen HW, Prins HJ, Krijnen PA, Kokhuis TJ, de Jong N, et al. Cell Tissue Res. 2012; 348(1):119-30.
16. Platelet lysate from whole blood-derived pooled platelet concentrates and apheresis- derived platelet concentrates for the isolation and expansion of human bone marrow mesenchymal stromal cells: production process, content and identification of active components.
Fekete N, Gadelorge M, Fürst D, Maurer C, Dausend J, Fleury-Cappellesso S, et al. Cytotherapy. 2012; 14(5):540-54.
17. Phenotypical and functional characteristics of mesenchymal stem cells from bone marrow: comparison of culture using different media supplemented with human platelet lysate or fetal bovine serum.
Ben Azouna N, Jenhani F, Regaya Z, Berraeis L, Ben Othman T, Ducrocq E, et al. Stem Cell Research & Therapy. 2012, 3(1):6.
18. Human platelet lysate permits scale-up of dental pulp stromal cells for clinical applications.
Govindasamy V, Ronald VS, Abdullah AN, Ganesan Nathan KR, Aziz ZA, Abdullah M, et al. Cytotherapy. 2011;13(10):1221-33.
19. Alternatives to the use of fetal bovine serum: human platelet lysates as a serum substitute in cell culture media.
Rauch C, Feifel E, Amann EM, Spötl HP, Schennach H, Pfaller W, et al. ALTEX. 2011; 28(4) : 305-16.
20. Influence of Platelet Lysate on the Recovery and Metabolic Performance of Cryopreserved Human Hepatocytes Upon Thawing.
Tolosa L, Bonora-Centelles A, Donato MT, Mirabet V, Pareja E, Negro A, et al. Transplantation. 2011; 91(12):1340-6.
21. Platelet-lysate-Expanded Mesenchymal Stromal Cells as a Salvage Therapy for Severe Resistant Graft-versus-Host Disease in a Pediatric Population.
Lucchini G, Introna M, Dander E, Rovelli A, Balduzzi A, Bonanomi S, et al. Biol Blood Marrow Transplant. 2010; 16(9):1293-301.
22. Generation of mesenchymal stromal cells in the presence of platelet lysate: a phenotypic and functional comparison of umbilical cord blood- and bone marrow-derived progenitors.
Avanzini MA, Bernardo ME, Cometa AM, Perotti C, Zaffaroni N, Novara F, et al. Haematologica. 2009;94(12):1649-60.
23. Treatment of refractory acute GVHD with third-party MSC expanded in platelet lysate-containing medium.
von Bonin M, Stölzel F, Goedecke A, Richter K, Wuschek N, Hölig K, et al. Bone Marrow Transplant. 2009; 43(3):245-51.
24. Platelet lysate stimulates wound repair of HaCaT keratinocytes.
Ranzato E, Patrone M, Mazzucco L, Burlando B. Br J Dermatol. 2008;159(3):537-45.
25. Human platelet lysate allows expansion and clinical grade production of mesenchymal stromal cells from small samples of bone marrow aspirates or marrow filter washouts.
Capelli C, Domenghini M, Borleri G, Bellavita P, Poma R, Carobbio A, et al. Bone Marrow Transplant. 2007; 40, 785–791.
26. Platelet lysates promote mesenchymal stem cell expansion: a safety substitute for animal serum in cell-based therapy applications.
Doucet C, Ernou I, Zhang Y, Llense JR, Begot L, Holy X, et al. J Cell Physiol. 2005; 205(2):228-36.
细胞器,转化频率高,重复性好,是目前该领域研究中最常用和最有效的 DNA 导入技术。相比较第一代台式基因枪而言,手持式基因枪由于气体压力较小(仅有 100-600 psi),而不能穿透成熟叶片的细胞壁,一定程度上影响了其在植物中转基因的应用范围,不过与台式基因枪互补,Helios 很好地延伸了基因枪的应用领域。 同样是利用高压气体传送基因,制作技术的改良使得基因枪从细胞转殖到活体转殖,从台式到手持,一步一步将基因枪的应用范围扩大。首先意识到并积极尝试利用基因枪的生命
叶片轰击区域出现大面积细胞死亡;而尝试使用250 或300 psi气压轰击时,叶片会被撕碎;当使用 80 或 100 psi 轰击叶片时,叶片被轰击区域相对保持完好,但同时没有检测到成功转染的样品。(Kekarainen, T., & Valkonen, J. P. T. (1995). Inoculation of viral RNA and cDNA to potato and tobacco plants using the Helios Gene Gun. Micro, 4–7.)左图:传统
相关专题 张宁,王凤山 (山东大学药学院生化与生物技术药物研究所 ,山东济南250012 《中国海洋药物》杂志2004年第2期(总第98期) 摘要:DNA的提取是分子生物学研究的基础技术,提取的DNA的纯度及结构完整性是进行基因工程各项研究所 必需的条件。近年来一些新的或改进的DNA提取纯化方法不断出现,本文对从陆生动物、植物、微生物以及海洋生物提取DNA的方法进行综述。 关键
 技术资料
技术资料需要更多技术资料 索取更多技术资料
资料下载:
UltraPURE使用說明.pdf 附 (下载 0 次)
UltraGRO-PURE.pdf 附 (下载 0 次)
UltraGRO+PURE_MSC+culture.pdf 附 (下载 0 次)
请 [登录] 后再下载!