相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 保存条件:
-80ºC
- 保质期:
一年
- 英文名:
Alpha Synuclein Pre-formed Fibrils (Type 1)
- 库存:
大量
- 供应商:
StressMarq
- 规格:
100 µg/100 µg x2/100 µg x5/500 µg (@ 5mg/mL)/500 µg x2 (@ 5mg/mL)
| 规格: | 100 µg | 产品价格: | 询价 |
|---|---|---|---|
| 规格: | 100 µg x2 | 产品价格: | 询价 |
| 规格: | 100 µg x5 | 产品价格: | 询价 |
| 规格: | 500 µg (@ 5mg/mL) | 产品价格: | 询价 |
| 规格: | 500 µg x2 (@ 5mg/mL) | 产品价格: | 询价 |
| 产品名称 | Alpha Synuclein 蛋白 |
| 产品描述 |
活性重组人Alpha Synuclein 蛋白前体原纤维 Pre-formed Fibrils (1 型) |
| 应用范围 | WB, SDS-PAGE, In vivo assay, In vitro assay |
| 浓度 | 各批次不同,请详见说明书 |
| 标记物 | 无标签 |
| 性质 | 重组 |
| 来源物种 | 人 |
| 表达系统 | 大肠杆菌 (E. coli) |
| 氨基酸序列 | MDVFMKGLSK AKEGVVAAAE KTKQGVAEAA GKTKEGVLYV GSKTKEGVVH GVATVAEKTK EQVTNVGGAV VTGVTAVAQK TVEGAGSIAA ATGFVKKDQL GKNEEGAPQE GILEDMPVDP DNEAYEMPSE EGYQDYEPEA |
| 纯度 | >95% |
| 蛋白长度 | 全长蛋白 |
| Full Biological Activity | 会使内源性α-突触核蛋白磷酸化. 37°C下以600 rpm震荡孵育后, 100 µM α-突触核蛋白单体 (SPC-321) 被10 µM α-突触核蛋白前体原纤维 (SPR-322)催化, 使 25 µM 硫黄素T (PBS pH 7.4, 100 µl 反应量) 产生了 13,000 相对荧光单位的荧光强度. 用 Molecular Devices Gemini XPS 微孔板读板机读取荧光读数,激发荧光在 450 nm 发射光为485 nm. |
产品特性
| 储存缓冲液 | PBS |
| 储存温度 | -80ºC |
| 运输温度 | 干冰. 运输: 该产品会与其他同订单产品分开发货. |
| 纯化方式 | 离子交换层析纯化 |
| Protein Size | 分子量~14.46 kDa |
| 引用该产品 | Human Recombinant Alpha Synuclein Protein (StressMarq Biosciences Inc., Victoria BC CANADA, Catalog # SPR-322) |
| 分析证书 | 该蛋白已经通过SDS-PAGE检测证明纯度大于95%. |
| 其他相关信息 | 为达到最佳效果, 请在使用前超声处理. |
生物学特性
| 别名 | Active Alpha synuclein pre-formed fibrils, Active Alpha synuclein aggregates, Active Alpha synuclein Protein aggregates, Active Alpha synuclein aggregates, Active Alpha-synuclein Protein, Non-A beta component of AD amyloid Protein, Non-A4 component of amyloid precursor Protein, NACP Protein, SNCA Protein, NACP Protein, PARK1 Protein, SYN Protein, Parkison disease familial 1 Protein, Active Alpha synuclein Protein seed |
| 研究领域 | 神经纤维缠结&Tau, 突触核蛋白, 神经生物学, 神经衰退疾病, 帕金森氏病, 阿尔茨海默病 |
| 细胞定位 | 细胞核, 细胞质, 膜 |
| Accession Number | NP_000336.1 |
| GeneID | 6622 |
| Swiss Prot | P37840 |
| 科研背景 | Alpha-Synuclein (SNCA) is expressed predominantly in the brain, where it is concentrated in presynaptic nerve terminals (1). Alpha-synuclein is highly expressed in the mitochondria of the olfactory bulb, hippocampus, striatum and thalamus (2). Functionally, it has been shown to significantly interact with tubulin (3), and may serve as a potential microtubule-associated protein. It has also been found to be essential for normal development of the cognitive functions; inactivation may lead to impaired spatial learning and working memory (4). SNCA fibrillar aggregates represent the major non A-beta component of Alzheimers disease amyloid plaque, and a major component of Lewy body inclusions, and Parkinson’s disease. Parkinson's disease (PD) is a common neurodegenerative disorder characterized by the progressive accumulation in selected neurons of protein inclusions containing alpha-synuclein and ubiquitin (5, 6). |
| 参考资料 | 1. “Genetics Home Reference: SNCA”. US National Library of Medicine. (2013). 2. Zhang L., et al. (2008) Brain Res. 1244: 40-52. 3. Alim M.A., et al. (2002) J Biol Chem. 277(3): 2112-2117. 4. Kokhan V.S., Afanasyeva M.A., Van’kin G. (2012) Behav. Brain. Res. 231(1): 226-230. 5. Spillantini M.G., et al. (1997) Nature. 388(6645): 839-840. 6. Mezey E., et al. (1998) Nat Med. 4(7): 755-757. |
产品图片
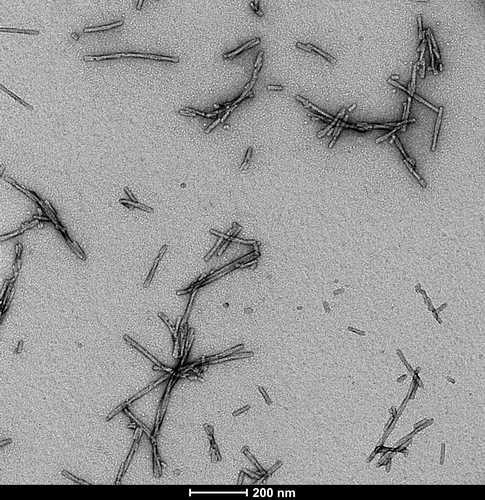
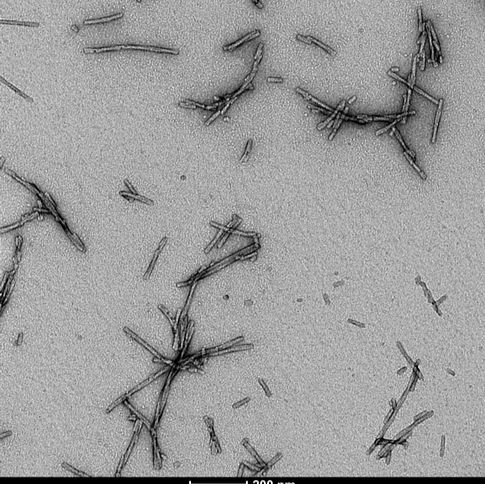
1型 Alpha 突触核蛋白前体原纤维 (PFFs) (SPR-322) 的电镜图。
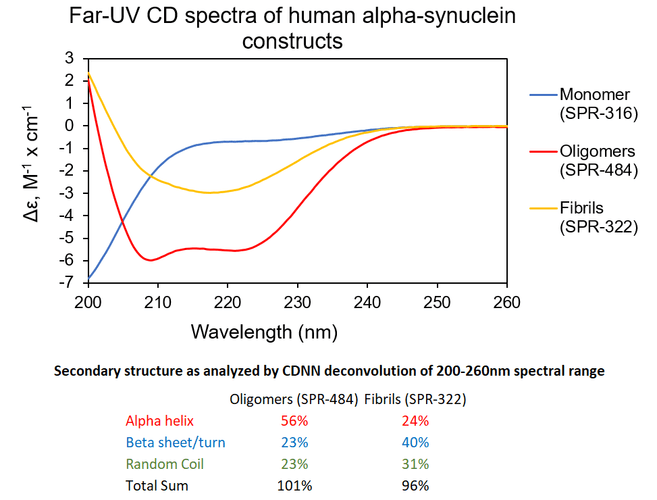
相比于原纤维,α突触核蛋白寡聚体有独特的二级结构。UV-CD 数据显示StressMarq的α突触核蛋白寡聚体有不同于单体和原纤维的独特二级结构。更具体的说, StressMarq的动态学稳定的α突触核蛋白寡聚体 (SPR-484) 显示出比1型α突触核蛋白PFFs (Type 1) (SPR-322) 多很多的α螺旋但是β折叠相对较少。 StressMarq的α突触核蛋白单体 (SPR-316) 在200nm处显示出强烈的负信号,暗示着无序的蛋白状态 (缺乏二级结构)。
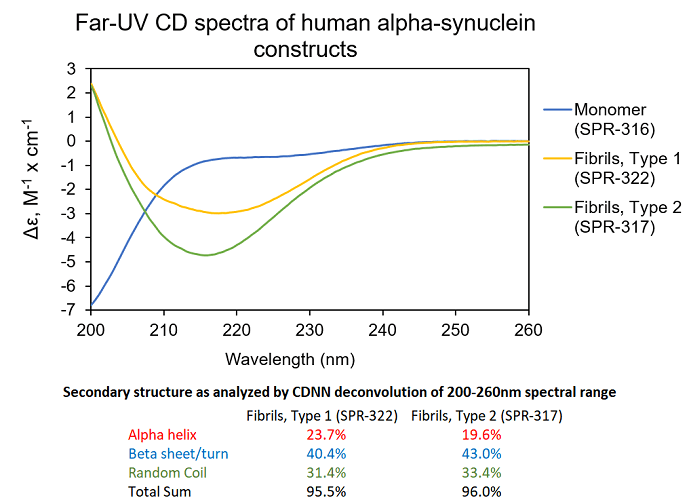
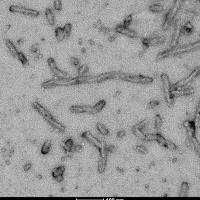
UV-CD数据显示StressMarq的 Alpha 突触核蛋白前体原纤维 (PFF), 1型 (货号SPR-322) 和2型 (货号SPR-317) 都含有较高的 beta 折叠, 然而他们的二级结构也确实有微小的差别。StressMarq的Alpha突触核蛋白单体 (货号SPR-316) 在200nm处显示出强烈的负信号,暗示着无序的蛋白状态 (缺乏二级结构). 在这个实验中, 前体原纤维 (PFF)在UV-CD前 进行了10次超声处理来确保测量之前的可溶性。
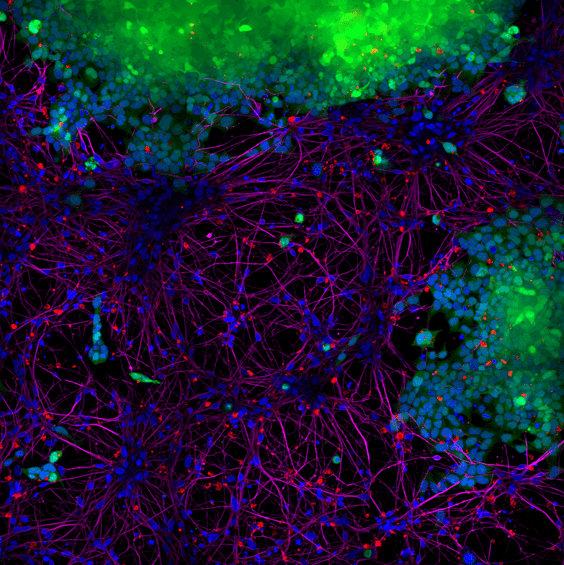
图片显示StressMarq的 alpha-突触核蛋白 PFFs (红色,货号SPR-322) 于14天内由 SH-SY5Y细胞吸收然后转移至神经元 iPSCs 中。B蓝色: Hoechst/DNA; 绿色: SHSY5Y-GFP; 红色: alpha-synuclein PFFs-555 (货号SPR-322); 紫色: 微管蛋白.

14 kDa 1型重组人Alpha 突触核蛋白前体原纤维 (SPR-322)SDS-PAGE. 泳道 1: 分子量梯 (MW). 泳道 2: 1型 Alpha 突触核蛋白前体原纤维 (SPR-322).
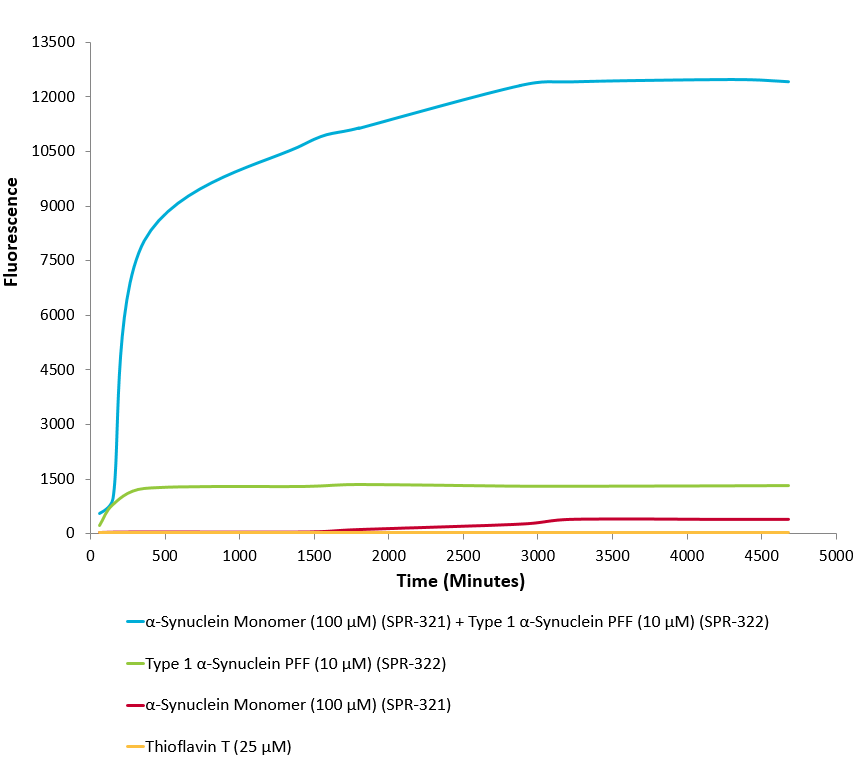
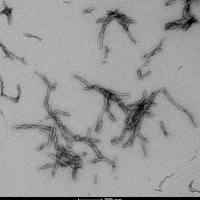
1型突触核蛋白 (α-Syn) 前体原纤维 (SPR-322) 催化1型单体(SPR-321)形成新的前体原纤维. 硫黄素 T 是一种荧光染料, 可以绑定富含beta折叠的结构, 例如 α-Syn 前体原纤维. 绑定之后, 硫黄素T光谱会发生红移, 荧光强度会增强. 左侧硫黄素 T 发射光曲线展示了四种试验对象随时间增强的荧光强度(相关于α-Syn 蛋白前体原纤维),其中 10 μM 1型 α-Syn 前体原纤维(SPR-322) 与100 μm 1型 α-Syn 单体 (SPR-321) 混合物荧光增强最明显, 另外几组对比分别是1型 α-Syn 前体原纤维 (SPR-322) 、1型 α-Syn 单体 (SPR-321) 以及 λex = 450 nm, λem = 485 nm. 注意: 我们计算浓度时用的α突触核蛋白单体和原纤维的分子量都是14.46 kDa. 实验加样量为 100µL/孔,所以100 µM 是 144.6µg/孔,10 µM 是 14.46 µg/孔.
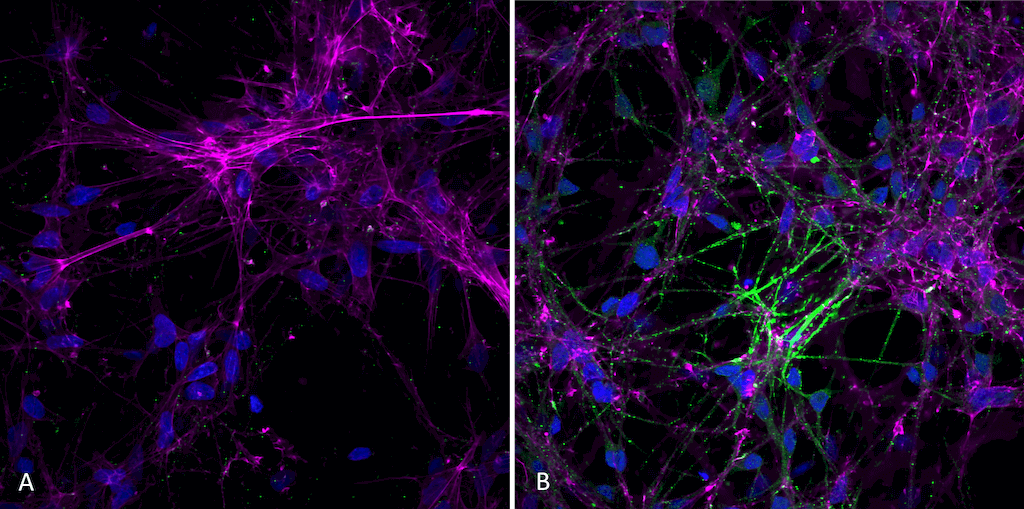
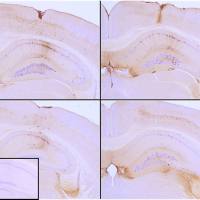
经alpha突触核蛋白前体原纤维 (SPR-322) 处理的 人iPSC-衍生神经元的免疫细胞化学/免疫荧光分析. 一抗: 小鼠抗-Alpha 突触核蛋白 (pSer129) 单抗 (SMC-600), 1:1000 稀释度 4°C 隔夜孵育. 二抗: 抗兔: A488, 1:1000 室温孵育1小时. 放大倍数: 40X. 细胞核染色: Hoechst- 20 min, 室温 (蓝色). 肌动蛋白染色: Phalloidin-647- 20 min, 室温 (magenta). 每孔4K细胞. iPSC 神经元: Applied StemCell 货号 # ASE-9321K. A)阴性对照l; 孔中没加原纤维. B) 加入活性重组人前体原纤维 (1型) 7天后. 原纤维使用前经超声处理,每孔 2.5 ug
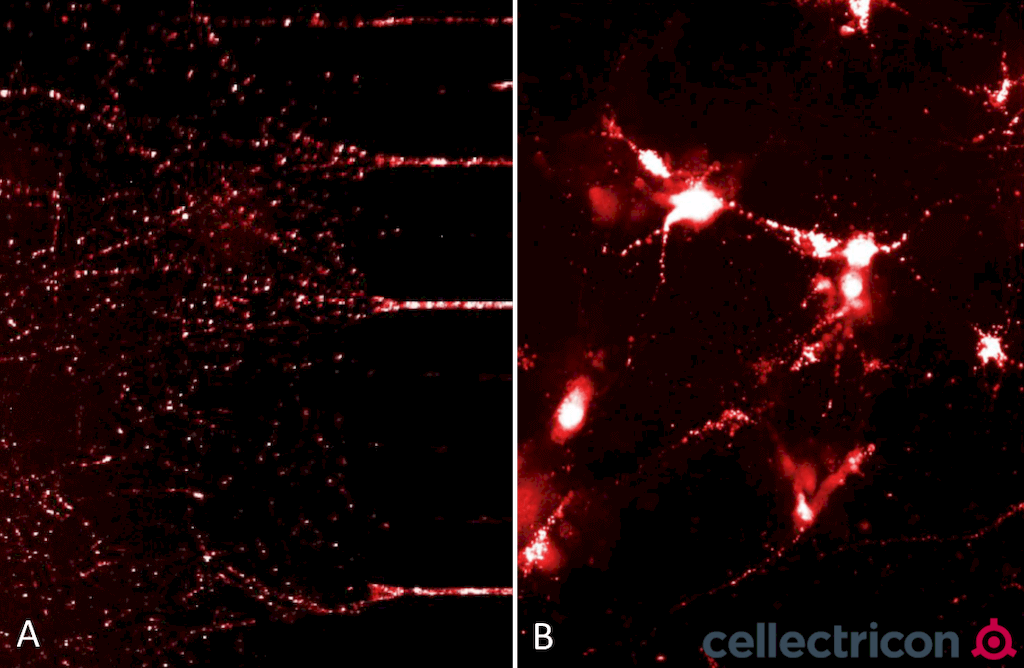
ATTO633 荧光标记的alpha 突触核蛋白 PFFs (SPR-322) 被吸收然后转运到细胞体, 诱导小鼠神经灰质原代细胞中的alpha突触核蛋白聚集. (A) 24小时后充满荧光标记alpha突触核蛋白的神经突植于微流控培养系统. (B) 24小时后Alpha 突触核蛋白在小鼠神经皮质原代细胞的细胞体和神经突中聚集. 实验和图片来自Cellectricon.
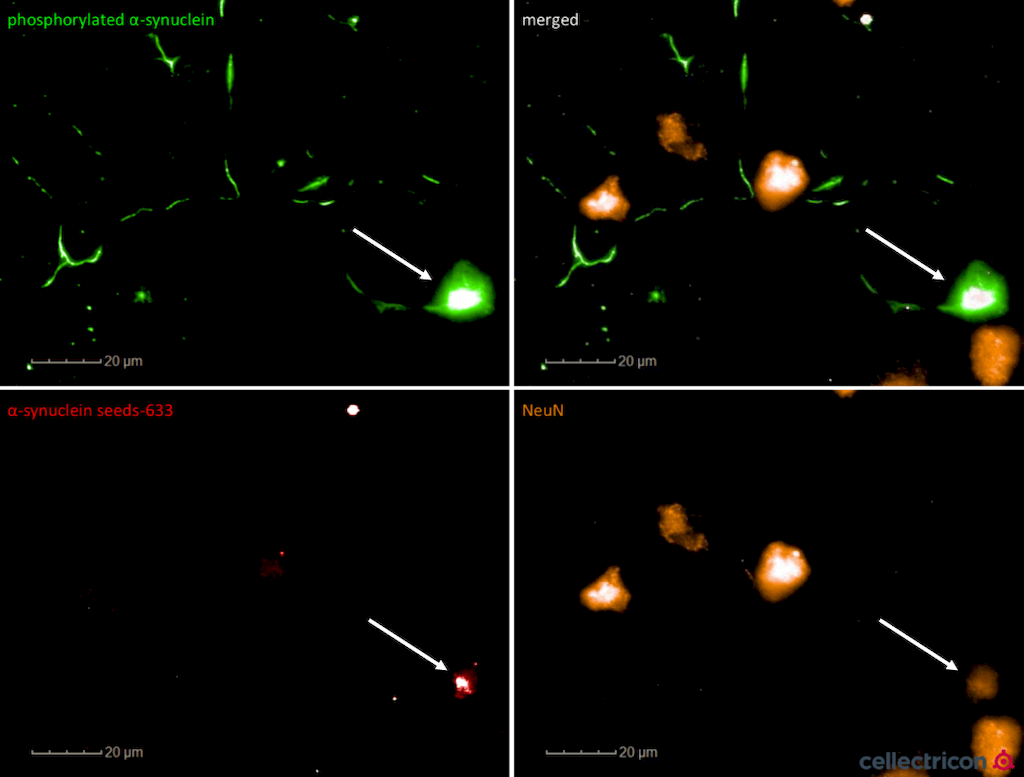
共焦成像显示 充满ATTO633荧光标记的alpha突触核蛋白PFF(SPR-322)的NeuN+ (成熟的) 原代皮质神经元. ATTO-633 alpha 突触核蛋白 PFFs 7天后聚集内源alpha 突触核蛋白磷酸化. 实验和图片来自Cellectricon.
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验- Retinoid X receptor as a novel drug target to treat neurological disorders associated with α-synucleinopathies.
Zhylkibayev, A. et al. (2024) bioRxiv. 2024.06.10.598149.
PubMed ID: N/A 应用范围: Aggregation Assay
- Gut microbiota produces biofilm-associated amyloids with potential for neurodegeneration.
Fernandez-Calvet, A. et al. (2024) Nat Commun. 15(1):4150.
PubMed ID: 38755164 应用范围: Aggregation Assay
- Genetic and pharmacological reduction of CDK14 mitigates synucleinopathy.
Parmasad, J. et al. (2024) Cell Death Dis. 15(4):246.
PubMed ID: 38575601 应用范围: Aggregation Assay
- Identification of glycerol 3-phosphate acyltransferase as a potent modifier of α-synuclein-induced toxicity.
Lim, K.L. et al. (2024) Res Sq. Preprint.
PubMed ID: N/A 应用范围: Aggregation Assay
- Immunization Effects of a Novel α-Synuclein-Based Peptide Epitope Vaccine in Parkinson’s Disease-Associated Pathology.
Park, J.S. et al. (2023) Vaccines. 2023, 11, 1820.
PubMed ID: N/A 应用范围: Functional Assay
- α-Synuclein-dependent increases in PIP5K1γ drive inositol signaling to promote neurotoxicity.
Horvath, J.D. et al. (2023) Cell Rep. 42(10):113244.
PubMed ID: 37838947 应用范围: Aggregation Assay
- Validation of preclinical cellular models to screen the effectiveness of drugs directed to slow down Alzheimers and Parkinsons disease progression.
Luykx, A., Nunen, T., and Beeken, J. (2023) PhD Thesis.
PubMed ID: N/A 应用范围: Aggregation Assay
- Two-color coincidence single-molecule pull-down for the specific detection of disease-associated protein aggregates.
Saleeb, R.S. et al. (2023) bioRxiv Preprint
PubMed ID: N/A 应用范围: Aggregation Assay
- Disrupting the α-synuclein-ESCRT interaction with a peptide inhibitor mitigates neurodegeneration in preclinical models of Parkinson’s disease
Nim, S. et al. (2023) Nature Commun. 2023; 14: 2150
PubMed ID: 37076542 应用范围: Aggregation Assay
- Longitudinal synaptic, inflammatory, and dopaminergic system assessment in a SynFib rat model of Parkinson's disease.
Nykӓnen. H. (2022) Master's Thesis.
PubMed ID: N/A 应用范围: Aggregation Assay
- Granulovacuolar degeneration bodies are independently induced by tau and α-synuclein pathology
Jorge-Oliva, M. et al. (2022) Alzheimers Res Ther. 14(1):187
PubMed ID: 36517915 应用范围: Aggregation Assay
- Rational Generation of Monoclonal Antibodies Selective for Pathogenic Forms of Alpha-Synuclein
Gibbs, E. et al. (2022) Biomedicines 10, 2168.
PubMed ID: 36140270 应用范围: Thioflavin T Assay
- LRP1 is a neuronal receptor for α-synuclein uptake and spread.
Chen, K. et al. (2022) Mol Neurodegener 17(1):57
PubMed ID: 36056345 应用范围: Functional Assay
- Design, Synthesis and Chemically Engineered Graphene Quantum Dot Applications: Contrast Agent for MR Imaging and Targeted Therapeutics on Parkinson’s Treatment.
Poonkuzhali, K., Seenivasagan, R., and Jeevaratnam, K. (2022) SSRN Preprint
PubMed ID: N/A 应用范围: Functional Assay
- α-Synuclein uptake, accumulation, and inflammatory responses in Parkinson's disease.
Stevenson, T.J. (2021) PhD Thesis.
PubMed ID: N/A 应用范围: Aggregation Assay
- Deciphering the role of hsp110 chaperones in diseases of protein misfolding.
Yakubu, U.M. (2021) PhD Thesis Doctoral Dissertations.
PubMed ID: N/A 应用范围: Thioflavin T Assay
- Suppression of aggregate and amyloid formation by anovelintrinsically disordered region in metazoan Hsp110 chaperones.
Yakubu, U.M., Morano, K.A. (2021) J Biol Chem. 296:100567
PubMed ID: 33753171 应用范围: Thioflavin T Assay
 技术资料
技术资料暂无技术资料 索取技术资料