相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 灵敏度:
0.24ng/mL
- 供应商:
上海赛唐生物科技有限公司
- 库存:
定制
- 样本:
细胞上清液
- 标记物:
辣根过氧化物酶 (HRP)
- 适应物种:
通用
- 应用:
工业残留检测
- 检测方法:
ELISA酶联免疫法
- 检测范围:
0-400ng/ml
- 规格:
96T
本试剂盒是用来定量分析以中国仓鼠卵巢细胞(Chinese Hamster Ovary cells,CHO)为表达系统时,蛋白药物中宿主细胞残留蛋白。
CHO 细胞系被广泛用来表达治疗性蛋白,在表达目的蛋白的同时,会伴随着表达细胞自身凋亡,资料显示细胞破碎后释放到培养基中的宿主蛋白达上千种之多,其中很大一部分具有很强的免疫原性,导致不良的毒性或免疫反应而危及产品安全和质量,造成潜在的生物污染,生物医药产品生产下游过程的目的之一就是移除这些潜在危害。
因此,非常有必要将宿主细胞蛋白(HCP)残留量降低到最低水平,在研发下游纯化的工艺时,必须具有一种科学合理的测定成品或者半成品中HCP浓度的方法,而酶联免疫法具有极高灵敏度,因而被监管机构定为HCP检测的金标准。
本试剂盒采用了固相夹心法的酶联免疫吸附实验(ELISA)。先将捕获抗体包被微孔板,制成固相抗体。检测时在包被抗体的微孔板中先加入待测抗原孵育,洗涤后加入辣根过氧化物酶(HRP)标记的检测抗体,形成包被抗体-抗原-检测抗体复合物。经洗涤后去除未参与反应的结合物,最后加入底物TMB显色。TMB在HRP的氧化作用下转化成蓝色,并在酸的作用下转化成最终的黄色。氧化后的TMB颜色和因子的总含量呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),与浓度拟合成标准曲线,通过样本OD值,代入标准曲线方程,计算样品中因子浓度。
试剂盒优势
抗体滴度高:试剂盒中使用的抗体,在动物免疫阶段采用间接法Elisa检测效价达106以上
稳定性高:生产过程采用广谱蛋白稳定剂,和微孔板处理工艺,增加标准品及微孔板热稳定性和结果的可重复性。
稀释液优化:使用优化稀释液,可降低样本检测过程中非特异性吸附,本底显色极低利于观察待测样本浓度。
| 名称 | 规格 | 数量 | 保存 | |
| 1 | 已包被平底微孔板 | 96孔 | 1板(可拆卸) | 2-8℃密封冷藏 |
| 2 | 标准品母液(500μg/mL) | 50μL | 1管 | 2-8℃冷藏 |
| 3 | 检测抗体母液(100×) | 150μL | 1管 | 2-8℃冷藏 |
| 4 | TMB | 10mL | 1瓶 | 2-8℃避光冷藏 |
| 5 | 终止液 | 10mL | 1瓶 | 2-8℃冷藏 |
| 6 | 洗液(100×) | 10mL | 1瓶 | 2-8℃冷藏 |
| 7 | 稀释液(10×) | 10mL | 1瓶 | 2-8℃冷藏 |
| 8 | 封板膜 | 4张 | ||
| 9 | 使用说明书 | 1份 |
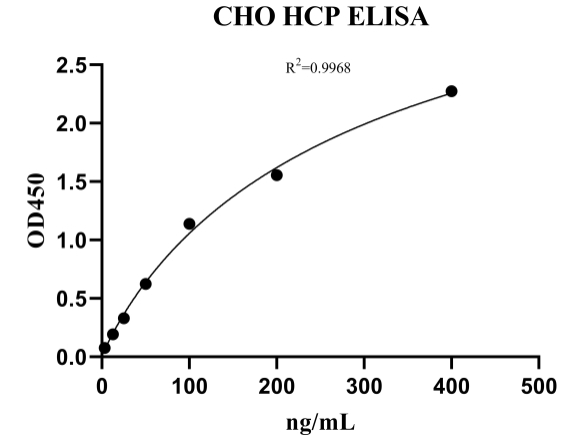 |
Con ng/mL | OD450 | |
| S1 | 400 | 2.586 | |
| S2 | 200 | 1.706 | |
| S3 | 100 | 1.072 | |
| S4 | 50 | 0.622 | |
| S5 | 25 | 0.34 | |
| S6 | 12.5 | 0.224 | |
| S7 | 6.25 | 0.169 |
质量控制
1. 批内差CV%: 6-10
2. 批间差CV%: 6.9-10.4
3. 线性:
| 稀释倍数 | Range % |
| 1:02 | 98.0-102.9 |
| 1:04 | 98.5-110.2 |
| 1:08 | 84.0-105.5 |
| 1:16 | 88.4-108.9 |
| 1:32 | 87.2-110.5 |
| 1:64 | 89.5-110.4 |
灵敏度:
最低检测限(LOD):0.24ng/mL
最低定量限(LOQ):1.95ng/mL
疑问解答
1.CHO HCP ,G3残留检测试剂盒和CHO HCP ,G2残留检测试剂盒有什么区别?
G3针对细胞上清HCP,G2针对细胞内HCP。
2.本产品对标竞品?
Cygnus F550-1
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验[1] Daniel G. Bracewell,Richard Francis,C. Mark Smales. The Future of Host Cell Protein (HCP) Identification During Process Development and Manufacturing Linked to a Risk-Based Management for Their Control[J]. Biotechnology and Bioengineering, 2015, 112(9):1727-1737.
[2] European Medicines Agency. ICH Topic Q 6 B. Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products[S]. 1999.
[3] Guideline on Immunogenicity assessment of therapeutic proteins[S]. EMEA guidelines CHMP, BMWP, 2006, 14327.
[4] Position statement on DNA and host cell proteins (HCP) impurities, routine testing versus validation studies[S]. EMEA guidelines CPMP. BWP, 1997, 382, 97.
[5] Points to Consider in the Manufacture & Testing of Monoclonal Products for Human Use[S]. US Food and Drug Administration, 1997, FDA-1994-D-0318.
[6] Office of Biotechnology Products Recommended Practices (OBP-RP-004)[C]. WCBP, 2013.
[7] 王志明. 基因工程药物中宿主细胞蛋白的检测与控制[J]. 中国新药杂志, 2016, 25(22):2550-2557.
 技术资料
技术资料暂无技术资料 索取技术资料








