普康智合(成都)生物制品有限公司
1 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
新研究 | 高致病性猪繁殖与呼吸综合征毒株遗传与致病性的演化规律
154 人阅读发布时间:2025-08-04 17:10
2006年,由经典PRRSV演化而来的HP-PRRSV在中国引发以高热、高发病率、高死亡率为特征的疫情,随后该毒株在中国及亚洲多区域广泛传播,并伴随显著变异。HP-PRRSV及其变种已成为中国优势流行毒株,但针对新型L8.7 PRRSV的流行规律、分子进化及致病性研究仍存在空白。
2025年5月22日,一项发表于《Taylor & Francis》期刊的“高致病性猪繁殖与呼吸综合征病毒的遗传进化和致病性变异”的研究,系统的阐明了L8.7谱系的流行动态、进化趋势、疫苗株关联性及致病性演变规律。

该项研究为制定L8.7 PRRSV防控策略提供了关键数据支撑。
内容摘要
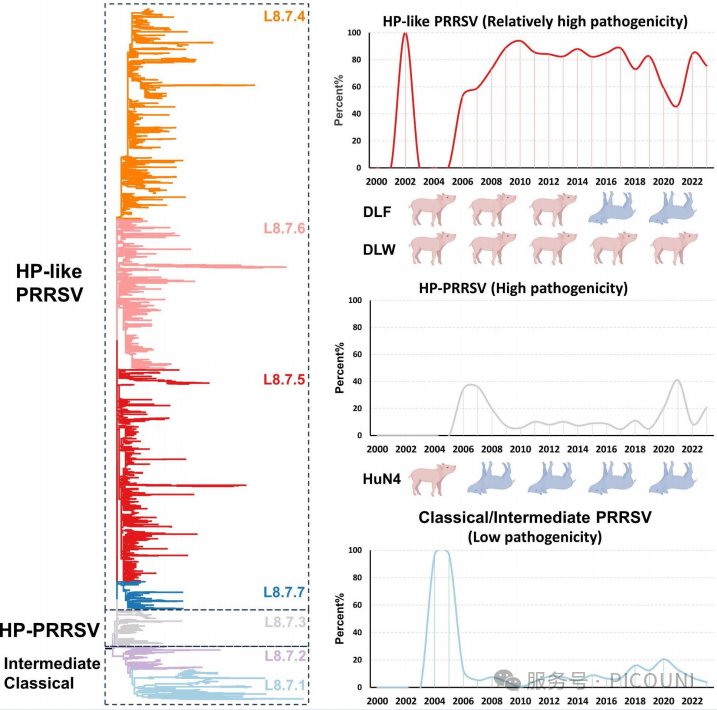
实验结果
# L8.7 PRRSV的分类
为解析PRRSV L8.7的进化特征,该项研究共采用2509条ORF5序列进行分析:其中2159条L8.7毒株序列源自NCBI数据库,350条为实验室2014至2023年收集的L8.7毒株序列(图1(a))如图所示,L8.7毒株进一步划分为7个组别(L8.7.1~8.7.7)(图1(a,b));所有序列信息为(图2)。
如图1(b)所示,用于构建系统进化树的参考毒株来自已知经典毒株及致病性研究中报道的L8.7 PRRSV毒株。组内与组间平均遗传距离如图1(c)所示。除L8.7.2外,其他组内平均遗传距离均低于5%;总体而言,组间遗传距离普遍为4.3%~10.4%。此外L8.7.4-L.7.7毒株展现出具有不同特征的特定氨基酸突变模式,被定义为类HP-PRRSV。在L8.7群体2509条序列中,2.23%(56/2509)属于L8.7.1(CH-1a样PRRSV),4.74%(119/2509)为L8.7.2(中间型PRRSV),11.48%(288/2509)为L8.7.3(HP-PRRSV),81.54%(2046/2509)为类HP-PRRSV。
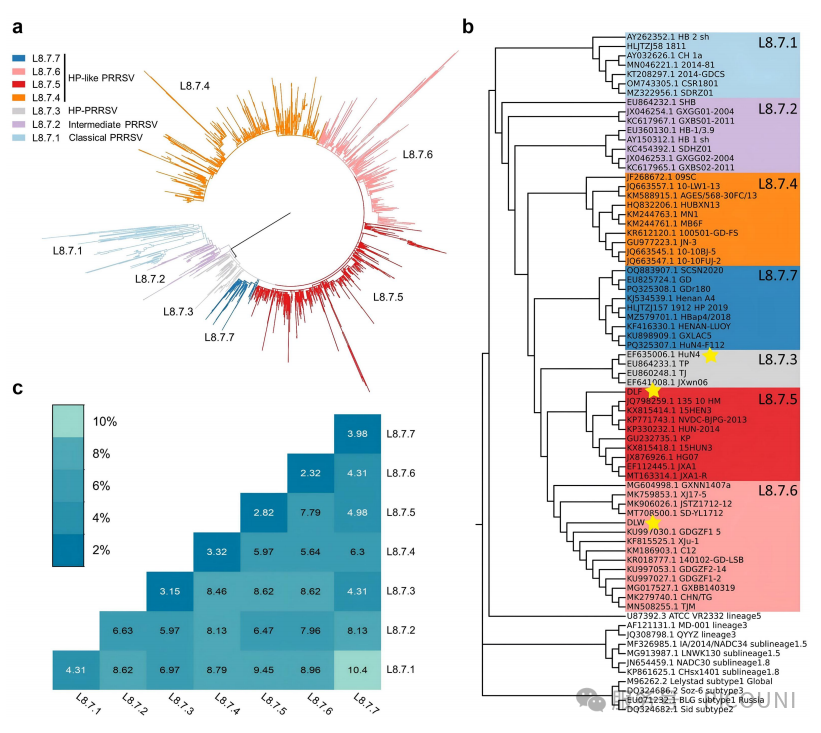
图1 L8.7毒株的系统进化树与核苷酸一致性分析
(a)将L8.7序列划分为7个组别的系统进化树。(b)基于L8.7 PRRSV分离株ORF5基因及各谱系参考PRRSV毒株构建的系统进化树,该项研究中涉及的动物实验毒株以黄色五角星标注。(c)L8.7毒株组内与组间遗传距离(核苷酸差异百分比)。
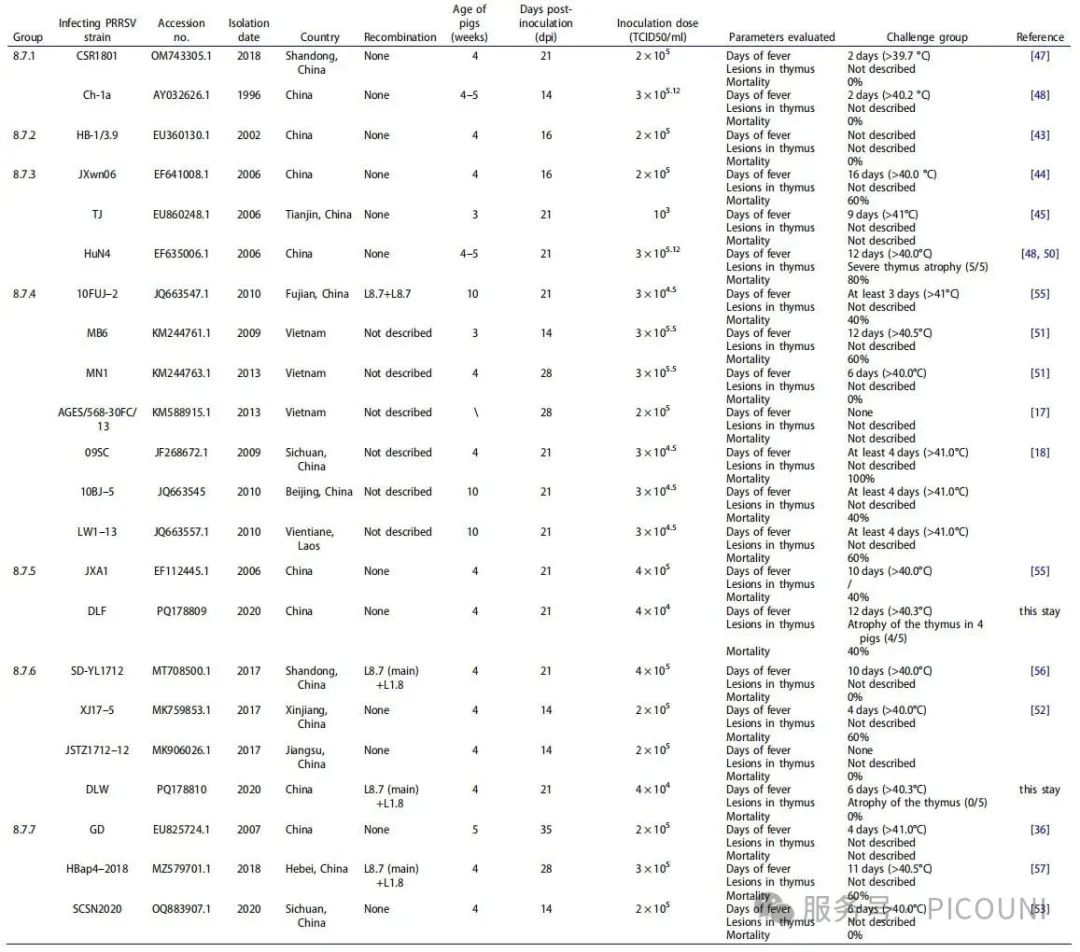
图2 L8.7.1-L8.7.7 PRRSV致病性比较分析
# L8.7 PRRSV的全球分布
该项研究对已知时间与地域信息的L8.7序列进行全面分析。值得注意的是,L8.7.4组别流行范围最广,存在L8.7毒株的9个国家中覆盖了8个(图3(a,b))。尼泊尔、老挝及缅甸仅检出单一组别L8.7.4,未发现其他组别。L8.7.1、8.7.3、8.7.5、8.7.6和8.7.7毒株分别分布于2、3、4、4和2个国家(图3(a,b))。L8.7.2毒株目前仅在中国有报道(图3(b))。中国L8.7 PRRSV毒株数量(2201/2509,87.7%)与多样性(7/7组别,100%)均居首位(图3(b))。
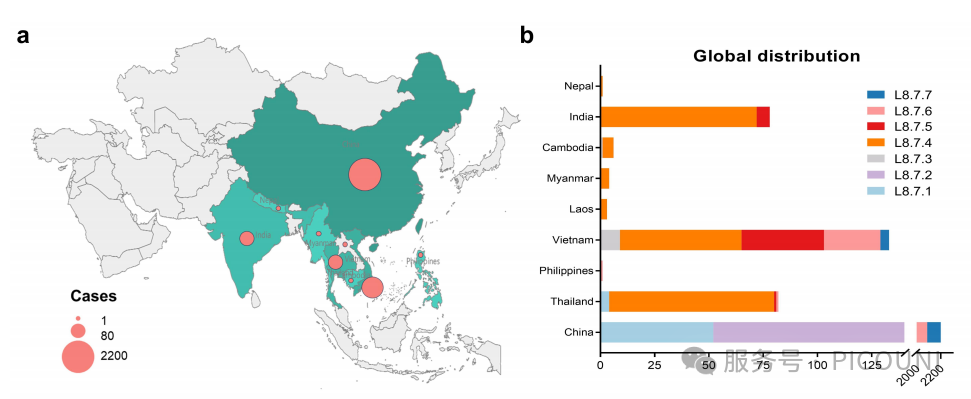
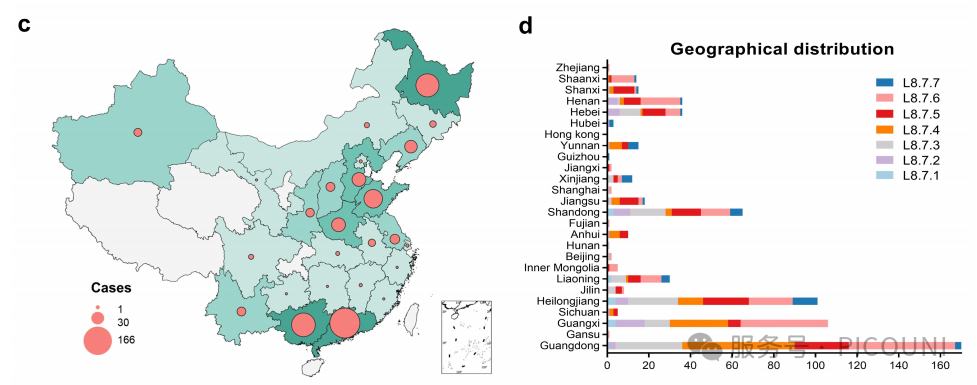
图3(c) L8.7毒株在中国不同区域的地理分布 图3(d) L8.7毒株在中国各省份的数量分布
类HP-PRRSV(L8.7.4-8.7.7)逐步取代HP-PRRSV成为中国的主要流行毒株(图3(e))。其中,L8.7.4组别于2006年在中国首次被报道并监测,2009-2011年间在中国L8.7毒株中占据较大比例(41.3%~79.6%)。值得注意的是,部分组别流行率呈现突发性增长:如L8.7.5组别于2007年在中国首次出现并持续流行,但自2011年起其占比显著提升(17.1%~51.6%)(图3(f))。值得关注的是L8.7.6毒株的周期性流行特征。该组别最早于2002年(EU709835.1,SH02)被鉴定,初期检出数量极少(仅1株),2003-2005年间未检出,2006年快速增加后于2009年前逐步减少;随后在2014-2023年间成为主要流行毒株,占比达21.5%~47.1%。L8.7.6组别在中国检出率最高(612/2201,27.8%),且分布范围最广(20/21省份,95.2%)(图3(d,f))。L8.7.7组别于2008年首次被监测到,但直至2011年其流行率仍较低,此后逐步上升;2022-2023年间检出率快速增长至15.1%~17.1%。
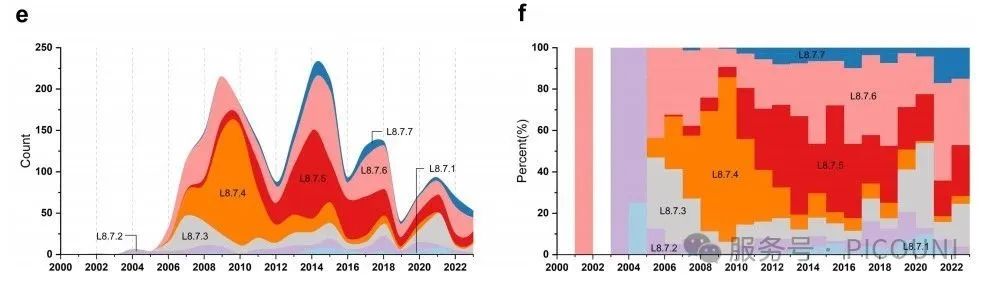
图3(e) 基于ORF5序列的L8.7毒株随时间分布数量 图3(f) 中国区域相对频率的堆叠柱状图

表1 HP-PRRSV弱毒疫苗(MLV)与类HP-PRRSV毒株的全基因组关联性分析
结果表明,区分疫苗样PRRSV与类HP-PRRSV的关键无法通过全基因组核苷酸一致性或特征性氨基酸变化归纳,但可通过NSP2额外缺失特征判断(表1)。统计分析显示,L8.7.6谱系中27.85%(22/79)的毒株与疫苗存在关联。
HP-PRRSV及类HP-PRRSV毒株对仔猪的致病性
#类HP-PRRSV优势毒株的分离与鉴定
为系统解析类HP-PRRSV中优势流行组别(L8.7.5与L8.7.6)的致病性,该项研究成功分离出L8.7.5谱系毒株DLF与L8.7.6谱系毒株DLW。上述病毒分离自猪肺泡巨噬细胞(PAMs)及Marc-145细胞。IFA检测显示,接种毒株的PAMs及Marc-145细胞中均可见PRRSV M蛋白表达(图4(a)),表明DLF与DLW毒株分离成功。
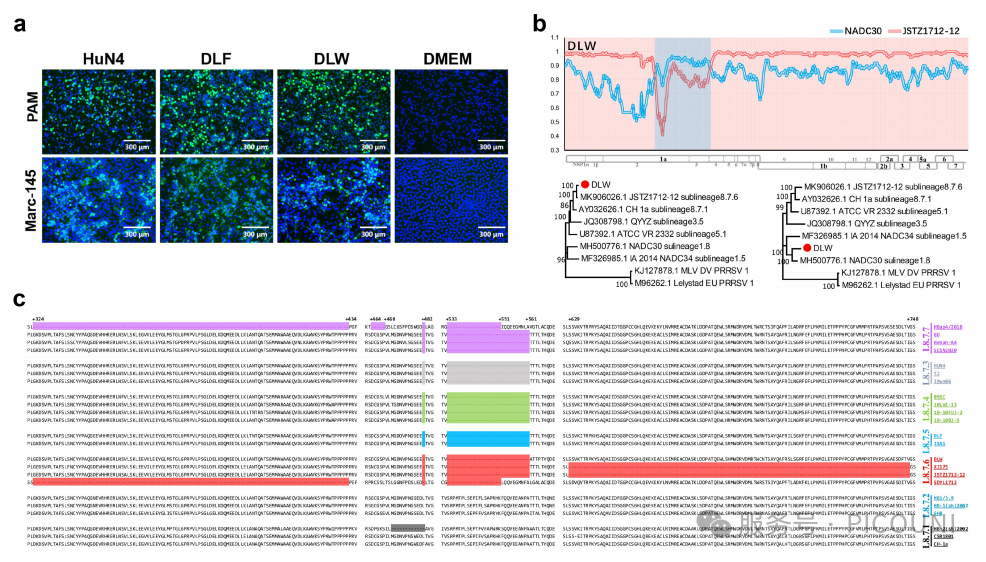
图4 L8.7毒株的分离培养、重组分析及特征性NSP2氨基酸比对
(a)DLW与DLF毒株鉴定。通过靶向PRRSV M蛋白的单克隆抗体进行免疫荧光试验(IFA),在对照组、DLF感染组、DLW感染组及HuN4感染组的PAMs与Marc-145细胞中观察到特异性反应。细胞核经DAPI复染。标尺=300微米。(b)DLW重组事件分析。(c)L8.7毒株NSP2蛋白推断氨基酸序列比对。
# DLF和DLW的基因组特征
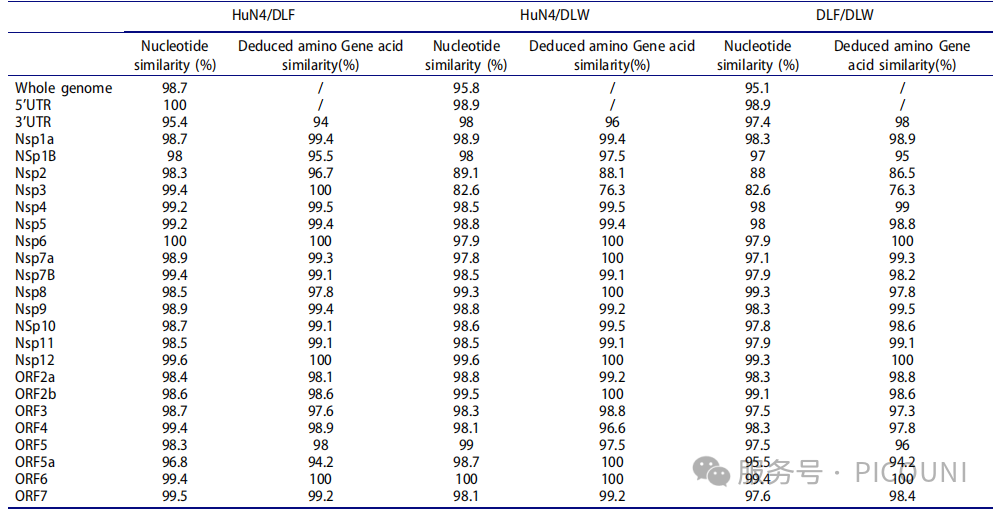
DLF(PQ178809)与DLW(PQ178810)的全基因组长度分别为15,324和15,323个核苷酸(不含poly(A)尾)。HuN4/DLF、HuN4/DLW及DLF/DLW间的基因组核苷酸相似性分别为98.67%、95.78%和95.13%(如下表)。
NSP2蛋白序列比对显示,DLF与DLW在CH-1a毒株NSP2蛋白第482位及533-561位氨基酸处存在不连续缺失30个氨基酸(1+29个氨基酸),该缺失模式与L8.7.3(HP-PRRSV)一致(图4(c))。为探究DLF与DLW是否涉及重组事件,通过SimPlot和RDP4软件分析发现:DLW存在重组事件(重组位点为3500-5657 nt),而DLW未发生重组(图4(b))。无论是基于前期研究还是本研究的疫苗株与野毒株区分标准,DLF与DLW均属于野生型毒株。
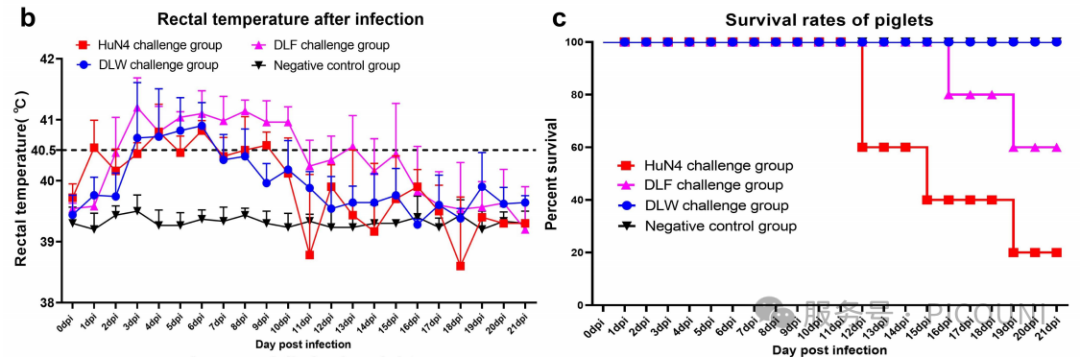
图5(b)DLF、DLW及HuN4攻毒后直肠温度变化趋势
图5(c)DLF、DLW及HuN4攻毒后存活率
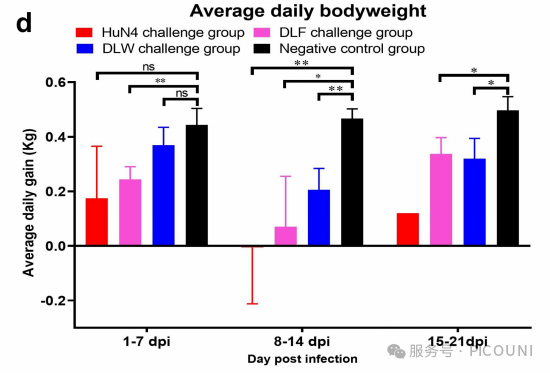
图5(d)DLF、DLW及HuN4攻毒组平均日增重变化
数据以平均值±标准差(误差线表示)展示。:p<0.05;:p<0.01;:p<0.001;****:p<0.0001;ns:无统计学差异
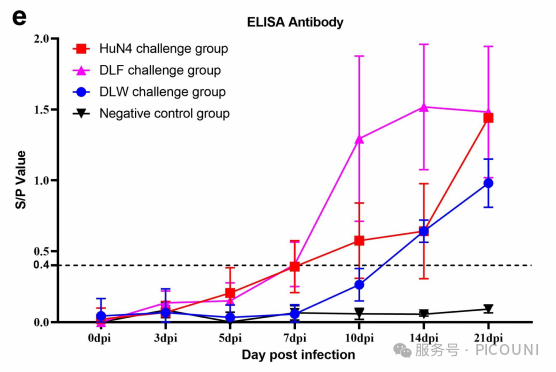
图5(e)DLF、DLW及HuN4攻毒诱导的抗PRRSV抗体滴度变化
# 病毒血症及不同组织病毒载量评估
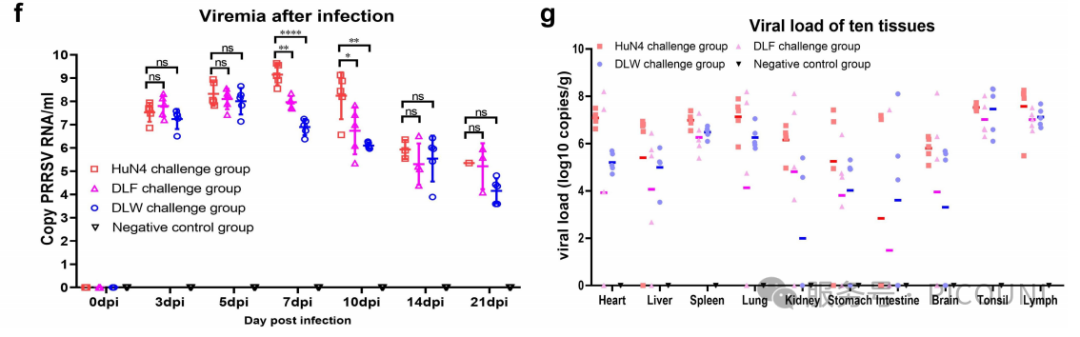
图5(f)DLF、DLW及HuN4攻毒诱导的病毒血症动态变化
图5(g)DLF、DLW及HuN4攻毒组各组织中的病毒载量分析
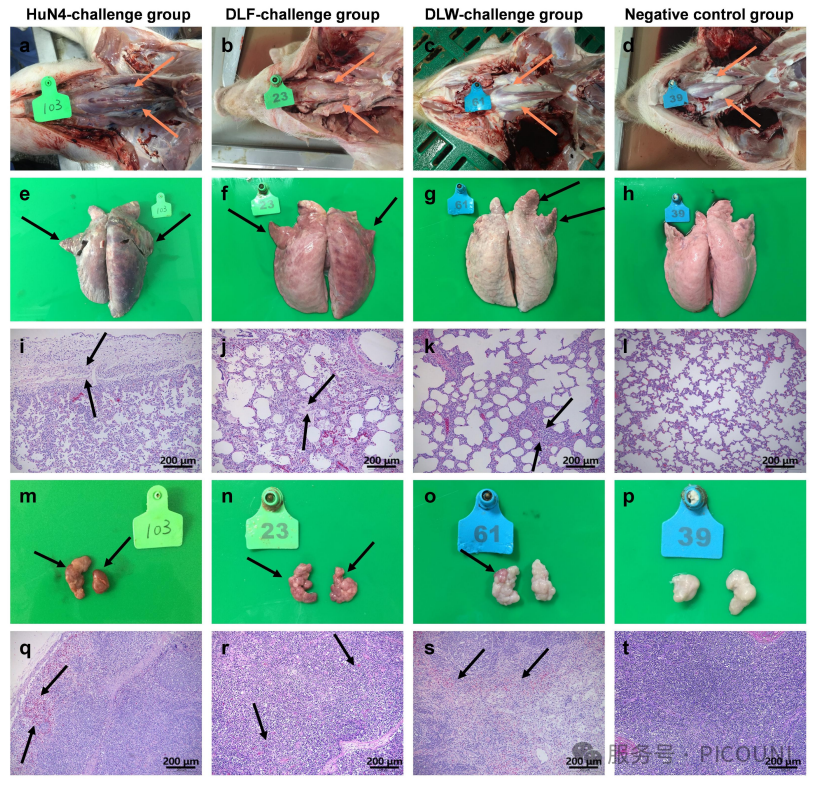
图6 不同攻毒组的大体与组织学肺部病变
结论
L8.7谱系是中国境内最早发现的PRRSV谱系,已持续流行超过25年。2006年,由经典PRRSV演化而来的HP-PRRSV在中国引发以高热、高发病率、高死亡率为特征的疫情,随后该毒株在中国及亚洲多区域广泛传播,并伴随显著变异。值得注意的是,HP-PRRSV及其变种已成为中国优势流行毒株,但针对新型L8.7 PRRSV的流行规律、分子进化及致病性研究仍存在空白。因此,该项研究聚焦L8.7 PRRSV开展了系统全面的分析。
对L8.7毒株的关注焦点主要集中于其致病性,尤其是2006年L8.7.3毒株(HP-PRRSV)引发疫情后。为此,该项研究分离并评估了当前L8.7谱系中最具流行优势的类HP-PRRSV毒株(L8.7.5:DLF;L8.7.6:DLW)的致病性。结果显示,尽管类HP-PRRSV(DLF与DLW)的毒力相较于HP-PRRSV(HuN4)有所下降(表现为仔猪存活率上升、日增重提高、发热温度及时长降低、胸腺萎缩程度差异),但其仍具有显著的致病性。该项研究中病毒毒力与攻毒仔猪7 dpi和10 dpi的血清病毒载量呈相关性,而其他时间点未观察到显著差异。因此,生存率、发热温度及时长、胸腺萎缩程度是客观反映PRRSV对仔猪致病性的重要指标。
自2016年L1谱系PRRSV在中国流行以来,重组毒株报道逐渐增多,中国主要重组模式为L1(L1.5或L1.8)与L8.7或L8.7与L1(L1.5或L1.8)的重组。该项研究中DLW为L8.7与L1.8的重组毒株(重组模式:L8.7+L1.8),其致病性低于HuN4及DLF。尽管DLW对仔猪的致病性显著降低,但毒力下降与重组事件的关联性仍需深入研究。总体而言,除L8.7.1(低致病性)和L8.7.2(低致病性)毒株外,L8.7.3毒株对仔猪具有强致病性。结合前期报道的2006年L8.7.5毒株及2017年L8.7.6毒株致病性实验结果,类HP-PRRSV(L8.7.4~8.7.7)在保持较高毒力的同时,对仔猪的致病性较L8.7.3毒株有所减弱(如上述图2)。
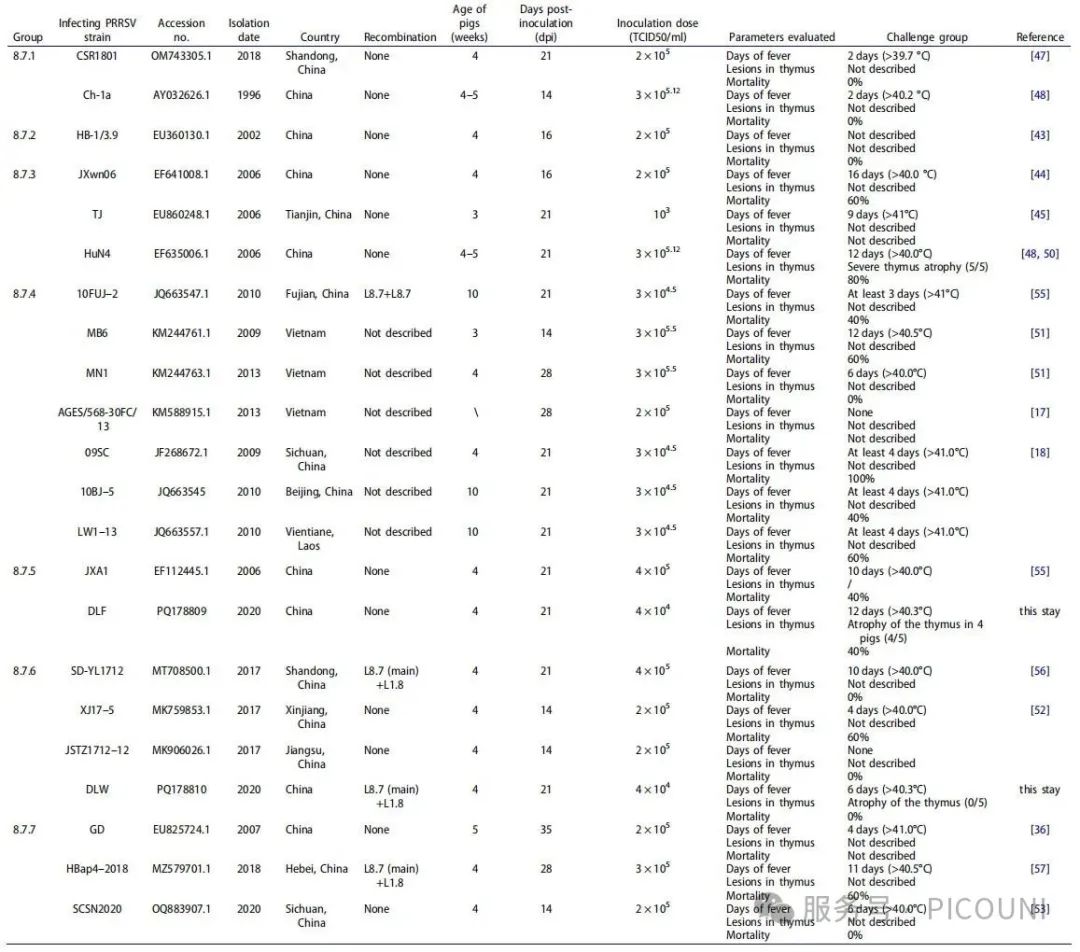
图2 L8.7.1-L8.7.7 PRRSV致病性的比较分析
# 探讨观点
1. 致病性演变的临床启示
动物实验表明,HP-like毒株(如DLW/L8.7.6)虽致死率低于经典HP-PRRSV(HuN4),但可引起持续高热(>41℃)和生长抑制,且淋巴结病毒载量居高不下。这解释了临床上为何部分病例虽无急性死亡,却出现顽固性呼吸道症状和继发感染。建议诊断时需结合ORF5测序与组织病理分析,避免将HP-like毒株误判为低致病性毒株。
2. 防控策略的优化方向

产 品 推 荐
⬇

END
地址:成都天府国际生物城(双流区凤凰路269号14栋1单元1001)




