Olink Proteomics品牌商
1 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
以Olink Explore触碰蛋白组学检测边界,为何"看不见"的蛋白更有价值?
83 人阅读发布时间:2025-11-13 14:15
在精准医疗的探索中,蛋白组学正重塑我们对多种疾病机制的认知。与基因组相比,蛋白质作为生命活动的直接执行者,更能反映机体在“后天”环境中的动态变化,揭示那些基因组层面难以捕捉的病理机制。
近年来,随着高深度质谱、邻位延伸技术(PEA)等突破性方法的涌现,蛋白质组学已实现对数以千计蛋白的高通量检测。然而,技术能力的提升也带来了新的挑战:研究人员开始面临“如何在数千种蛋白质中,精准识别出真正具有临床价值的标志物”这一关键问题。尽管新技术能够产生海量数据,但若缺乏有效的聚焦方向,宝贵的生物学信号仍可能淹没在数据噪音的海洋中,难以转化为临床可用的可靠标志物。
今天,借助Olink Explore HT平台近期对6,800例样本的系统性分析结果,我们将和大家一同探讨:高通量蛋白质组学如何从“追求数量”转向“聚焦价值”。并直面一个核心问题:当技术已能覆盖近万种蛋白时,我们究竟需要多少数据,才能穿透噪音,触达真实的生物学真相?
打破误区
每份血样都应检出所有蛋白?
-
常见性观测蛋白(Commonly observed proteins):在大多数情况下为大部份个体所共有。 -
条件性观测蛋白(Conditionally observed proteins):针对特定个体在特定的时间被观察到.
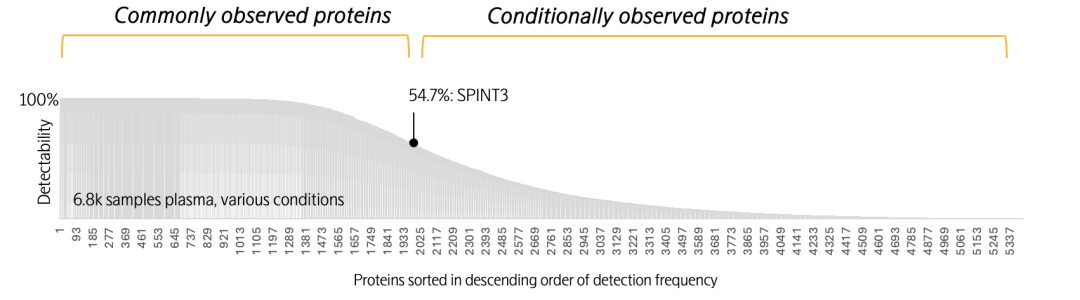
Olink Explore HT在6800份多维样本中的蛋白质检出率
(横坐标为1-5400号蛋白质,纵坐标为超出检出限的样本比例)
以SPINT3蛋白为例,它是一种具有组织特异性与生理特异性的蛋白质,主要由男性生殖组织产生,为典型的“条件性观测蛋白”。在6,800份血浆样本中,其54.7%的检出率精准匹配了研究群体的性别比例,充分验证了Olink Explore平台检测的生物学合理性。
样本类型与蛋白“可见性”的关系
组织与血浆的惊人差异
某些蛋白质在血液中为常见性观测蛋白,但在细胞和组织中则为条件性观测蛋白。例如,SERPINC1(凝血调节蛋白,由肝脏分泌)、GC(维生素D运输蛋白,由肝脏分泌)以及GUCA2A(食欲调节蛋白,由结肠与回肠分泌)在血浆样本中普遍可被检测(检出率99.9%),反映出其在循环系统中的稳定存在。然而,由于这些蛋白的组织来源具有特异性,SERPINC1 和 GC 仅由肝脏表达,而 GUCA2A 仅由结肠和回肠表达。当对164份不同细胞和组织的裂解液样本进行检测,这些蛋白质仅在其来源组织中被检测到(数据见下图)。这也表明了,采用Olink Explore平台所获得的检测结果符合样本的生物学特性。
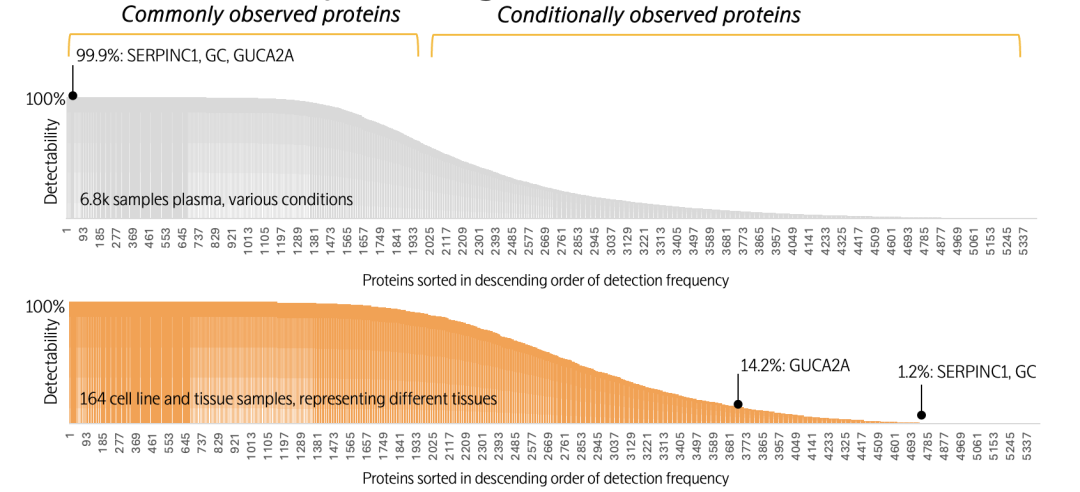
与分泌至血液中广泛分布的蛋白质相反,另一类蛋白因其细胞内定位特性,在血液中难以检测,却在特定组织或细胞中高表达。例如,转录因子TP53主要定位于细胞核内,而雌激素受体ESR1作为膜结合蛋白,特异性表达于子宫内膜、乳腺等激素应答组织。这两类蛋白在血液中的检出率极低,但在相应的组织或细胞裂解物中可被稳定检测。这一分布差异不仅反映了蛋白质功能与其亚细胞定位、组织表达模式之间的紧密关联,也为生物标志物研究提供了重要启示:在试验设计时,应依据目标蛋白的生物学特性,合理选择不同类型的样本,以提高标志物检出的有效性和准确性。

“稀缺”的价值
条件性观测蛋白的临床潜力
CEACAM5(癌胚抗原相关细胞粘附分子5)在6,800份泛人群血浆样本中检出率仅为1.3%,但在特定的结直肠癌研究队列中,检出率显著提升至78.4%。这一跨越不同人群的显著差异,不仅印证了CEACAM5在区分结直肠癌患者与健康个体方面的鉴别能力,也凸显了其作为潜在诊断标志物的早期应用价值。
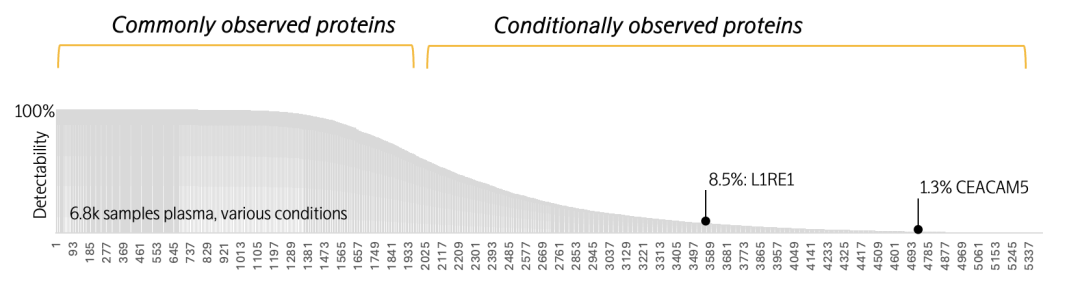
L1RE1(LINE-1反转录转座子元件ORF1蛋白)在广泛人群血浆样本中的检出率仅为8.5%,但在III-IV期恶性卵巢癌患者中的检出率为77.7%(在良性肿瘤队列中为9.6%)。瑞典乌普萨拉大学免疫学、遗传学和病理学系Ulf Gyllensten教授团队利用Olink Explore HT技术,在未经治疗的卵巢癌队列中验证了L1RE1等蛋白在区分良恶性卵巢癌方面的能力。该研究首次提出L1RE1可作为鉴别晚期卵巢癌与良性肿瘤的潜在生物标志物,此前L1RE1尚未被报道与癌症相关。

以真实的生物学视角,加速标志物发现
Olink Explore平台检测结果的可靠性及其所带来的深刻生物学洞察,已获得全球学术界与大型队列研究的广泛验证,包括截止到2025年10月份已发表的3,200余篇同行评议论文,以及UK Biobank制药蛋白组学(UKB-PPP)和再生元遗传学中心等多项权威项目的认可。
此外,发表于《Science Advances》与《Nature》等顶刊的重要研究均已表明,尽管Olink在蛋白检测数量上并非最高,其数据却能揭示更多具有生物学意义的表型关联。这源于Olink研发端对于蛋白标志物库的“精挑细选”与“严格验证”:通过精准聚焦与系统验证,确保所选蛋白覆盖关键生物学通路,同时具备高度的准确性与临床应用潜力。
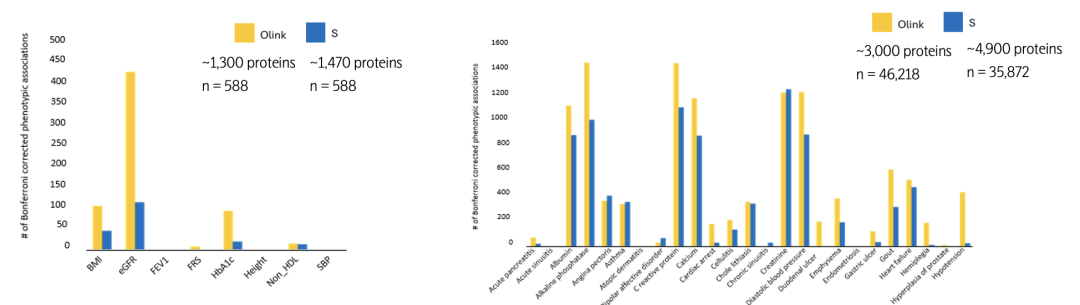
展望未来


基于“常见性观测蛋白”与“条件性观测蛋白”的分类框架,研究人员能够:
-
建立起更可靠的基础参考范围;
-
优先关注到在特定疾病队列中显著高发的“条件性蛋白质”;
-
构建更具特异性和临床相关性的生物标志物模型。
最终将目光聚焦于关键的生物学事件,减少数据噪音的干扰,加速从蛋白质组学数据到可临床应用的标志物转化,为精准医疗开辟更为清晰、可靠的研究路径。
参考文献:
1. John E Blume, Michael Wilhelmsen, Ryan W Benz, et.al, Discovery and Validation of Plasma-Protein Biomarker Panels for the Detection of Colorectal Cancer and Advanced Adenoma in a Danish Collection of Samples from Patients Referred for Diagnostic Colonoscopy, The Journal of Applied Laboratory Medicine, Volume 1, Issue 2, 1 September 2016, Pages 181–193,
2. Moskov, M., Hedlund Lindberg, J., Lycke, M. et al. Deep plasma proteomics identifies and validates an eight-protein biomarker panel that separate benign from malignant tumors in ovarian cancer. Commun Med 5, 230 (2025).
3. Katz DH, Robbins JM, Deng S, et al. Proteomic profiling platforms head to head: Leveraging genetics and clinical traits to compare aptamer- and antibody-based methods. Sci Adv. 2022 Aug 19;8(33):eabm5164. doi: 10.1126/sciadv.abm5164. Epub 2022 Aug 19. PMID: 35984888; PMCID: PMC9390994.
4. Eldjarn, G.H., Ferkingstad, E., Lund, S.H. et al. Large-scale plasma proteomics comparisons through genetics and disease associations. Nature 622, 348–358 (2023).