Olink Proteomics品牌商
1 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
Olink蛋白组学助力斯坦福团队揭秘脑与免疫系统是健康长寿的关键
109 人阅读发布时间:2025-11-24 14:50
研究背景
衰老是导致器官功能障碍,慢性疾病及死亡的根源。目前人类对衰老分子机制的认知仍然有限。研究表明,人体器官存在差异化的衰老速率。既往的衰老评估模型及传统临床指标(如表观遗传时钟、DNA甲基化检测)存在显著局限性:它们仅能反映机体的整体衰老状态,却无法精准捕捉不同器官间衰老速率的差异——例如,一个人的心脏可能比实际年龄衰老10岁,而肝脏却比实际年龄年轻5岁,这种器官特异性衰老的异质性长期被忽视。
更关键的是,传统方法难以阐明器官衰老与具体疾病之间的关联逻辑,也无法明确多个器官衰老如何协同作用并最终影响死亡风险。在抗衰老干预领域,这一困境更为突出:既缺乏能够量化器官衰老程度的有效工具,也缺少可转化为临床应用的分子标志物,导致难以精准关联器官功能状态、疾病发生风险与长寿潜力。
以Olink为代表的血浆蛋白质组学技术凭借两大核心优势,为破解这一系列难题提供了突破口:其一,血液样本具有临床极易获取的特性,大幅降低了检测门槛;其二,随着技术的迭代升级,检测精度与覆盖范围不断提升。这些进步使其成为深入解析器官健康状态、精准评估器官特异性生物学年龄的理想手段。

斯坦福大学研究团队在国际期刊Nature medicine(IF=50)发表了一项重磅研究:Plasma proteomics links brain and immune system aging with health span and longevity。该研究通过使用高通量高灵敏的Olink PEA技术对英国生物样本库(UK Biobank)近45,000人血浆中的3,000多个蛋白质进行研究,构建了覆盖人体11个主要器官的生物年龄预测模型。
研究发现:大脑与免疫系统的生物学年龄相对年轻化,是维持健康长寿的核心决定因素。这项通过大规模血浆蛋白质组学分析取得的重要成果,不仅为解析器官衰老的异质性机制提供了新视角,更为实现精准化抗衰老干预策略奠定了科学基础。
研究设计
该研究基于英国生物样本库大规模人群队列,通过系统性血浆蛋白组学分析,构建了器官衰老模型,核心设计如下:
研究样本与数据
-
核心队列:英国生物样本库(UK Biobank)的 44,498 名参与者(年龄 40-70 岁),血浆样本通过Olink Explore 3072平台检测了2,916 种蛋白质(数据来自 UKB-PPP 项目,含随机样本与疾病富集样本)。
-
验证队列:纵向验证(1,176人,1-15年随访,Olink 1,536平台检测了1,459 种蛋白);跨平台验证(斯坦福 601人);影像学验证(45,574人MRI脑体积数据)。
核心技术路线
基于GTEx组织RNA数据库,筛选器官特异性蛋白,共鉴定了11个器官(包括脑、心脏、免疫系统等)的富集蛋白集;使用LASSO回归(五折交叉验证优化参数)构建了11个器官特异性模型(基于器官富集蛋白),1个整体模型(非器官特异性蛋白)和1个传统模型(全部蛋白质);11个中心的23,140个样本做训练集,剩余11个中心的21,358样本做测试集;计算年龄差:年龄差=预测年龄-实际年龄,z标准化后用于跨器官比较。
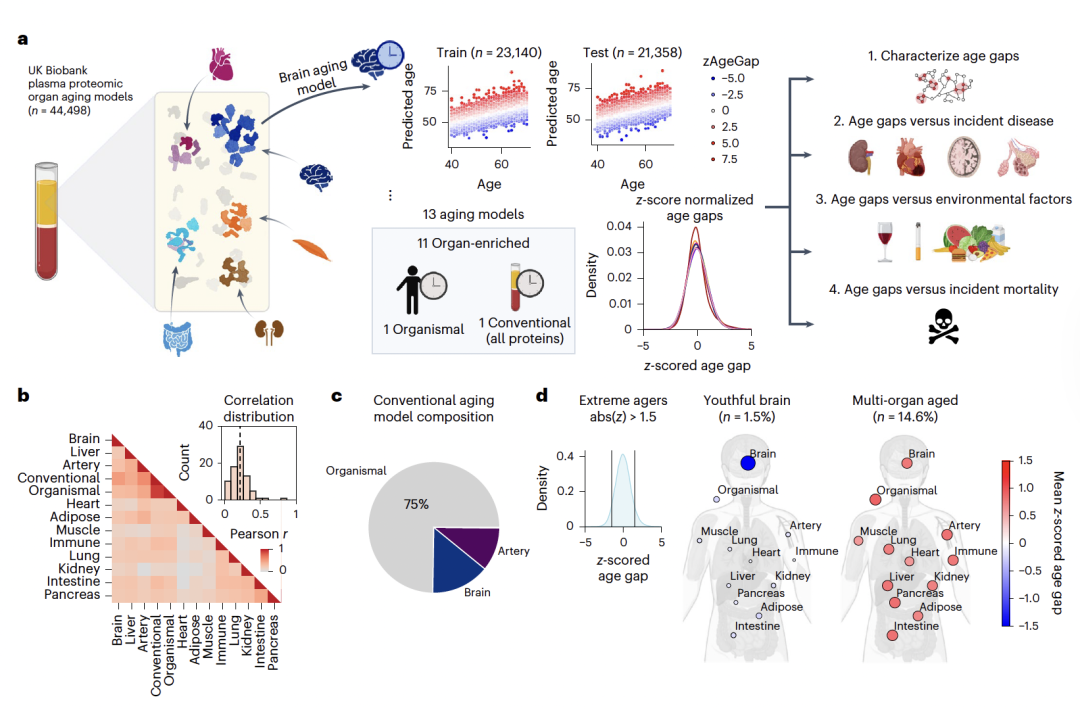
英国生物样本库(UKB)基于血浆蛋白的器官年龄预测
验证与拓展分析
为确保研究结果的可靠性,团队进行了多项验证:
-
纵向稳定性验证:对1,176人进行1-15年随访,发现器官年龄差在9年内保持中等至强相关性(平均r=0.6);
-
跨平台验证:对比不同平台(斯坦福队列,n=1,636),关键器官模型如心脏(r=0.82)、肾脏(r=0.81)表现出高度一致性;
-
影像学验证:与45,574人的MRI脑体积数据进行对比分析。
亮点结果
研究发现,大脑和免疫系统的年轻态是长寿的关键。数据分析显示:
-
多器官衰老会累加死亡风险:2-4个衰老器官HR=2.3,5-7个HR=4.5,8个以上HR高达8.3
-
单器官年轻化中,只有大脑年轻(HR=0.60)和免疫系统年轻(HR=0.58)能显著降低死亡率
-
大脑和免疫系统双年轻的人群死亡率最低(HR=0.44),相比正常衰老人群,17年随访期间死亡率降低56%
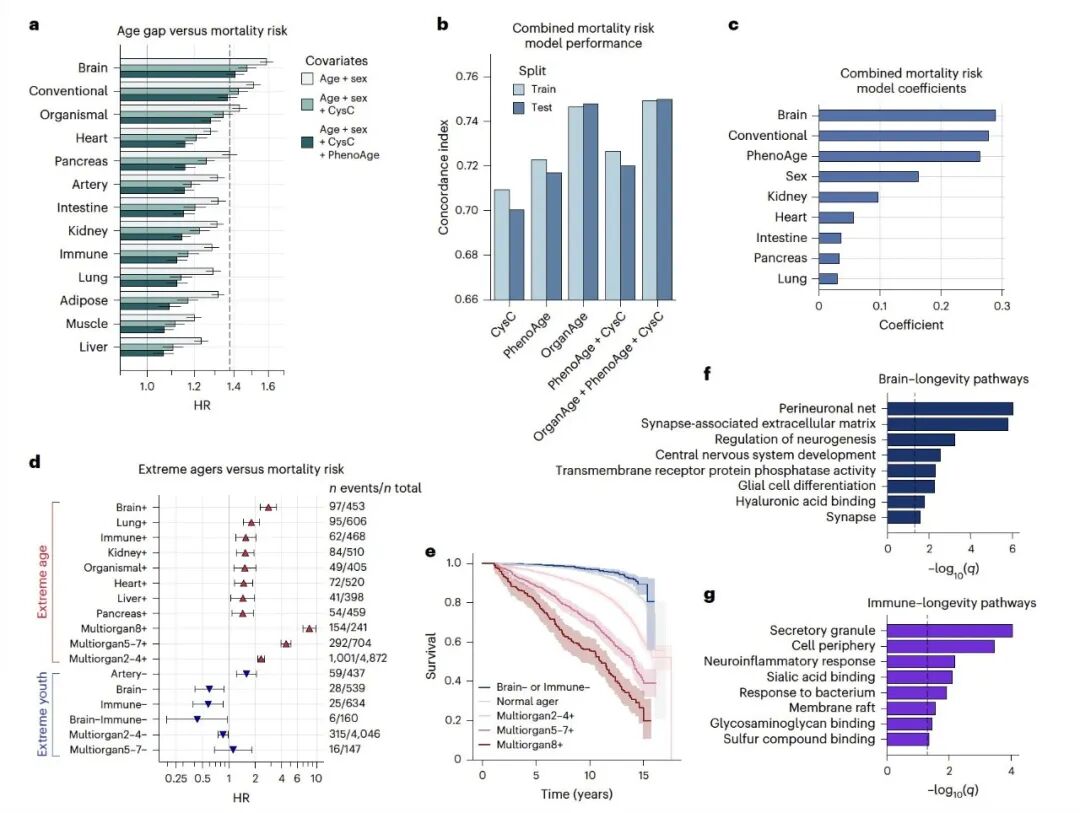
器官衰老程度的增加会逐渐提高死亡风险,而大脑和免疫系统的年轻状态则与长寿有关
这一发现,为"脑-免疫轴调控全身衰老"理论提供了强有力的流行病学证据。研究表明,大脑可能通过神经内分泌系统调控免疫功能,而免疫系统又通过炎症反应影响大脑健康,形成双向调控网络。
深入分析发现,脑衰老相关蛋白主要来源于少突胶质细胞系,与神经周网(perineuronal nets)的维持密切相关。其中:
-
神经丝轻链(NEFL):反映轴突损伤,是脑衰老模型中最具权重的蛋白
-
髓鞘少突胶质细胞蛋白(MOG):髓鞘外表面成分,随年龄增加而升高
-
胶质纤维酸性蛋白(GFAP):反应性星形胶质细胞标志物,随年龄增加
-
短蛋白聚糖(BCAN):细胞外基质成分,随年龄减少
这些发现表明,白质退化与神经周网破坏可能是脑衰老的核心机制,为神经退行性疾病的防治提供了新靶点。
该研究还评估了生活方式对器官衰老的影响,发现了多项可干预因素:
-
加速衰老的因素:吸烟、饮酒、加工肉类摄入、失眠等
-
延缓衰老的因素:剧烈运动、多脂鱼类摄入、禽肉摄入、高等教育等
-
潜在有益的药物/补充剂:结合雌激素(改善绝经后女性免疫/肝脏衰老)、布洛芬、葡萄糖胺、鱼肝油、多种维生素和维生素C等
特别值得注意的是,雌激素治疗与免疫系统(HR=0.58)、肝脏和动脉的年轻化显著相关,为绝经后女性的抗衰老干预提供了新思路。
这项研究为我们揭开了衰老之谜的重要一角,证实了大脑和免疫系统在健康长寿中的核心地位。随着科学技术的进步,人类或许很快就能通过简单的血液检测,全面了解自己的器官衰老状态,并采取针对性措施延缓衰老进程。
该研究不仅具有重大科学意义,也为普通人追求健康长寿提供了实证指导:保护好大脑和免疫系统,可能就是延长健康寿命的关键所在。在抗衰老的道路上,我们正从经验走向科学,从模糊走向精准,而这或许正是迈向"健康中国"的重要一步。
1. Oh, H.SH., Le Guen, Y., Rappoport, N. et al. Plasma proteomics links brain and immune system aging with healthspan and longevity. Nat Med 31, 2703–2711 (2025).