推荐产品
技术资料/正文
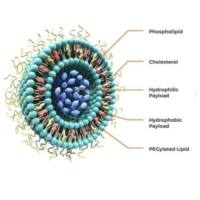
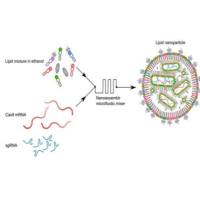
唾液酸-苯硼酸识别:赋能脂质体(Liposome)和脂质体纳米颗粒(LNP)的智能靶向递送
594 人阅读发布时间:2025-10-13 09:45
在纳米药物递送领域,如何实现高效、精准、低副作用的靶向运输,一直是科研与产业关注的核心。近年来,基于唾液酸(Sialic acid)与苯硼酸(Phenylboronic acid, PBA)的特异性识别机制,为脂质体(Liposome)和脂质体纳米颗粒(LNP)的改造带来了新的突破。
唾液酸:理想的靶点
肿瘤细胞表面高表达
多种恶性肿瘤细胞表面常出现唾液酸化糖蛋白和糖脂过度表达,这与细胞增殖、转移和免疫逃逸密切相关。
疾病相关性强
唾液酸水平异常不仅与肿瘤相关,也涉及炎症、代谢性疾病,为药物递送提供了天然靶点。
苯硼酸:精准的导航头
苯硼酸及其衍生物能够与含顺式二醇结构的分子(如唾液酸)形成可逆共价键,并具有以下特点:
选择性结合
苯硼酸对唾液酸表现出显著亲和力,可实现“锁定目标”功能。
环境响应
在弱酸性肿瘤微环境中,苯硼酸与唾液酸的结合更稳定,实现局部强化靶向。
修饰灵活
苯硼酸基团可通过化学偶联嵌入脂质层或表面修饰,打造“导航头”,不改变载体整体结构。
应用价值
1. 脂质体(Liposome)药物递送
苯硼酸修饰后的脂质体可主动识别肿瘤细胞表面唾液酸,增强药物在病灶部位的富集,显著提高疗效并减少毒副作用。
2. 脂质体纳米颗粒(LNP)核酸递送
在mRNA、siRNA等基因药物递送中,苯硼酸修饰的LNP可借助唾液酸识别,提升细胞摄取效率,增强转染水平。
3. 肿瘤成像与诊断
通过将荧光探针或磁共振造影剂封装于苯硼酸修饰脂质体中,可实现唾液酸相关病变的精准成像。
技术优势
靶向精准:唾液酸-苯硼酸相互作用保障主动定位
响应智能:酸性肿瘤环境下结合更强,实现控释
平台兼容:适配化疗药物、核酸药物、疫苗等多种载体
应用广泛:覆盖癌症、代谢病、炎症性疾病及诊断成像
苯硼酸修饰的脂质体/脂质纳米颗粒代表了一种高效、智能且极具转化潜力的主动靶向策略。它巧妙地利用了肿瘤细胞的固有特征(唾液酸过表达和微酸性环境),实现了药物的精准递送与可控释放,为下一代靶向纳米药物的开发提供了强大而灵活的工具,有望在癌症治疗等领域开启新的篇章。