推荐产品
技术资料/正文
SSTR(生长抑素受体)靶向肽赋能脂质体与LNP :靶向神经内分泌肿瘤的精准治疗工具
470 人阅读发布时间:2025-10-09 09:47
在精准医疗时代,靶向递送技术是提高药物疗效、降低系统毒性的核心挑战之一。生长抑素受体(Somatostatin Receptors, SSTR)作为在多种肿瘤及病理组织中过度表达的G蛋白偶联受体家族,已成为肿瘤诊断与治疗的重要靶点。近年来,通过SSTR靶向肽修饰的脂质体(Liposome)及脂质纳米颗粒(Lipid Nanoparticle, LNP)技术,为实现高效、特异性的主动靶向递送开辟了全新路径。
一、SSTR的生物学意义与靶向价值
SSTR广泛分布于神经内分泌肿瘤(如胰腺神经内分泌瘤、垂体瘤)、部分实体瘤(如小细胞肺癌、乳腺癌)及炎症病变细胞表面,其过度表达与疾病进展密切相关。SSTR与内源性生长抑素(Somatostatin)具有高亲和力,这一特性为设计外源性靶向分子提供了理想基础。通过理性设计与合成SSTR特异性结合的多肽配体(如奥曲肽类似物、环肽等),可实现对病变细胞的精准识别与结合。
二、SSTR靶向肽:精准导航的“分子向导”
SSTR靶向肽是一类经优化设计的功能性短肽,具备以下核心优势:
高亲和性与特异性:
靶向肽通过模拟天然生长抑素的活性结构域,与SSTR亚型(尤其是SSTR2、SSTR5)选择性结合,有效避免与非靶组织的相互作用,显著提升靶向效率。
可定制化修饰:
肽链可通过化学偶联与脂质体或LNP表面功能化结合,且不影响载体稳定性或药物包封效率。
良好的生物相容性:
多肽材料本身具有低免疫原性及可降解性,符合临床转化要求。
三、SSTR靶向肽修饰脂质体与LNP:双平台协同优势
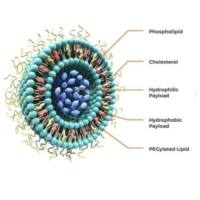
1. 脂质体平台:经典载体的升级
传统脂质体通过EPR效应(增强渗透与滞留效应)实现被动靶向,但缺乏细胞选择性。
SSTR靶向肽的引入使其升级为“主动靶向系统”:
· 增强细胞内核作用,促进药物内化;
· 克服多药耐药性(MDR),通过旁路途径提升胞内药物浓度;
· 兼容亲水/疏水药物,适用于化疗药、基因药物及显像剂。
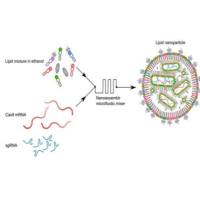
2. LNP平台:核酸递送的新突破
LNP在mRNA疫苗中的成功证明了其高效封装与递送核酸的能力。SSTR靶向肽修饰进一步拓展其应用场景:
· 实现针对肿瘤细胞的siRNA/mRNA特异性递送,调控致病基因表达;
· 减少非靶向累积,降低免疫激活风险;
· 支持联合治疗(如化疗与基因沉默同步进行)。
四、应用前景与临床转化潜力
SSTR靶向脂质体/LNP技术有望在以下领域发挥重要作用:
肿瘤精准治疗:针对神经内分泌肿瘤、胶质瘤等高表达SSTR的恶性肿瘤,递送化疗药物(如多柔比星)或RNA疗法;
分子影像诊断:携带造影剂(如钆、荧光染料)的靶向系统可用于PET/MRI成像,提升病灶检测灵敏度;
炎症性疾病治疗:如类风湿关节炎中巨噬细胞表面SSTR靶向递送抗炎药物。