推荐产品
技术资料/正文
P-选择素靶向肽修饰脂质体/脂质体纳米颗粒 —— 基于分子识别的精准递送平台
408 人阅读发布时间:2025-09-30 09:35
在药物递送领域,实现病灶部位的精准蓄积并高效发挥疗效是核心目标。其中,靶向分子的选择是成功的关键。P-选择素(P-selectin)作为一种在炎症和血栓性疾病中至关重要的细胞粘附分子,正成为下一代靶向治疗的新兴热点。以其为靶点设计的靶向肽修饰脂质体与脂质纳米颗粒(LNP),为攻克相关疾病提供了极具前景的解决方案。
一、详解核心靶点:P-选择素的生物学功能与靶向价值
P-选择素是选择素(Selectin)家族的重要成员,是一种位于细胞膜上的跨膜糖蛋白。其主要表达于活化的血小板和活化的血管内皮细胞表面。
1. 关键触发机制:
在正常生理状态下,P-选择素静默地存在于血小板α颗粒和血管内皮细胞Weibel-Palade小体内。当组织发生炎症或损伤时,诸如组胺、凝血酶、自由基等激动剂会迅速刺激这些细胞,导致P-选择素在数分钟内被动员并高表达于细胞表面,充当招募信号的“警报器”。
2. 核心病理学功能:
P-选择素的核心功能是介导初始的、可逆的细胞粘附过程。它通过识别并结合白细胞(如中性粒细胞、单核细胞)表面的糖蛋白配体(如PSGL-1),使白细胞在血流中“减速”、沿着血管壁“滚动”,这是白细胞募集至炎症部位、以及血小板-白细胞聚集体形成的起始关键步骤。
3. 作为理想靶点的突出优势:
病理特异性表达:在健康组织中表达极低甚至不表达,仅在疾病激活部位显著高表达,奠定了超高靶向特异性的基础,能极大避免脱靶效应。
枢纽地位:位于多种疾病通路的核心环节,靶向P-选择素可同时干预炎症和血栓过程,实现“一石二鸟”的治疗效果。
血管腔内侧表达:其表达于血管内膜侧,直接暴露于血液循环中,使得经静脉注射的纳米药物能轻易并快速地接触到靶点,无需穿越血管屏障,靶向效率极高。
二、P-选择素靶向肽:设计精良的“制导系统”
基于P-选择素的天然配体(如PSGL-1的功能域),研究人员开发出了高亲和力、高特异性的P-选择素靶向肽。
这些短肽通常通过理性设计和筛选获得,具备以下特点:
高亲和力与选择性:能够与P-选择素特异性结合,有效竞争天然配体。
可工程化修饰:其肽链末端可方便地进行化学修饰,从而稳定偶联到脂质体或LNP的磷脂层表面,且不影响载体自身的稳定性和载药能力。
良好的安全性:作为短肽,免疫原性低,生物相容性好。
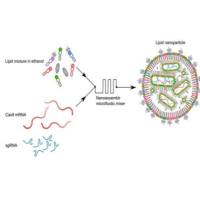
三、赋能药物递送平台:脂质体与LNP
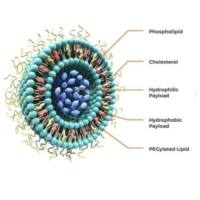
将P-选择素靶向肽修饰于传统的脂质体或LNP表面,是对这些纳米载体的革命性升级。
脂质体:凭借其优异的载药能力,可包载各类抗炎药、抗血栓药或抗氧化剂。靶向肽的引入使其从被动靶向(EPR效应)转变为主动靶向,能精准地将药物送达活化的血小板、内皮细胞或白细胞聚集的病灶,显著提高局部药物浓度,增强疗效并降低全身副作用。
脂质纳米颗粒(LNP):作为核酸药物的卓越递送载体,LNP封装siRNA、mRNA或反义寡核苷酸等。P-选择素靶向修饰使LNP能将治疗性核酸精准递送至病灶区域的特定细胞,例如通过沉默关键炎症因子或促凝蛋白的基因,在源头上中断疾病进程,实现精准的基因调控治疗。
P-选择素作为连接炎症与血栓的关键桥梁分子,是药物靶向递送的一个极具吸引力的靶标。基于P-选择素靶向肽修饰的脂质体/LNP技术,成功构建了能够智能识别疾病信号、直达病灶核心的“生物导弹”系统。它不仅为现有药物赋予了新的生命力,更有望为一系列难治性炎症和血栓性疾病带来突破性的治疗策略,代表着精准医疗未来的重要发展方向。