江苏赛昂斯生物科技有限公司
3 年
手机商铺
- NaN
- 0.2999999999999998
- 1.2999999999999998
- 0.2999999999999998
- 3.3
推荐产品
技术资料/正文
【前沿进展】Cell丨间歇性禁食触发器官间通讯,抑制毛囊再生
86 人阅读发布时间:2025-01-07 09:53

论文上线截图
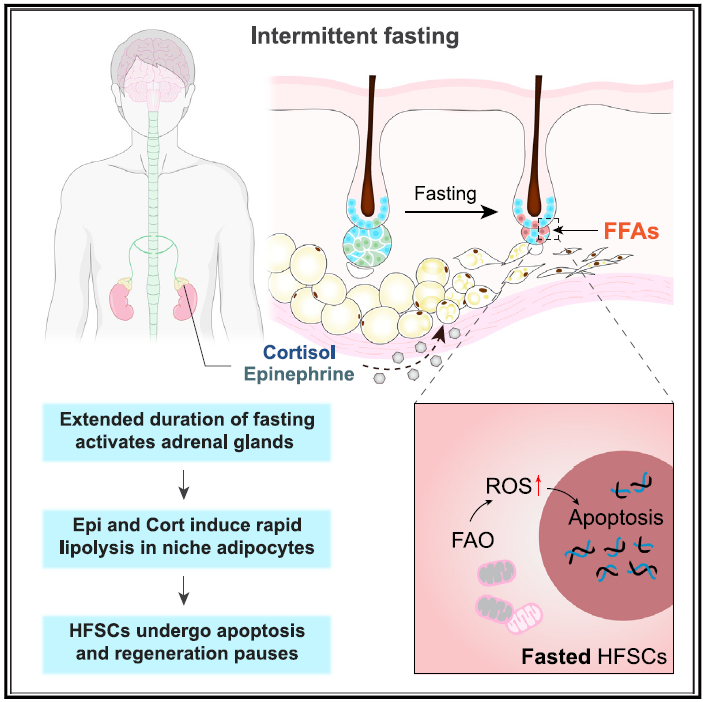
近年来,各种间歇性禁食方案,包括周期性禁食或时间限制性饮食计划,在全球范围内越来越受欢迎。越来越多的证据表明,这些禁食模式不仅有益于代谢健康和体重控制,而且对组织健康也产生深远影响。体细胞是维持和再生全身许多组织的动力。在组织内,体细胞位于一个被称为“生态位”的特殊微环境中。微环境决定干细胞的命运,并调节各种生理和环境变化的再生过程。然而,间歇性禁食如何影响体细胞及其微环境的详细机制尚未完全理解。
先前的研究表明,禁食可以改善肠道、肌肉和造血系统中多种体细胞的功能和应激抵抗力。然而,间歇性禁食对皮肤等其他外围组织的影响尚未确定。
作者在皮肤中研究了这些问题。在皮肤内,毛囊经历生长期、退行期和休止期的周期性阶段来产生新的头发,这是由毛囊干细胞(HFSCs)的周期性激活驱动的。在休止期,HFSCs在毛囊的隆起和毛发发生区域保持静止。它们在生长期开始时变得短暂活跃,启动毛囊再生并进行自我更新。此外,皮肤中的多种细胞类型组织成一个复杂的微环境,围绕HFSCs,使它们的再生活动能够响应外部刺激或生理变化。之前的临床观察表明,为了快速减肥而进行非常低热量饮食的患者可能会经历脱发。然而,现代间歇性禁食方案对毛囊再生和头发生长的影响仍不清楚。
在这里,作者发现常用的间歇性禁食方案通过选择性诱导活化的HFSCs凋亡来抑制毛囊再生。这种效应与卡路里减少、昼夜节律变化或mTORC1细胞营养感应机制无关。相反,禁食激活了肾上腺和皮肤真皮脂肪细胞之间通讯,触发游离脂肪酸迅速释放到微环境中,扰乱HFSCs的正常代谢,并提高它们的细胞活性氧水平,导致氧化损伤和凋亡。随机临床试验表明间歇性禁食抑制人类头发生长。作者的研究揭示了间歇性禁食对组织再生的抑制效应,即间歇性禁食会触发器官间通讯,并抑制HFSC的再生活性,从而抑制毛发生长。
1.常用的间歇性禁食方案抑制毛囊再生
作者采用两种常用的间歇性禁食方案:16/8时间限制性进食(TRF),即每日食物摄入限制在8小时内,随后进行16小时的禁食期;以及隔日禁食(ADF),即在24小时的禁食期和24小时无限制进食期之间交替(图1A)。在治疗前给小鼠剃毛,并监测它们的毛发再生(图1B)。与正常随意进食(AL)的动物相比,接受TRF或ADF的动物的毛囊再生显著受损。接受间歇性禁食的小鼠的葡萄糖耐受性增强。这些发现表明,虽然常用的间歇性禁食方案对代谢有益处,但它们显著抑制了毛囊再生。
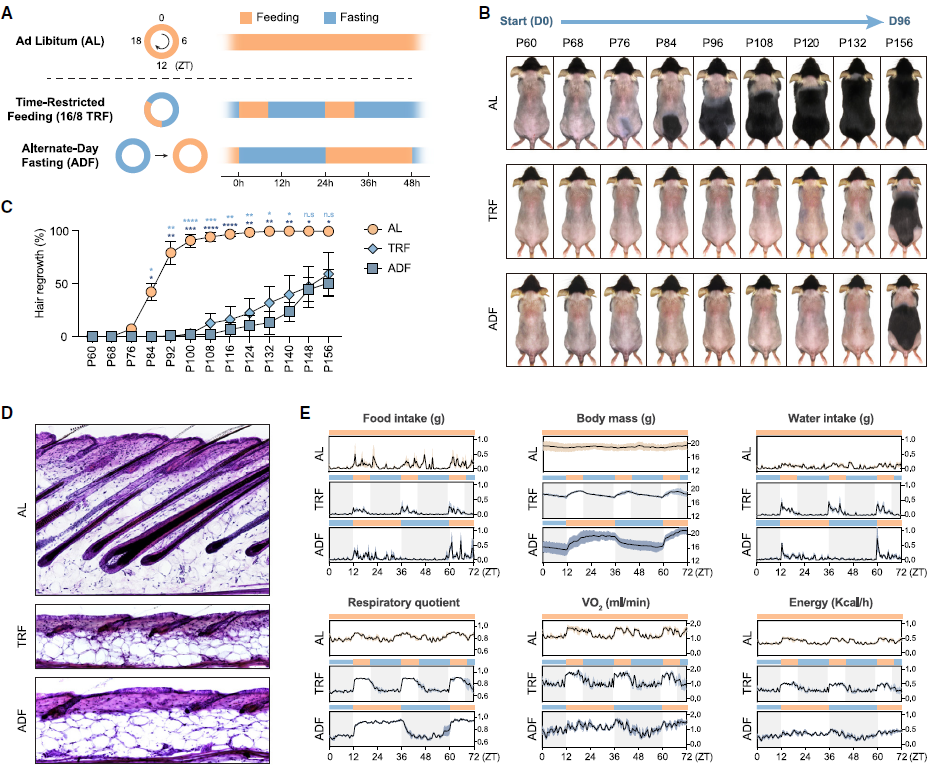
图1. 间歇性禁食抑制毛囊再生
2. 间歇性禁食选择性地诱导激活的HFSCs凋亡
接下来,作者分析间歇性禁食如何影响HFSCs的命运(图2A)。未能激活的HFSCs是许多毛囊再生缺陷的常见原因。作者测试了间歇性禁食是否抑制HFSC激活,结果发现,在AL的小鼠中,HFSCs能够激活并进入生长期,同样,在ADF方案下的小鼠也激活一定数量的HFSCs。然而,在24小时禁食期后,它们毛囊内EdU+ HFSCs的数量急剧减少,同时出现了许多凋亡信号。在间歇性禁食期间,HFSCs被反复激活和消除,导致毛囊生长受到抑制(图2B)。同样,在TRF方案下的小鼠中也发现凋亡的HFSCs。那么激活的HFSCs是否被选择性地消除,结果发现大多数凋亡的HFSCs对EdU呈阳性,表明它们在凋亡前曾被激活(图2D);在ADF的进食期间大约有25%的HFSCs被激活,而在禁食后大约有90%被消除(图2E),导致在多次禁食后ADF中HFSCs的总数显著减少(图2F)。未激活的HFSCs在24小时禁食后没有显示出任何凋亡信号,这表明只有激活的HFSCs受到禁食的影响。这些数据表明,在间歇性禁食下,HFSCs经历了激活和凋亡的重复周期(图2J)。短期间歇性禁食会扰乱毛囊再生进入后期的正常进展,导致毛囊再生延迟。长期会导致HFSC丢失和毛囊退化。
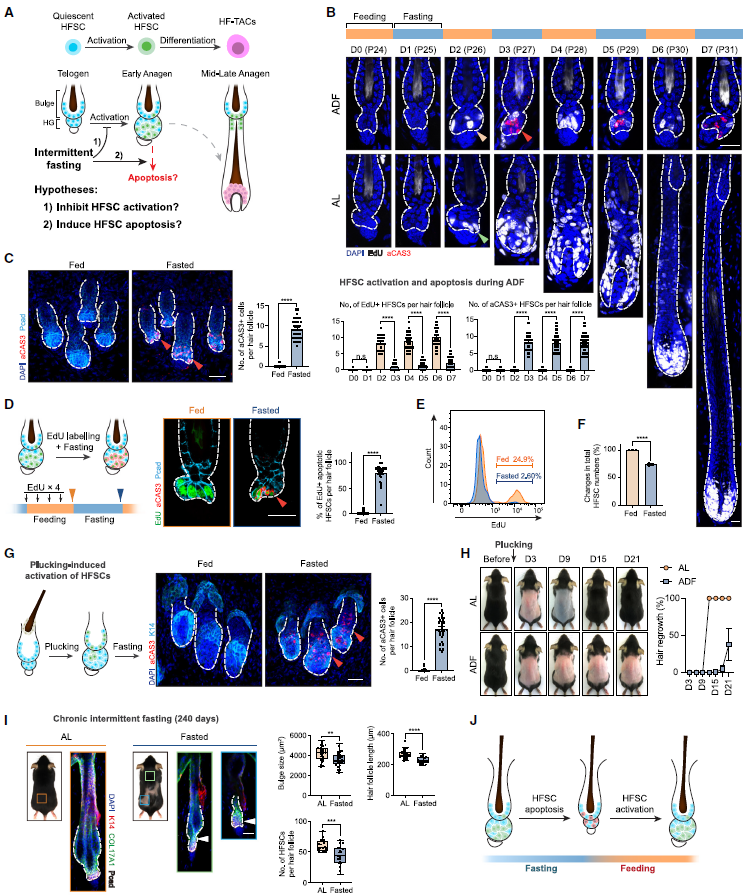
图2. 间歇性禁食诱导激活的HFSCs凋亡
3.延长禁食时长导致干细胞死亡
间歇性禁食通常被认为是通过减少总体卡路里摄入和改变饮食模式来实现其效果的(图3A)。作者检测了小鼠的日常食物消耗。与预期相反,接受TRF或ADF的小鼠平均每天的卡路里摄入量并没有显著减少(图3B)。
延长禁食时长是各种间歇性禁食方案中另一个关键组成部分。为了确定HFSCs的凋亡是否与禁食时长相关,作者让小鼠经历不同时长的禁食,并检查HFSCs凋亡的情况(图3D)。在禁食8小时后,毛囊的凋亡信号最小。随着禁食时长的延长,凋亡的HFSCs数量持续上升,并在重新进食后消失(图3D)。以上结果表明,延长禁食时长介导了间歇性禁食对毛囊再生的抑制效应,总的来说,HFSCs的凋亡和毛囊再生缺陷主要是因为延长了间歇性禁食方案中的禁食时长,而不是总体卡路里摄入减少或昼夜节律变化。随着禁食期的延长,缺陷的严重性加剧。由于ADF方案引起严重的HFSC凋亡和毛囊再生缺陷,作者将重点使用ADF进行后续的机制研究。
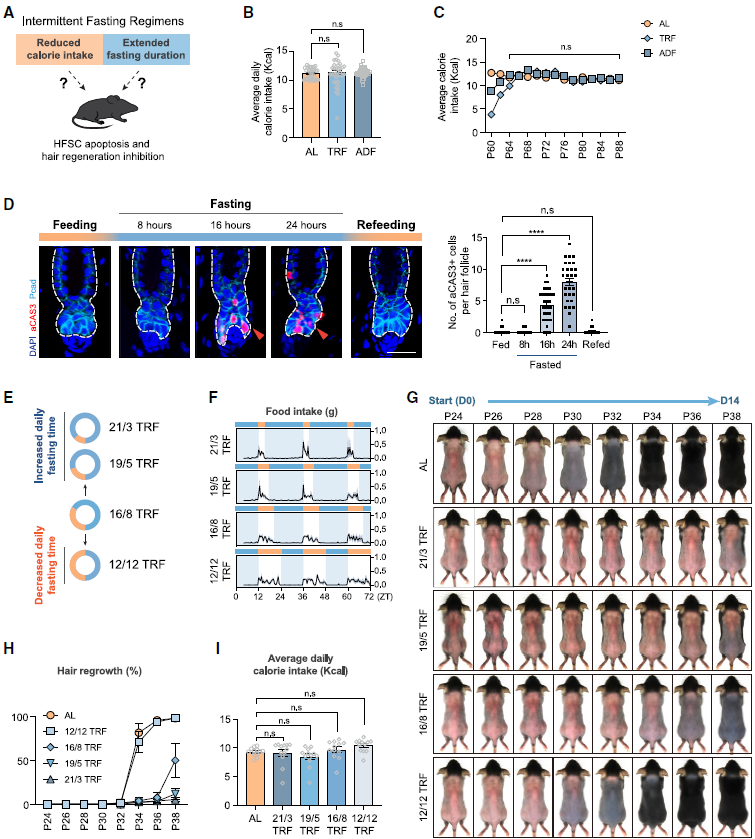
图3. 延长禁食时间可诱导HFSCs凋亡,抑制毛囊再生
4.禁食诱导的微环境脂肪细胞中的脂解作用驱动HFSCs凋亡
接下来,作者旨在研究延长禁食如何影响HFSCs。禁食引起系统性营养水平的暂时下降,最终导致凋亡(图4A)。但是,HFSCs的禁食诱导凋亡并不依赖于经典的mTORC1细胞营养感应机制。
延长禁食时长还触发一系列进化上保守的适应性反应,来启动健康行为并动员储存在脂肪组织中的脂肪。作者检测到在24小时禁食后,真皮脂肪细胞经历了广泛的脂解作用,分解储存的甘油三酯,释放大量的游离脂肪酸(FFAs)进入微环境。在禁食16小时后,可以观察到真皮脂肪细胞中明显的脂解作用(图4F),与毛囊中凋亡的HFSCs的出现相一致(图3D)。一旦小鼠进食,真皮脂肪细胞的脂解作用立即停止,HFSCs的凋亡也减少(图3D-4F)。这些数据暗示真皮脂肪细胞脂解作用与禁食期间HFSCs凋亡之间存在强烈的联系。通过特异性敲除真皮脂肪细胞中的脂解酶:甘油三酯脂肪酶(ATGL),进一步确定了禁食诱导的真皮脂肪细胞的脂解驱动了HFSCs死亡(图4)。
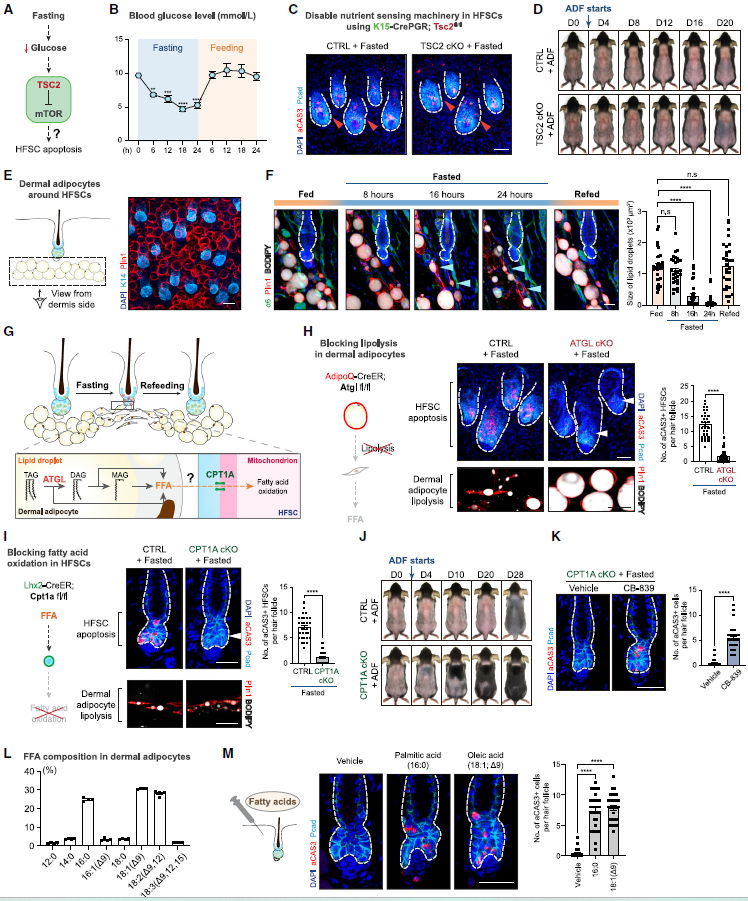
图4. 禁食诱导的微环境脂肪细胞中的脂解作用促进HFSCs凋亡
5. 禁食激活肾上腺,停止组织再生
为了研究禁食信号是如何传递到皮肤并诱导真皮脂肪细胞中的脂解作用,作者首先检查了交感神经的作用,没有交感神经支配,在禁食时真皮脂肪细胞的脂解作用和HFSCs的凋亡仍然存在,因此,交感神经支配在这里没有显著作用。
另一种可能性是肾上腺(图5A)。肾上腺在调节身体对禁食的生理适应中发挥中心作用。肾上腺素都具有强大的脂解功能。作者监测了接受ADF的小鼠在24小时禁食和24小时重新进食周期中肾上腺的活动(图5E)。数据暗示了肾上腺激活、真皮脂肪细胞脂解作用和禁食期间HFSCs凋亡之间存在强烈的相关性。
为了评估释放的皮质酮和肾上腺素是否在真皮脂肪细胞中诱导脂解作用,作者建立使用低葡萄糖培养基的皮肤外植体培养系统模拟禁食条件。将更高浓度的皮质酮或肾上腺素真皮注射到皮肤中,导致真皮脂肪细胞中广泛的脂解作用以及HFSCs的凋亡,而不需要禁食(图5F-5G)。为了进一步确认这一点,作者去除小鼠的两个肾上腺(图5H),发现没有肾上腺,挽救了真皮脂肪细胞中的禁食诱导的脂解作用和HFSCs的凋亡(图5H-5J)。综合这些发现,延长禁食激活肾上腺释放脂解激素,这些激素通过微环境中的脂肪细胞发出信号,消除激活的HFSCs并抑制毛囊再生。
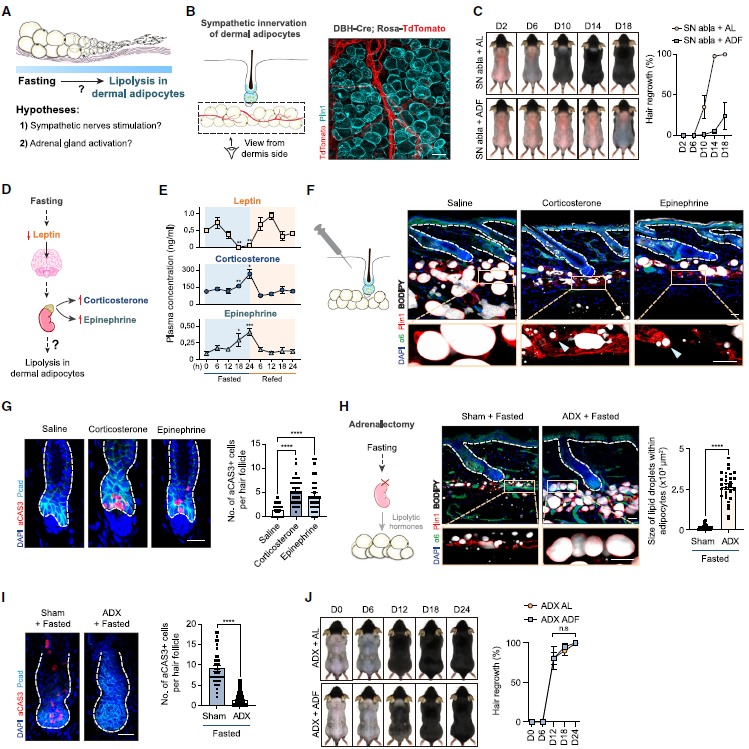
图5. 禁食激活肾上腺,诱导微环境脂肪细胞脂解及HFSCs的凋亡
6. 禁食诱导HFSCs中活性氧(ROS)水平升高
为了探究禁食诱导的HFSCs凋亡背后的分子机制,作者使用流式细胞分选(FACS)技术纯化HFSCs并进行RNA测序分析(图6A)。作者观察到禁食的HFSCs中糖酵解途径的下调和脂肪酸代谢途径的上调,证实了它们从利用葡萄糖向游离脂肪酸(FFAs)的转变(图6C)。且禁食的HFSCs中最显著的变化与氧化应激反应、线粒体功能障碍和凋亡途径相关(图6D)。这些发现表明,禁食诱导的HFSCs凋亡可能与细胞氧化应激的增加有关。由于细胞氧化应激通常源于活性氧(ROS)的增加,作者检测了禁食的HFSCs中线粒体ROS的水平。结果表明,在禁食24小时后,HFSCs中线粒体ROS水平升高(图6E)。作者进一步确认了禁食的HFSCs中线粒体功能障碍(图6E)和干细胞中细胞氧化应激的增加(图6G)。这些数据表明,禁食诱导的HFSCs凋亡与激活的脂肪酸氧化(FAO)和ROS的增加产生有关,最终导致氧化损伤和凋亡。
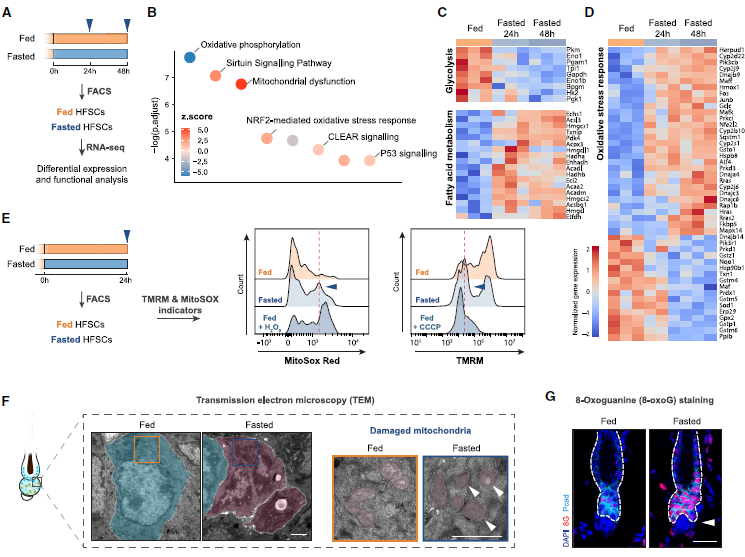
图6. ROS升高导致HFSCs细胞凋亡
7. 增强抗氧化能力可预防禁食诱导的HFSCs死亡
与通常被激活的HFSCs所采用的糖酵解途径不同,脂肪酸氧化(FAO)天生会产生更多的ROS。阻断HFSCs中的FAO可以减轻禁食诱导的HFSCs死亡(图4I)。作者纯化了与HFSCs在发育过程中共享同一谱系起源但对禁食诱导的凋亡有抵抗力的表皮干细胞(EpiSCs)并进行RNA测序分析。然后,将它们表达的关键抗氧化酶基因与HFSCs进行了比较。与EpiSCs相比,激活的HFSCs显著低表达抗氧化基因(图6H),即它们更容易受到ROS诱导的损伤。
基于这些发现,作者局部应用外源性抗氧化剂维生素E到皮肤,或过表达抗氧化酶过氧化氢酶(CAT),有效地预防禁食诱导的HFSCs凋亡,并减轻间歇性禁食小鼠的毛囊再生抑制(图6I-6J)。综合这些数据,作者的研究表明延长禁食会激活HFSCs中的FAO,导致细胞ROS的产生增加。由于它们的抗氧化能力有限,导致干细胞发生氧化损伤和凋亡。通过药理学或遗传学手段增强HFSCs的抗氧化能力,可以有效地预防干细胞死亡,并减轻再生缺陷。
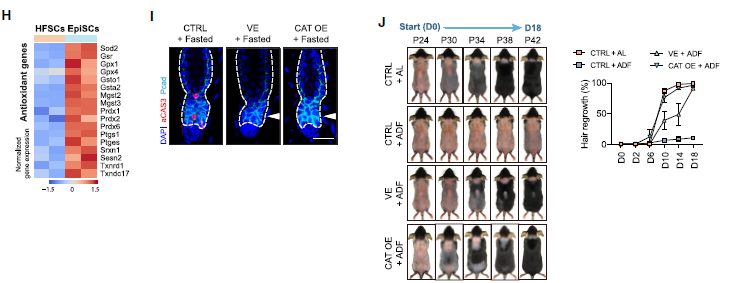
图6. 增强抗氧化能力可防止禁食时HFSCs细胞凋亡
8. 禁食诱导HFSCs凋亡并抑制人类头发生长
为了确定游离脂肪酸(FFAs)是否也会在人类HFSCs中诱导活性氧(ROS)水平升高和凋亡,作者从健康捐赠者的头皮毛囊中纯化了HFSCs,并用FFAs处理它们(图S7A),结果表明线粒体ROS水平增加(图7A)。
为了确定间歇性禁食是否影响人类头发生长,作者进行了人类随机对照试验(RCT)研究。与先前的研究结果一致,间歇性禁食改善了代谢健康(图S7F–S7I),间歇性禁食的参与者的头发生长显著被抑制(图7E)。此外,正如在小鼠中观察到的,18小时的禁食增加了18/6 TRD的人类参与者血液中脂解激素的水平。以上结果表明介导间歇性禁食对HFSCs和头发生长影响的机制在人类中同样存在。
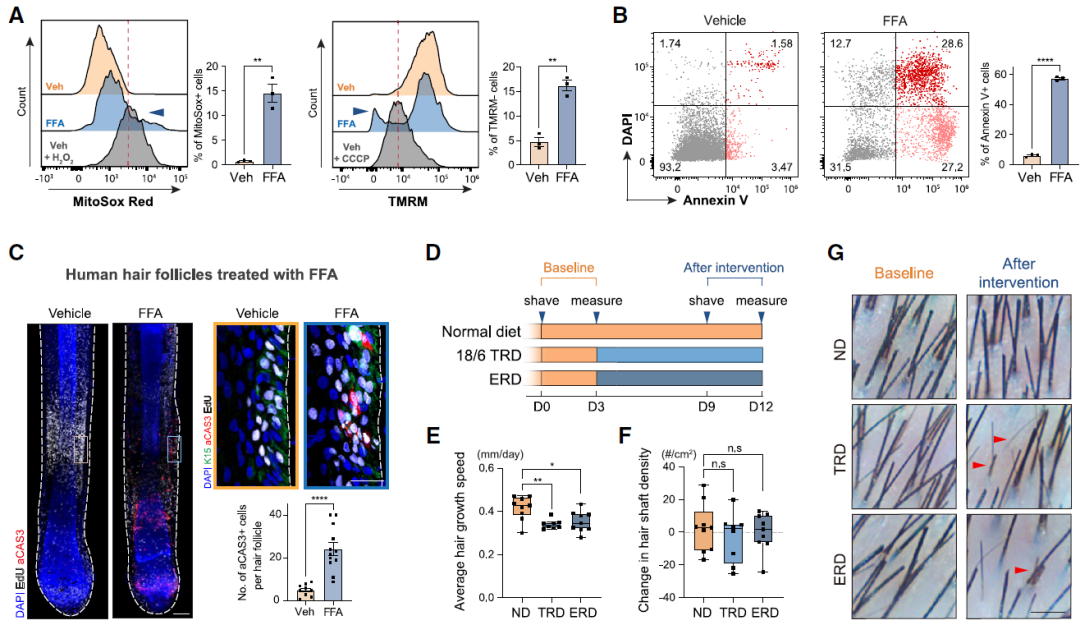
图7. 禁食诱导HFSCs凋亡并抑制人类头发生长
结论
总之,作者的发现阐明了间歇性禁食影响体细胞和组织生物学的原理和机制,并为研究这种影响提供了策略。考虑到全球对间歇性禁食的广泛采用,未来将全面评估不同禁食方案对各种干细胞系统的影响,并不断探索在保留其益处的同时减轻对组织生物学影响的方法。