普健生物(武汉)科技有限公司品牌商
14 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
乙酰化修饰|多样化的功能,多样化的应用
2474 人阅读发布时间:2021-08-12 14:39
蛋白质翻译后修饰是细胞功能调节的核心,几乎参与了细胞所有的正常生命活动过程,并发挥着十分重要的调控作用。研究表明,人体内50%-90%的蛋白质发生了翻译后修饰,多样化的修饰方式显著增加了蛋白的多样性和复杂性。目前已经确定的翻译后修饰方式超过400种,常见的修饰方式包括甲基化、磷酸化、泛素化、乙酰化、糖基化、SUMO化、亚硝基化和氧化等。
一、蛋白乙酰化修饰
蛋白质乙酰化修饰(Acylation)参与多种生物学过程调控,其研究历史已达50多年,目前已成为国际上蛋白质领域的研究热点。蛋白乙酰化是乙酰基供体(如乙酰辅酶A)通过酶学或非酶学的方式将乙酰基团共价结合到赖氨酸残基上的过程。
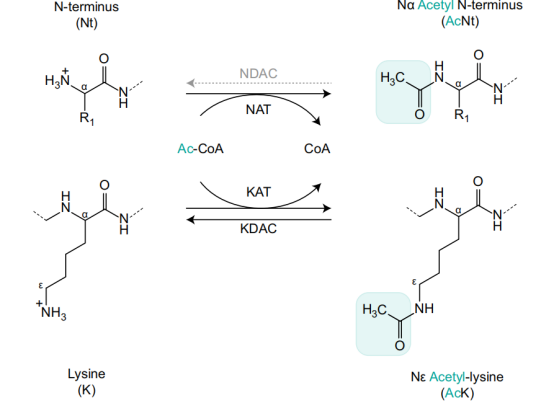
Nα和Nε乙酰化原理
目前,已知有两类乙酰化形式——Nα乙酰化和Nε乙酰化。Nα乙酰化是指蛋白质的 N 末端被乙酰化修饰,一般认为不可逆,在真核生物中非常普遍,存在于将近85%的真核蛋白中,在原核生物中却非常少见。
与 Nα乙酰化相反,Nε乙酰化是动态的、可逆的。其中,研究最多的是赖氨酸残基的乙酰化修饰。Nε乙酰化会随着细胞的生理状态和外界环境变化而改变,从而起到细胞内外信号传递、酶原激活的作用,因此可以作为蛋白质构象和活性改变的调控开关,一旦发生异常会导致疾病的发生。
一、蛋白乙酰化修饰
蛋白质乙酰化修饰(Acylation)参与多种生物学过程调控,其研究历史已达50多年,目前已成为国际上蛋白质领域的研究热点。蛋白乙酰化是乙酰基供体(如乙酰辅酶A)通过酶学或非酶学的方式将乙酰基团共价结合到赖氨酸残基上的过程。

Nα和Nε乙酰化原理
目前,已知有两类乙酰化形式——Nα乙酰化和Nε乙酰化。Nα乙酰化是指蛋白质的 N 末端被乙酰化修饰,一般认为不可逆,在真核生物中非常普遍,存在于将近85%的真核蛋白中,在原核生物中却非常少见。
与 Nα乙酰化相反,Nε乙酰化是动态的、可逆的。其中,研究最多的是赖氨酸残基的乙酰化修饰。Nε乙酰化会随着细胞的生理状态和外界环境变化而改变,从而起到细胞内外信号传递、酶原激活的作用,因此可以作为蛋白质构象和活性改变的调控开关,一旦发生异常会导致疾病的发生。