上海诺佰佰生物科技有限公司
4 年
手机商铺
- NaN
- 0.5
- 0.5
- 2.5
- 2.5
推荐产品
技术资料/正文
N家干货 | 聊聊CD47靶点及其活性细胞株
1147 人阅读发布时间:2025-07-18 11:52
1.靶点介绍
CD47(白细胞分化蛋白 47)又称为整合素相关蛋白(integrin-associated protein, IAP),属于免疫球蛋白超家族,是一个拥有5个跨膜域的跨膜糖蛋白,广泛表达于几乎所有的正常细胞表面。目前已知的CD47的天然配体有三种:整合素(integrin)、血小板反应蛋白-1(Thrombospondin-1,TSP-1)和信号调节蛋白α(Signal-regulatory proteinα,Sirpα)。CD47与其配体主要参与细胞黏附、细胞迁移、吞噬功能,以及维持机体免疫稳态。
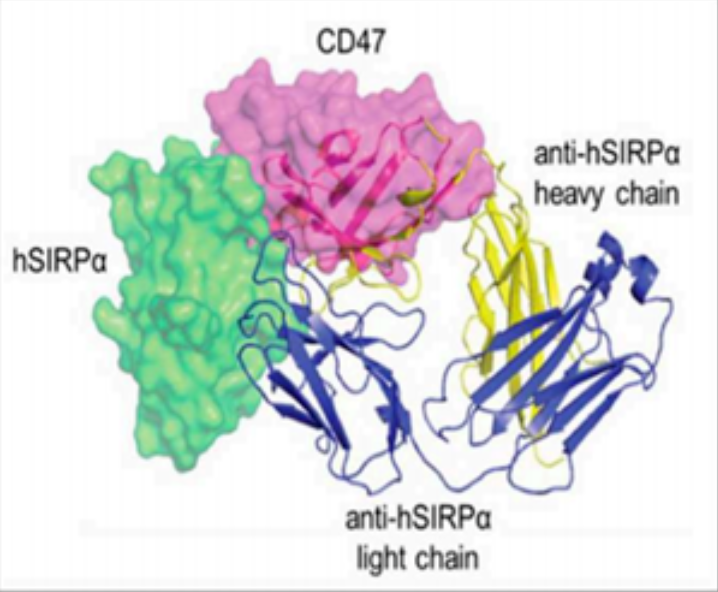
图1. CD47的结构
(https://doi.org/10.3389/fimmu.2020.00018)
2.作用机制
SIRPα和 SIRPγ是同源家族蛋白,与 CD47 具有相同的结合模式。但由于结合域中残基的差异,SIRPα与CD47的亲和力远高于 SIRPγ。SIRPα在髓系细胞的细胞膜上高表达,如巨噬细胞、粒细胞、单核细胞和髓系树突状细胞。CD47 与 SIRPα的相互作用会向巨噬细胞发出“别吃我”信号,从而抑制巨噬细胞的吞噬作用。因此,高表达CD47的肿瘤细胞能够通过阻断吞噬机制来逃避免疫监视。
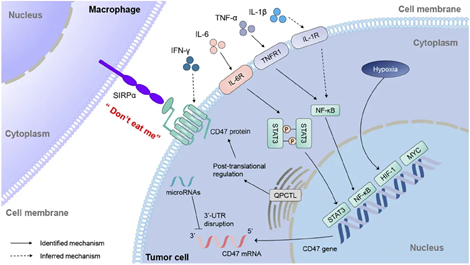
图2. CD47 表达的调节机制
(https://doi.org/10.1016/j.tranon.2020.100862)
3.信号通路
CD47在肿瘤细胞表面的过度表达可以帮助这些细胞逃避免疫细胞的监控和清除,这使之成为新型抗肿瘤药物开发中一个极具吸引力的靶点。靶向治疗CD47-SIRPα通路可通过多种机制清除肿瘤细胞。
(1)使用抗CD47抗体、抗SIRPα抗体或重组SIRPα蛋白抑制CD47-SIRPα相互作用,引发巨噬细胞吞噬肿瘤细胞。
(2)抗CD47抗体使树突状细胞吞噬肿瘤细胞,随后抗原呈递给CD4+和CD8+ T细胞,从而刺激抗肿瘤的适应性免疫反应。
(3)抗CD47抗体通过自然杀伤细胞介导的抗体依赖细胞毒性和补体依赖细胞毒性消除肿瘤细胞。
(4)抗CD47抗体通过不依赖caspase的机制刺激肿瘤细胞凋亡。
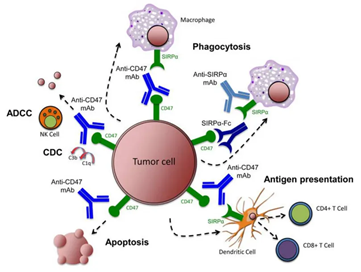
图3. 靶向肿瘤中的CD47-SIRPα通路
此外,在正常生理情况下,CD47 还主导红细胞在体内的清除和平衡。在衰老红细胞表面,CD47 表达量下调或构象改变,「抗吞噬」信号降低,磷酸酯酰丝氨酸等「促吞噬」信号的表达提升,促进巨噬细胞对衰老红细胞的吞噬。
4.疾病相关
基于上述 CD47 靶点自身的生物学特点,现已有多种解决方案应用于药物开发,如:
(1)开发 Fc 端为 IgG4 型的 CD47 抗体,而不是能引发强烈 ADCC 和 CDC 效应的 IgG1 型抗体;
(2)通过降低 CD47 药物对红细胞的结合能力,从而避免对红细胞的杀伤作用;
(3)彻底放弃 CD47 抗体强效 ADCC 作用,只利用 CD47/SIRPα本身的生物学效应来释放吞噬细胞的抗肿瘤潜力,但往往需要联合用药。
总之,就是增强正性的肿瘤靶向作用,降低对红细胞、血小板的影响。
5.研究现状
目前,全球CD47靶点的在研药物有164条,主要集中在单抗,双抗和融合蛋白,双抗在临床药物中的占比最大。当前全球范围内尚无CD47抗体获批上市,但仅在国内就有近60家企业针对CD47靶点进行研究,市场非常火热。
研发进展较为靠前的有宜明生物,信达生物,天境生物,杭州翰思等。适应症主要集中在骨髓增生异常综合征、血液肿瘤、髓系白血病、晚期/转移性实体瘤、淋巴瘤等,除以上适应症以外,CD47抗体适应症还包含结肠直肠癌、卵巢癌、乳腺癌、膀胱癌、头颈癌等实体瘤症状。CD47抗体的适应症众多,开发价值高,开发的前景较好。
|
药物名称 |
靶点 |
原研/在研机构 |
在研适应症 |
药物类型 |
全球最高研发状态 |
|
Lemzoparlimab |
CD47 |
天境生物 |
骨髓增生;成人急性髓性白血病;晚期恶性实体瘤 |
单克隆抗体 |
临床3期 |
|
Nibrozetone |
CD47 x NLRP3 x c-Myc |
赛生医药 |
小细胞肺癌;神经内分泌肿瘤 |
化学药 |
临床3期 |
|
HX-009 |
CD47×PD-1 |
杭州翰思 |
晚期恶性实体瘤,淋巴瘤 |
双特异性抗体 |
临床2期 |
|
IMM-2505 |
CD47×PDL1 |
宜明昂科 |
晚期恶性实体瘤 |
双特异性抗体 |
临床2期 |
|
莱法利单抗 |
CD47 |
中山康方 |
骨髓增生;腺癌;转移性结直肠癌 |
单克隆抗体 |
临床2期 |
|
IBI-322 |
CD47×PDL1 |
信达生物 |
小细胞肺癌,非小细胞肺癌,晚期恶性实体瘤 |
双特异性抗体 |
临床2期 |
|
6MW 3211 |
CD47×PDL1 |
迈威生物 |
急性髓性白血病 骨髓增生异常综合征 |
双特异性抗体 |
临床2期 |
|
替达派西普 |
CD47 |
宜明昂科 |
白血病;骨髓增生;晚期恶性实体瘤 |
融合蛋白 |
临床2期 |
|
IMM-0306 |
CD20×CD47 |
宜明昂科 |
弥漫性大B细胞淋巴瘤 |
双特异性抗体 |
临床1/2期 |
|
IBC-0966 |
CD47 x PDL1 x SIRPα |
北京星昊 |
肿瘤,非霍奇金淋巴瘤,实体瘤 |
融合蛋白 |
临床1/2期 |
|
SG404 |
CD47×PHD2 |
杭州尚健 |
血液肿瘤,实体瘤 |
融合蛋白 |
临床1期 |
|
AK-132 |
CD47 x CLDN18.2 |
中山康方 |
晚期恶性实体瘤 |
双特异性抗体 |
临床1期 |
|
BAT-7104 |
CD47×PDL1 |
百奥泰 |
晚期恶性实体瘤 |
双特异性抗体 |
临床1期 |
|
BC-007 |
CD47 x CLDN18.2 |
宝船生物 |
CLDN18.2阳性实体瘤 |
双特异性抗体 |
临床1期 |
|
3D-197 |
CD47 |
思路迪 |
晚期癌症,血液肿瘤,实体瘤 |
单克隆抗体 |
临床1期 |
|
PT 886 |
CD47 x CLDN18.2 |
凡恩世制药 |
胃食管交界处腺癌,胰腺导管腺癌 |
双特异性抗体 |
临床1/2期 |
|
CM-312 |
CD47 |
康诺亚 |
淋巴瘤,实体瘤 |
单克隆抗体 |
临床1期 |
|
D3L-001 |
CD47 x HER2 |
德昇济医药 |
HER2阳性实体瘤,乳腺癌,胃癌 |
双特异性抗体 |
临床1期 |
|
FP-002 |
CD47 |
菲鹏生物 |
晚期恶性实体瘤 |
单克隆抗体 |
临床1期 |
|
金妥利株单抗 |
CD47 |
长春金赛 |
急性髓性白血病 |
单克隆抗体 |
临床1期 |
|
HMPL-A83 |
CD47 |
和黄医药 |
晚期癌症,血液肿瘤,实体瘤 |
单克隆抗体 |
临床1期 |
表1. 部分在研药物
6.CD47相关活性检测细胞株
✦案例展示
NovoBio开发的靶细胞A549-CD47-GFP-Luc过表达CD47(CD47是一种免疫球蛋白样蛋白),下游具有信号通路和Luciferase报告基因。效应细胞Raw264.7-SIRPα-RFP过表达巨噬细胞上的信号调节蛋白α(SIRPα)。CD47与SIRPα相互作用时,SIRPα能够识别CD47而结合,释放“Don't eat me”信号,效应细胞不能吞噬靶细胞A549-CD47-GFP-Luc。当加入抗体Anti-CD47后,抗体Anti-CD47与A549-CD47-GFP-Luc表面CD47蛋白结合,阻断SIRPα与CD47蛋白的结合,从而释放“Eat me”信号,下游信号通路报告基因Luciferase的表达会衰减;Luciferase的信号值高低和Anti-CD47抗体、SIRPα或其抗体的生物学活性或浓度成反比。
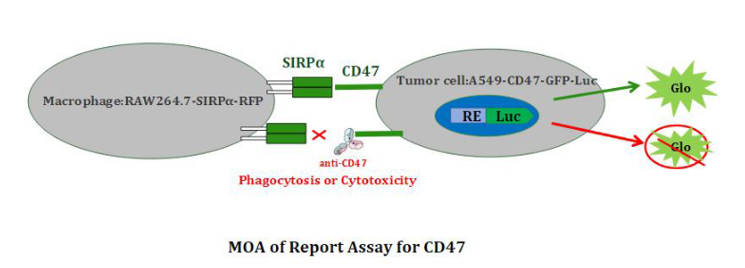
图4. 报告基因法检测CD47作用机制图
✦数据展示
(1)流式数据
① A549-CD47-GFP-Luc细胞株的亚克隆细胞进行流式细胞FACS检测,与宿主空细胞A549(Blank)比较,细胞表面CD47-GFP的阳性率达98%。其流式结果图如下
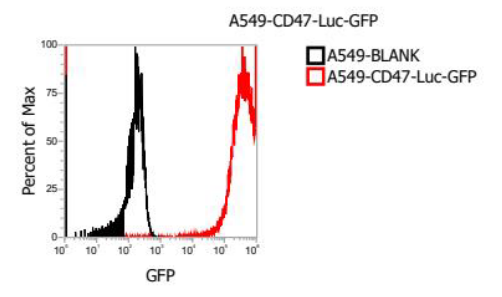
图5. 靶细胞 A549-CD47-GFP-Luc 表面 CD47-GFP 表达流式图谱
② Raw-264.7-SIRP𝐀-RFP效应细胞的流式细胞FACS检测,细胞中加入PE-SIRP𝐀抗体进行检测,与宿主细胞Raw264.7(Blank)比较,阳性率达99%。其流式结果图如下
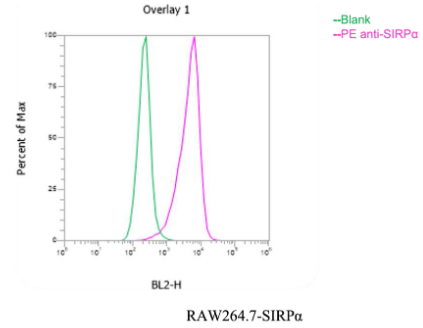
图6. 效应细胞 Raw264.7-SIRPα-RFP 表面 SIRPα 表达流式图谱
(2)活性考察
考察效应细胞Raw264.7-SIRP𝐀-RFP的活性,用A549-CD47-GFP-Luc作为靶细胞,报告基因Luciferase信号值随着加入抗体Anti-CD47的增多而衰减,孵育48小时后,吞噬机制下的活性结果如下:
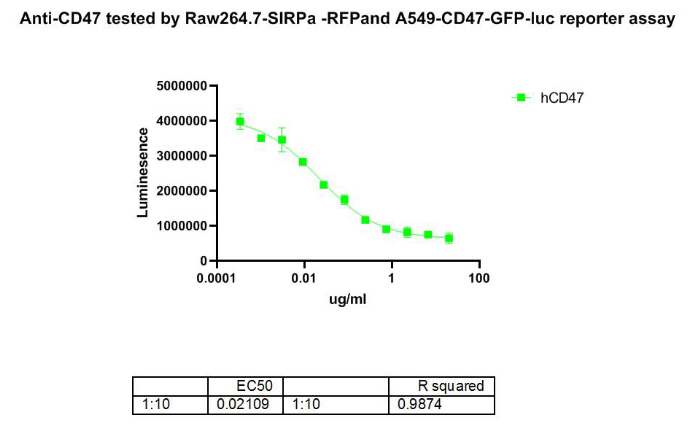
图7. 报告基因法检测 Anti-CD47 抗体阻断 CD47/SIPRα信号通路结果
(3)实际价值
不同于信号通路变化的评价方式,NovoBio报告基因细胞株的评价方式是细胞吞噬能力,是真正细胞功能的检测,更具有实际价值。
(4)优势特点
✅方法稳定,变动小;
✅实验窗口大,响应值高;
✅利用转基因构建的效应细胞可稳定传代;
✅该细胞株可以作为所有CD47靶点蛋白活性检测的效应细胞;
✅适合放行、长期稳定检测,方便方法验证。
📚 充实您的研究方法学,推动医学科学的进步!💪




