大脑中的战争 – 神经炎症的两面性
发布时间:2024-02-19 16:30 | 点击次数:
概览
• 简介
• 胶质细胞和巨噬细胞是第一道防线
• 血脑屏障是大脑的防火墙
• 浸润性外周免疫细胞形成骑兵
• 神经肽可调节战争
• 神经炎症的三幕交响曲:对急性缺血性脑中风的深刻见解
• 产品
• 参考文献
简介
神经炎症,被定义为中枢神经系统(CNS)内一种炎症反应,是由多种因素包括感染(例如COVID-19、弓形虫病、疟疾)、有毒代谢物、创伤、出血或者自身免疫过程触发的过程(Tohidpour et al., 2017)。中枢神经系统发生炎症是由细胞通过模式识别受体(PRRs)感知病原体相关的分子模式(PAMPs,例如,来自细菌的脂多糖(LPS)或者脂多糖酸)或者损伤相关的分子模式(DAMPs,例如来自受损神经元的原子核或者胞质蛋白或者核酸、胞外ATP或者寄生虫疟色素)通过模式识别受体(PRRs)引起的。
当炎症活动时期较短时,神经炎症在其正常先天反应中被认为具有神经保护作用;然而,长期或者不能适应的神经炎症是驱动许多神经性疾病包括神经退行性疾病(例如阿尔兹海默症和帕金森病、癫痫和运动退行性疾病)和精神疾病(如精神分裂症和抑郁症)以及中风、脑癌、疼痛综合征和创伤性脑损伤的关键病理性因素(Chaney et al., 2021)。
中枢神经系统中的免疫激活涉及小胶质细胞和星形胶质细胞,以及内皮细胞和血管周细胞。它会引起一种短暂的、自我限制的免疫系统反应,从而启动组织修复。当正常的解决机制失败时,持续的炎症反应则会发生,它是有害的并会抑制再生。持续性炎症可由内源性因素(例如基因突变、蛋白聚集如α-突触核蛋白或者β淀粉样蛋白)或者环境因素(例如感染、创伤)触发。不健康的生活方式、过度肥胖、糖尿病、精神压力、睡眠不足和衰老也会增加神经性炎症的可能性。
图1:中枢神经系统(CNS)中的急性炎症伴随着神经退行性变和胶质细胞的激活
胶质细胞和巨噬细胞是第一道防线
小胶质细胞、星形胶质细胞和寡突胶质细胞是普遍分布在脑实质中的胶质细胞,它们可与脑相关巨噬细胞(BAMs)以一种协同的方式启动和调节大脑的炎症反应。
以前,人们认为巨噬细胞、小胶质细胞和星形胶质细胞经历了一个简单的极化,形成了促炎或抗炎表型。这些表型分别被称为M1小胶质细胞和M2巨噬细胞(M1和M2分别为小胶质细胞和巨噬细胞极化的范例),或者A1/A2星形胶质细胞。根据此观点,促炎表型中的免疫细胞可通过释放促炎细胞因子、招募其它免疫细胞,并在邻近细胞中诱导炎症反应来引发炎症。相反,抗炎表型中的细胞可通过释放抗炎细胞因子和通过营养因子的释放来促进组织修复,从而调节和停止潜在的炎症过程。
然而,最近的研究,特别是全基因组表达谱的研究已揭示了这些细胞表型的复杂性。研究显示,这些细胞可经受一系列表型状态,这说明神经炎症过程比预期的更微妙,其调控更精细。这些新的发现挑战了极化的简单观点,并强调了验证过程中这些细胞类型的多面性。
小胶质细胞是中枢神经系统的固有免疫细胞,约占中枢神经系统中细胞的10%(Webers et al., 2020)和脑中胶质细胞数量的20%(Troncoso-Escudero et al., 2018)。小胶质细胞的特征是高度变化的过程,当它们处于静止状态时,这有助于检测病原体和微环境中的细微变化。它们可作为哨兵通过表面受体识别补体片段、免疫球蛋白、黏附分子、趋化因子受体(CCR)、toll样受体(TLR)、嘌呤受体、清道夫和Fc受体(Jurga et al., 2020; Prinz et al., 2021; Dermitzakis et al., 2023)。
静止状态可被危险信号包括PAMPs 和 DAMPs转为激活状态。激活的小胶质细胞通过释放细胞因子来交流,细胞因子会警告周围细胞并影响他们的功能。它们可产生促炎介质(例如肿瘤坏死因子-α (TNF-α)、白细胞介素IL-1β、IL-6、IL-12和IL-18、干扰素γ (IFN-γ)、诱导型一氧化氮合酶(iNOS)和单核细胞趋化蛋白(MCP-1))和抗炎介质(例如白细胞介素IL-4、IL-10和IL-13,转化生长因子-β(TGF-β)(Angiulli et al., 2021)。
图 2:P2Y12 在静止小胶质细胞中表达。用小鼠抗-P2Y12 (cat. 476 011, 1:2000,红色)和豚鼠抗-IBA1(cat. no. 234 308, 1:500, 绿色)抗体对经PFA固定的小鼠大脑皮层进行间接免疫染色。细胞核被 DAPI染为蓝色。
图 3:用豚鼠抗-CD11c (稀释比例 1:1000; 红色) 和兔抗-IBA1 (cat. no. HS-234 013 稀释比例1:1000; 绿色)对经PFA固定的(A):野生型和(B):三重转基因阿尔兹海默症的小鼠大脑皮层切片进行间接免疫染色。红色标记显示CD11c仅在激活的小胶质细胞中表达。细胞核被 DAPI染为蓝色。
值得注意的是,小胶质细胞的激活伴随着蛋白表达的变化。静息小胶质细胞的特征蛋白如P2Y12(图2)、CX3CR1、HexB或TMEM119的表达下调,而其它蛋白,例如CD11c(图3)、CD86(图4)、CD11b、IBA1、CD68、F4/80(小鼠特异)和半乳凝素-3(图5)的表达上调或表达仅取决于小胶质蛋白的激活(Benmamar-Badel et al., 2020, Jurga et al., 2020, Almolda et al., 2015, Garcia-Revilla et al., 2022)。
除了这些急性变化,小胶质细胞在暴露于炎症刺激后会表现出持久的变化并且变得对潜在的温和刺激更敏感。一方面,小胶质细胞启动效应可为小胶质细胞以后的免疫变化做准备;另一方面,小胶质细胞终生持续暴露在感染中可能引起神经退行性疾病 (Lima et al., 2022)。
在老年大脑中发现的小胶质细胞转录组变化会引起炎症增强、吞噬功能受损和深刻的形态改变,从而降低免疫监视。在神经退行性疾病的小鼠模型中,已经发现了具有“疾病相关小胶质细胞”(DAM)特征的小胶质细胞(Finger et al., 2022)。
图 4:(A):活化小胶质细胞在小鼠中风脑的同侧海马体中可高度表达CD86(绿色)和CD11b(红色)。(B):海马区的高倍放大显示这两种标记物在活化小胶质细胞亚群中的共定位。使用兔抗-CD86 (cat. no. HS-466 003, 1:600, 绿色)和大鼠抗-CD11b(cat. no. HS-384 117, 1:250, 红色)抗体,通过酪酰胺信号放大技术,对经福尔马林固定、石蜡包埋的小鼠中风脑切片(在中大脑动脉闭塞(MCAO)后14天)进行间接免疫染色。细胞核被 DAPI染为蓝色。
图 5:活化小胶质细胞在小鼠中风脑的病变区域可高度表达半乳糖凝集素-3(粉色)、CD11b(红色)和(绿色)。使用(A):大鼠抗半乳糖凝集素-3(cat. no. HS-477 017, 1:500,粉色),(B):兔抗-CD11b (cat. no. HS-384 008, 1:500,红色)和(C): 豚鼠抗-IBA1(cat. no. 234 308, 1:500,绿色)抗体,对经PFA固定的小鼠脑切片(在中大脑动脉闭塞后14天)进行间接免疫染色。(D):病变区的高倍放大显示不同小胶质细胞表型单独表达IBA1或与CD11b和/或半乳糖凝集素-3联合表达。细胞核被DAPI染为蓝色。
边界相关巨噬细胞(BAMs)是位于中枢神经系统(CNS)和周围神经系统(PNS)界面的不同解剖特化处的巨噬细胞,特别是位于脑和脊髓周围的脑膜(软脑膜、蛛网膜和硬膜),血管周围丛和脉络膜丛。虽然BAMs在传统上被认为是中枢神经免疫系统的一个必要组分,但直到最近,其概况及在维持大脑防御和体内平衡的功能才在先进研究工具的帮助下阐明(Mildenberg, 2022)。
BAMs起源于卵黄囊中早期红髓祖细胞的CD206+巨噬细胞群(CD206是BAMs特有的一般标记物)。这些细胞构成了能够自我维持的稳定细胞群,并且它们能被来源于骨髓的单核细胞进行部分补充(至少在脉络膜丛)。一方面,BAMs的亚群在形态和运动性上普遍存在差异。然而,与小胶质细胞不同,BAMs不具有广泛的分支过程并表现出有限的运动性。另一方面,与小胶质细胞相似,BAMs具有高抗原呈递能力并能够有效地吞噬入侵的病原体和外来物质。它们分泌细胞因子和趋化因子,可影响局部微环境来响应损伤或炎症。由于BAMs位于CNS/PNS的边界,所以它们在从外围招募循环免疫细胞中起着关键作用。因此,它们在关键过程中例如血管发育、脂质和胆固醇代谢、免疫反应和抗原呈递,表现出共同的基因上调。BAMs可通过表达CD206(图6)和CD163(图7)而与小胶质细胞区分。此外,BAMs可表达特征性巨噬细胞标记物,包括整合素αM (CD11b),IBA1 (Aif1),巨噬细胞集落刺激因子(Csf1R)受体和F4/80,从而增强了它们的巨噬细胞特征(Gerganova, 2022)。
图 6:CD206阳性BAMs 位于血管上。使用兔抗-CD206 (cat. no. HS-488 003, DAB, 棕色) 和大鼠抗-IBA1(cat. no. HS-234 017, AP-RED, 红色)抗体,对经福尔马林固定石蜡包埋的小鼠脑切片进行间接免疫染色。细胞核被苏精染色可见为蓝色。
图7:CD163与IBA1在血管周围巨噬细胞中的共定位。SMA突出了血管边界。使用兔抗-CD163 (cat. no. HS-455 003, 2 µg/ml, 红色),小鼠抗-IBA1 (cat. no. 234 011, 1:500,绿色)和豚鼠抗-α-平滑肌肌动蛋白(SMA) (cat. no. 449 004, 1:500, 浅蓝)抗体,对经PFA固定的小鼠脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
星形胶质细胞约占所有脑细胞的50%(Alghamri et al., 2021),是中枢神经系统中最丰富的胶质细胞。星形胶质细胞具有多种功能,包括神经系统的机械支持、脑代谢的调节、神经递质的摄取和释放以及参与功能性突触的形成,从而有助于维持健康大脑(Chiareli et al., 2021)。
在病理条件下,星形胶质细胞会经历反应性星形胶质细胞增生,形态和功能会发生改变。反应性星形胶质细胞的特征是胶质纤维酸性蛋白(GFAP)和波形蛋白的表达增加(Singh, 2022) (图8),并且S100B蛋白合成上调(Higashino et al., 2009)。最近发表的文章描述了在脑损伤和神经系统疾病中可信赖的新的星形胶质细胞标记物,例如醛缩酶C(ALDOC)(Haddadi et al., 2022),兴奋性氨基酸转运蛋白1(EAAT1, GLAST)(Beschorner et al., 2007)和谷氨酰胺合成酶(GS)(Sandhu et al., 2021)。与小胶质细胞相似,星形胶质细胞在识别周围信号之后变得活跃,例如积累Aβ聚集体(Chiarini, 2020),释放促炎和抗炎性细胞因子(Tang et al., 2021; Liddelow et al., 2017; Escartin et al., 2021)。星形胶质细胞和小胶质细胞在中枢神经系统内的炎症反应中扮演着相互关联的角色。星形胶质细胞可通过释放促炎性细胞因子激发小胶质细胞活化,激活小胶质细胞转而可通过由星形胶质细胞表达的细胞因子受体进一步刺激炎症反应。反应性星形胶质细胞也可以对大脑产生直接的负面影响。例如,星形胶质细胞的一个谷氨酸输入体,EAAT2,在反应性星形胶质细胞中经常下调,这会导致细胞外谷氨酸浓度升高,随后通过兴奋性毒性危害神经元(Dahlmanns et al, 2023)。因此,星形胶质细胞可对整个中枢神经系统的邻近细胞施加调节影响(Reid and Kuipers, 2021; Rothhammer and Quintana, 2015)。
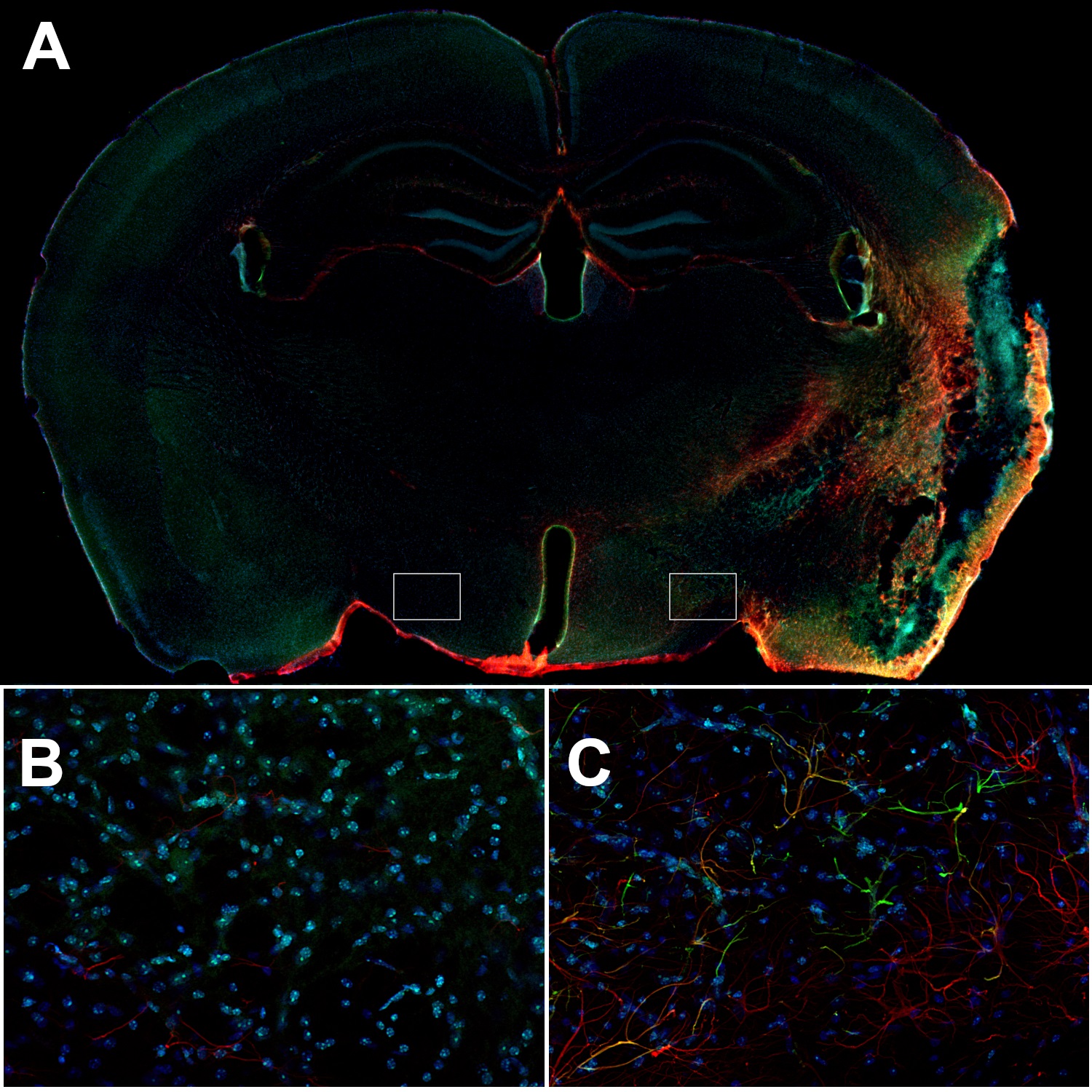
图8:小鼠中风大脑的同侧皮层中的反应性星形胶质细胞可表达高水平GFAP和波形蛋白。(A):使用兔抗-GFAP (cat. no 173 208, 1:500,红色)和豚鼠抗-波形蛋白(cat. no 172 004, 1:500,绿色)抗体,对经PFA固定的小鼠脑切片(在MCAO后14天)进行间接免疫染色。(B):对侧下丘脑中的星形胶质细胞是波形蛋白阴性并且GFAP的表达在(C):同侧下丘脑中会比星形胶质细胞显著降低。细胞核由DAPI染色可见为蓝色。
星形胶质细胞不仅控制免疫反应,也会通过控制疤痕形成及神经发生和突触发生而影响受伤之后的组织再生过程(Chiareli et al., 2021)。此外,星形胶质细胞有助于血脑屏障的完整性和调节,这会帮助大脑免受有害物质的侵害。功能失调性星形胶质细胞普遍携带表达基因突变或者疾病易感多态性,这会导致或促成神经退行性疾病紊乱例如亨廷顿病或者阿尔兹海默症。
寡突胶质细胞是一种神经胶质细胞,可启动髓鞘化,使得电位传导并协助神经代谢。寡突胶质细胞是中枢神经系统中炎症反应的主要目标,炎症反应可由浸润巨噬细胞和小胶质细胞释放的有害细胞因子、T淋巴细胞的细胞毒性或者由抗体诱导的抗体介导细胞毒性而触发(Kölliker-Frers et al., 2021)。然而,寡突胶质细胞也可通过生成广泛的免疫调节因子(如CXCL10、CCL2、CXCR2、CCL3)积极影响炎症反应。寡突胶质细胞也可在炎症和感染期间表达白细胞介素(如IL-4、IL-6、IL-10、IL-12)和其它细胞因子受体,表明它们可招募小胶质细胞到受伤组织中(Kölliker-Frers et al., 2021)。研究已表明,寡突胶质细胞祖细胞(OPCs,也被鉴定为NG2胶质细胞)在多发性硬化症中不仅仅是旁观者,也具有向T细胞呈递抗原的能力,并在神经炎症和神经退化中扮演着重要的角色(Psenicka et al., 2021, Poggi et al., 2023)。
Products Astrocytes & Oligodendrocytes in inflammation
血脑屏障是大脑的防火墙
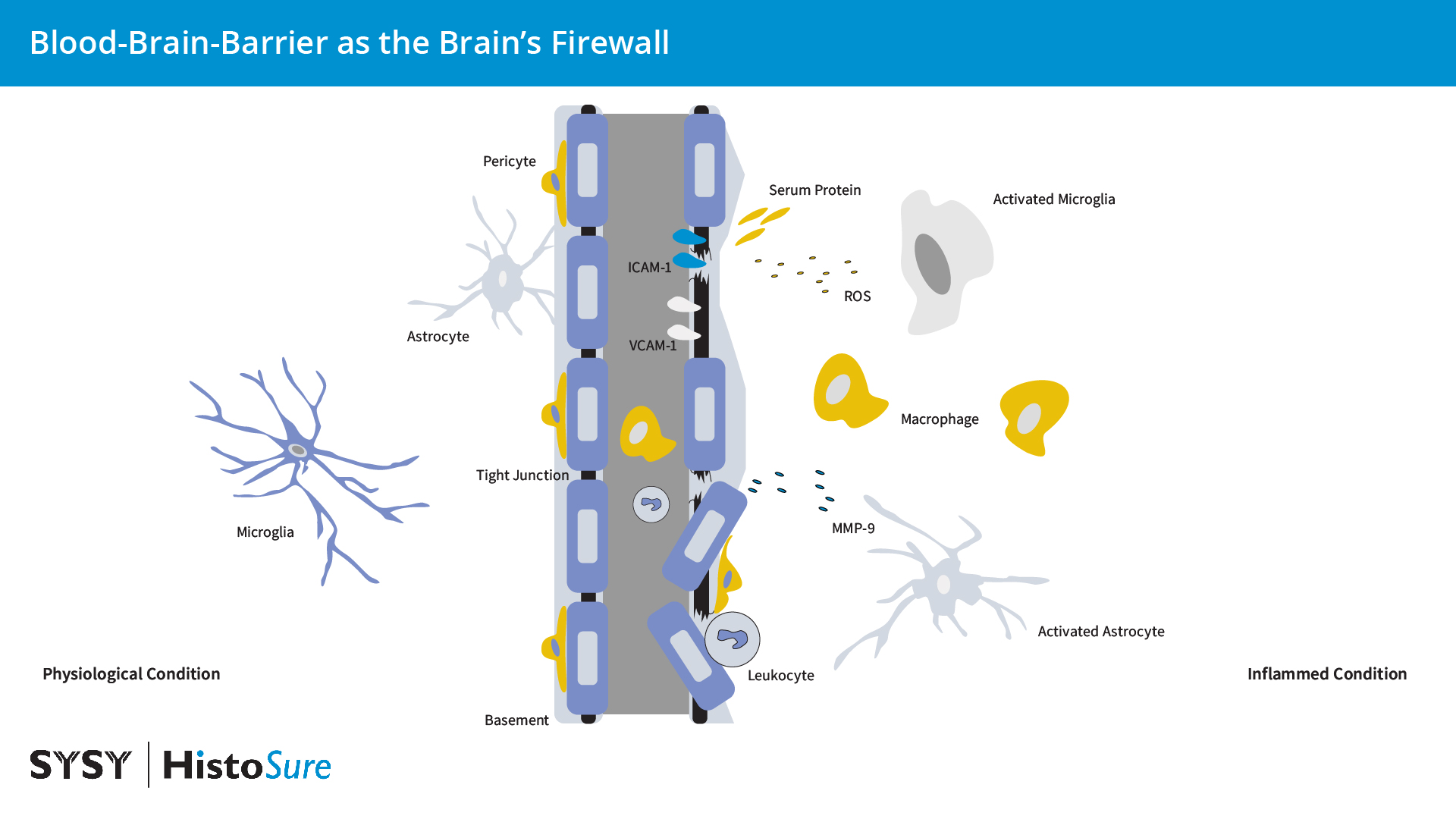
图 9:在生理条件下,脑内皮细胞由紧密和粘附连接例如咬合蛋白和闭合蛋白,从而使得血脑屏障的细胞间通透性低。炎症条件下星形胶质细胞和小胶质细胞的活化会引起细胞因子、趋化因子和基质金属蛋白酶(MMPs)的产量增加。来源于胶质细胞的活性氧(ROS)和MMP-9会影响血脑屏障的完整性。ICAM1和VCAM1表达的增加可促进白细胞聚集进入大脑。免疫细胞和其它血液物质的浸润可增强胶质细胞的活化。
血脑屏障(BBB)是大脑的防火墙,因此可维持大脑内稳态并保护神经元。血脑屏障是高度特化的多细胞结构,可作为外周循环和中枢神经系统之间的选择性扩散屏障。血脑屏障由毛细血管壁的内皮细胞即脑微血管内皮细胞(BMECs)、周细胞和星形胶质细胞(由星形胶质细胞足突覆盖的星形胶质基底膜)组成(图9)。BMECs由复杂紧密连接(TJs)和粘附链接(AJs)连接,例如咬合5和闭合蛋白(图10),来限制分子在中枢神经系统中的细胞旁和细胞外扩散。血脑屏障不是真正意义上的墙,而是血液循环和大脑之间的选择性屏障,可严格调控多种物质和血细胞从血液到大脑的转移。由于大脑是人体能量消耗最多的器官,多种高表达的受体和转运体例如转移受体(TfR)、低密度脂蛋白受体(LDLR)和葡萄糖转运体-1(GLUT1)在向大脑提供必需营养方面扮演着极其重要的角色(Han and Jiang et al., 2020)。一种特性的改变,例如胞吞作用或者转运可显著改变神经元环境并引起癫痫、自闭症谱系和精神运动迟缓综合征。
图10:咬合蛋白在紧密连接的细胞旁通透性屏障形成和调节中发挥作用。使用豚鼠抗-咬合蛋白(cat. no. 447 005, 1:500,红色)和小鼠抗-GFAP(cat. no 173 011, 1:500,绿色)抗体,对经PFA固定的小鼠大脑皮层进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图11:水通道蛋白-4 (AQP4)在环绕血管的星形胶质细胞血管周围足突上表达。使用小鼠抗-AQP4 (cat. no. 429 011, 1:500,红色)和大鼠抗-CD31 (cat. no. HS-351 117, 1:500,绿色)抗体,对经PFA固定的小鼠大脑皮层切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
衰老会引起血脑屏障的结构和功能改变,这会使得大脑更容易发生神经元损伤或者甚至神经变性(Hussain et al., 2021)。这些改变包括与年龄相关的周皮细胞功能障碍和血管细胞粘附分子1(VCAM1)上调。例如一些研究将血脑屏障功能障碍与阿尔兹海默症病理联系起来(Profaci et al., 2020)。在中风情况下,周皮细胞收缩大脑毛细血管然后死亡,这可能会引起血流量长期持续减少和血脑屏障功能丧失,从而导致神经细胞死亡的增加(Hall et al., 2014)。其它影响血脑屏障通透性的因素有例如不健康饮食或全身性炎症引起的肠道菌群变化(Sun et al., 2022)。
水通道蛋白-4(AQP4)是中枢神经系统中最丰富的双向水通道,并在环绕血管的星形胶质细胞血管周围足突上密度最高(图11)。水通道蛋白4在血脑屏障破坏中扮演着必不可少的角色。水通道蛋白4的异常表达和功能障碍已在多种认知障碍例如阿尔兹海默症、血管性痴呆和克雅氏症(CJD)中发现(Wang et al., 2022)。多种脑部疾病中的血脑屏障功能性障碍也包括受损的转运机制。在生理条件下,内源性Aβ与内流受体RAGE(糖化终产物受体)和外流受体LRP1(低密度脂蛋白受体相关蛋白)以及转运蛋白P-糖蛋白(P-gp)协同工作,可通过血脑屏障而被双向转运。在患有阿尔兹海默症时,增加的RAGE,减少的LRPI和P-gp转运蛋白会促进Aβ在大脑中积累。GLUT1表达的减少导致葡萄糖转运受损,并与阿尔兹海默症病理中的血脑屏障破坏有关。增强的跨细胞转运是中风早期的特征,并由增加的内皮小凹蛋白表达调控(Han and Jiang, 2020)。通过基质蛋白酶(MMPs)、细胞外基质(ECM)和TJ蛋白的降解,Cav-1也直接决定了中风后内皮屏障的完整性并负责调控梗死周围区域中的血栓炎症活性(Zhang et al., 2022)。
血脑屏障损坏使得免疫细胞或者血浆蛋白进入脑实质,引起大脑中的炎症过程。细胞间粘附分子(ICAM)1、VCAM1和血小板内皮粘附分子1(PECAM 1,CD31)在内皮细胞中可在低水平组成性表达。在缺氧条件下或通过释放细胞因子IL-1β和TNF-α,ICAM1和VCAM1会显著增加(图12)。在神经炎症和缺血期间,ICAM1可调节白细胞聚集进入大脑中,而VCAM1的作用还不太清楚(Yang et al., 2019)。限制免疫细胞贩运通过血脑屏障已被证明在MS中有效。然而,低水平的白细胞贩运对限制感染是必需的。免疫细胞和其它血液物质的浸润增强了神经胶质细胞的活化。因此,血脑屏障功能障碍会增加神经炎症的发生(Takata et al., 2021)。
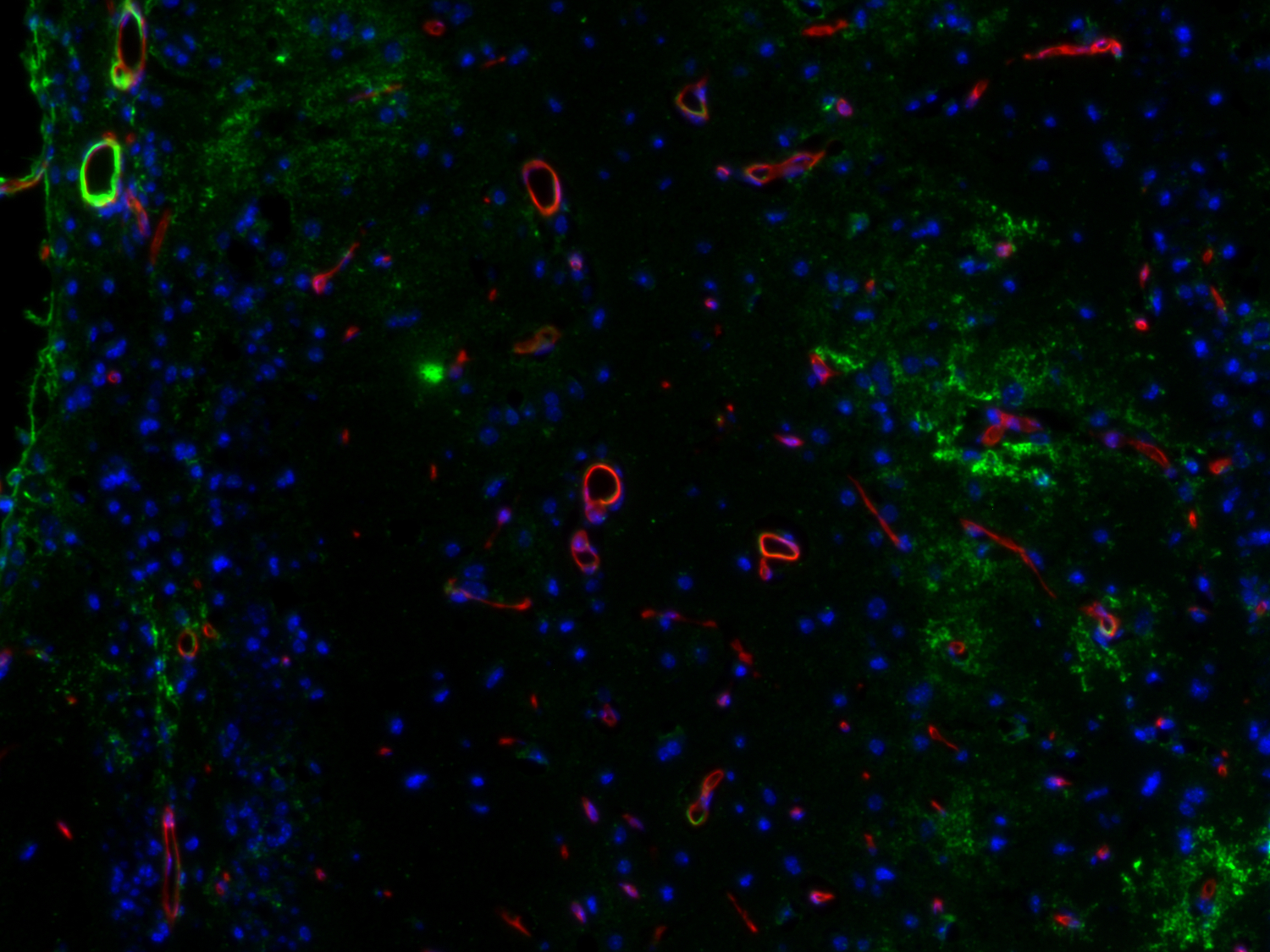
图12:VCAM1在靠近脑中风病变位点的血管中的表达增加。使用豚鼠抗-VCAM1 (cat. no. HS-470 004, 1:750,绿色)和大鼠抗-CD31 (cat. no. HS-351 117, 1:1500,红色)抗体,通过酪酰胺信号放大技术对经福尔马林固定、石蜡包埋的小鼠中风脑切片(在中大脑动脉闭塞后14天)进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
浸润性外周免疫细胞可形成骑兵
在正常情况下,血脑屏障可严格限制外周免疫细胞浸润进入中枢神经系统。只有少数免疫细胞亚群由于免疫监听所需因而可在脑脊液(CSF)中检测到并在多步外渗过程中会通过血脑屏障迁移。在缺乏由APCs(抗原呈递细胞)呈递的中枢神经系统抗原时,T细胞仅会穿过血脑屏障的内皮,而不是胶质细胞层,并会留在中枢神经系统。在炎症期间,T细胞会识别在血管周围抗原呈递细胞上它们的同源抗原并在血脑屏障后被重新激活。由骨髓细胞和星形胶质细胞生成的基质金属蛋白酶可切开星形胶质细胞足突,从而使得T细胞可进入中枢神经系统实质。粘附分子表达的改变和连接分子在炎症期间表达下降促进了外周免疫细胞聚集通过血脑屏障(Marchetti and Engelhardt, 2020)。外周免疫细胞在神经炎症中发挥双重作用,可以产生保护影响或者致病作用(图13)。
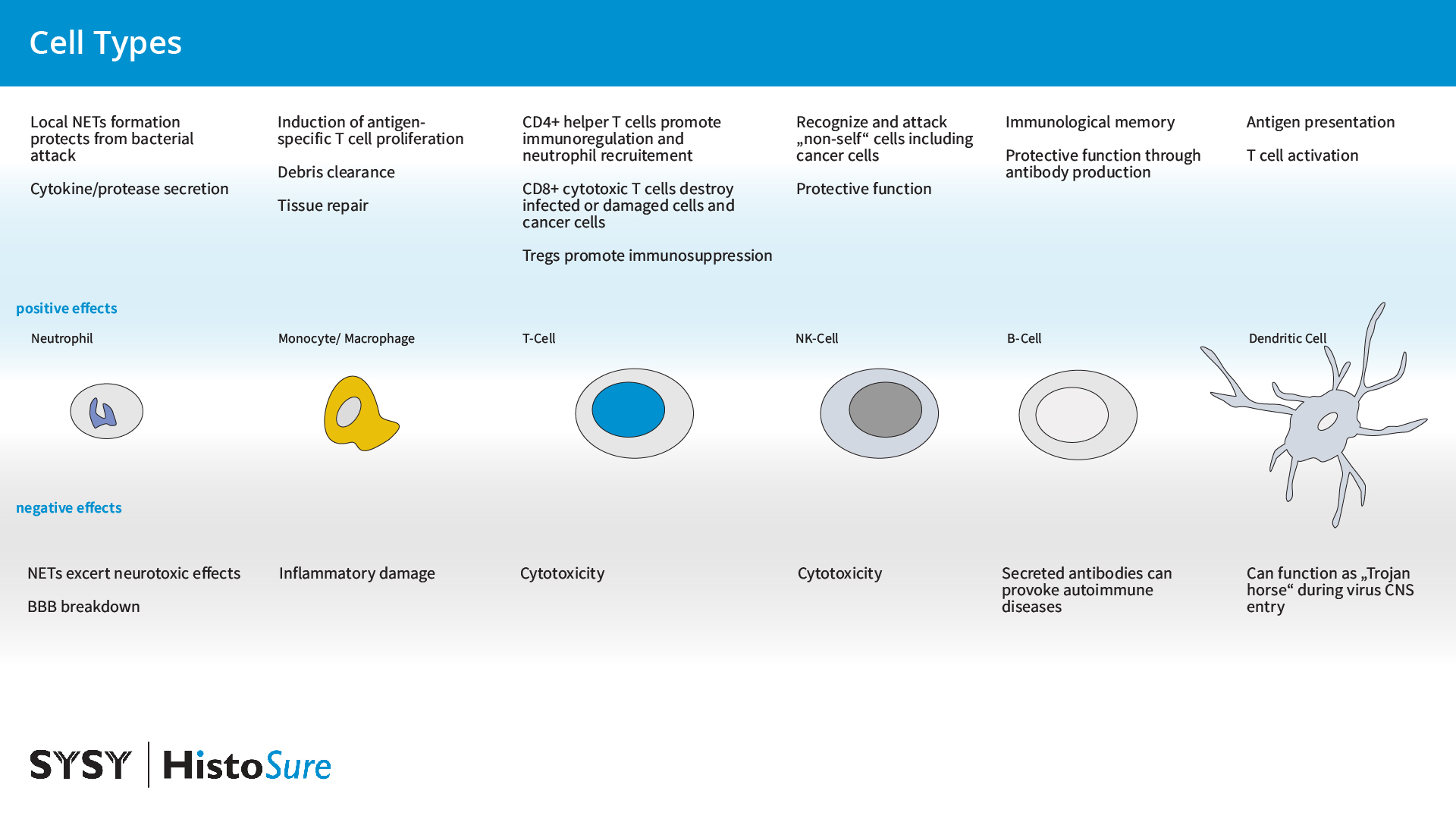
图13:外周免疫细胞的好处和坏处:炎症期间外周免疫细胞的浸润在大脑中产生保护(显示为蓝色)或者致病(标记为灰色)作用。
中性粒细胞是中枢神经系统病理生理学急性期间由化学介质或者DAMPs吸引到损伤或炎症部位的第一批细胞。Chil3(YM-1)是由中性粒细胞表达的一种啮齿类几丁质酶样蛋白(CLP)(图14),也是由巨噬细胞、小胶质细胞和破骨细胞交替活化的肺泡巨噬细胞(Kang et al., 2022)。由中性粒细胞释放的自由氧基和MMP-9会引起血脑屏障分解和外周免疫细胞浸润增加(Manda-Handzlik et al., 2019)。累积的中性粒细胞会释放由DNA和蛋白质组成的细胞外网结构,称为中性粒细胞胞外陷阱(NETs),这会保护受伤的大脑免受细菌、寄生虫、病毒和真菌的攻击。然而,NET的过度形成与脑部疾病和神经病理学有关(Manda-Handzlik et al., 2019)。
T细胞是适应性免疫系统的重要免疫细胞,在位于中枢神经系统中时经常被认为是致病的。T细胞有两种主要类型:细胞毒性CD8+细胞和CD4+辅助T细胞(图15)。最近的研究表明T细胞在限制炎症和中枢神经系统损伤中发挥着积极作用。在正常条件下,软脑膜巨噬细胞和脉络膜丛抗原呈递细胞(APCs)会向中枢神经系统中含有的CD4T细胞呈递抗原,使得T细胞进入中枢神经系统。T细胞在短期内具有神经保护作用,但是如果炎症不能消退,它可能会变为致病性。致病性T细胞已在MS和慢性神经退行性疾病如PD或AD中出现。组织驻留记忆T细胞(TRM细胞)已在小鼠和人类大脑实质中发现,它对局部保护、抵抗病原体来说必不可少(Smolders et al., 2018)。在健康大脑中,CD4T细胞通过帮助小胶质细胞成熟来参与大脑发育(Pasciuto et al., 2020)。
图14: Chil3(YM-1)一种啮齿类动物特异性的中性粒细胞颗粒蛋白,可观察中性粒细胞浸润。使用(A):大鼠抗-Chil3 (cat. no. HS-442 017, 1:1500,红色)和兔抗-CD45 (cat. no. HS-427 008, 1:2000,绿色)抗体或者(B):大鼠抗-Chil3 (cat. no. HS-442 017, 1:1500,红色)和兔抗-IBA1 (cat. no. HS-234 008, 1:2000,绿色)抗体,通过酪酰胺信号放大技术,对福尔马林固定、石蜡包埋的感染SARS-CoV2的K18-hACE2转基因小鼠大脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图15:在感染弓形虫的小鼠大脑中检测到CD4阳性(红色)辅助T细胞和CD8阳性细胞毒性T细胞。使用大鼠抗-CD4 (cat. no. HS-360 117, 1:200,红色)和兔抗-CD8a (cat. no. HS-361 003, 1:250,绿色)抗体,通过酪酰胺信号放大技术,对经福尔马林固定、石蜡包埋的感染弓形虫的小鼠脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
单核细胞来源的巨噬细胞(MDMs)。典型的CCR2-阳性单核细胞仅在病理学条件下才会被招募到中枢神经系统中,在这里它们会分化成单核细胞来源的巨噬细胞(MDMs)。单核细胞来源的巨噬细胞比小胶质细胞具有更高的吞噬活性,由于MHCII的表达更高,MDMs也具有更强的诱导抗原特异性T细胞增殖的能力(Chang et al., 2021)。在中风时,浸润性巨噬细胞和单核细胞被认为与驻留细胞合作而启动了碎片清除和组织修复。在实验性中风后,抗炎单核细胞的迁移与预后改善相关。然而急性炎症可成为慢性炎症,并且在慢性病变中,炎症单核细胞和巨噬细胞已持续存在多年(Spiteri et al., 2022)。
树突细胞。CD11c-阳性脑树突细胞占大脑中发现的免疫细胞的1%并存在于脑膜、脉络膜丛、脑脊液和血管周围间隙。它们是大脑中主要的抗原呈递细胞并在稳态条件下充当哨兵。它们的数量在神经炎症期间增加。通过生成IFN,树突细胞可以直接靶向病毒或者通过激活T细胞促成神经炎症(Constant et al., 2022)。单核细胞来源的树突细胞(moDCs)在活动性炎症环境中出现并不存在于健康的实质组织中。与驻留大脑的树突细胞相比,单细胞来源的树突细胞是不太好的APCs并在炎症环境的调节和髓鞘碎片清除中起着重要作用(Giles et al., 2018)。
B细胞可通过它们对B细胞谱系特异性抗原CD19和CD20的表达来鉴定,在适应性免疫系统的许多方面发挥作用,其中最显著的是抗体的产生和分泌。在健康的大脑中,很少能在中枢神经系统实质中发现B细胞,B细胞更常见于脑膜,特别是硬脑膜中。在病毒性或细菌性中枢神经系统感染中,B细胞可能会募集并发挥保护作用。然而,抗体的分泌可导致自身免疫性中枢神经系统疾病(Jain et al., 2021)。B细胞也可通过不依赖抗体机制在神经退行性疾病中发挥作用。研究表明,B细胞来源的细胞因子可能在MS的发育中发挥作用(Ahn et al., 2021)。
自然杀伤(NK)细胞。先天淋巴细胞(ILC)家族是相对新发现的免疫细胞族群,由三个家族成员ILC1、ILC2和ILC3组成。NK细胞被认为是ILC1家族的一部分。NK细胞是骨髓(BM)来源的造血细胞,广泛分布在周围淋巴器官和循环系统中。在中风等病理条件下,NK细胞被趋化因子招募到中枢神经系统,它们在那里可具有保护功能(Wang et al., 2023)。然而,NK细胞也可能具有致病功能,这取决于NK细胞亚群、微环境、疾病类型或时期(Liu et al., 2021)。驻留的NK细胞也存在于脑实质中,在控制中枢神经系统的炎症程度上扮演着重要的角色(Hao et al., 2010)。
神经肽可调节战争
神经肽是由神经元合成和分泌的小的内源性蛋白信使,可影响发育、增殖、生理和行为(Yeo et al., 2022)。然而,现已发现神经可通过控制免疫细胞和胶质细胞功能及血脑屏障通透性来调节大脑中的炎症反应(图16)。在小胶质细胞中发现了一些神经肽受体例如神经肽(NRY)受体、血管活性肠肽(VIP)受体和垂体腺苷酸环化酶激活多肽(PACAP)受体。众所周知,VIP在外围扮演着极其重要的炎症调控角色,而且不仅仅只在神经末梢表达,也在CD4和CD8T细胞中表达。VIP通过抑制巨噬细胞和小胶质细胞活化,并作用于肥大细胞、树突细胞和滑膜成纤维细胞而表现其抗炎活性。在大脑中,VIP可促进神经元增殖、存活和轴突再生,因此MS和帕金森症的一个有希望的治疗靶点(Ganea et al., 2015; Martinez et al., 2019)。像VIP一样,PACAP也可抑制炎症并促进神经元存活,在小鼠模型中,已证明服用外源PACA对弓形虫诱导的神经炎症是有益的(Figueiredo et al., 2022)。
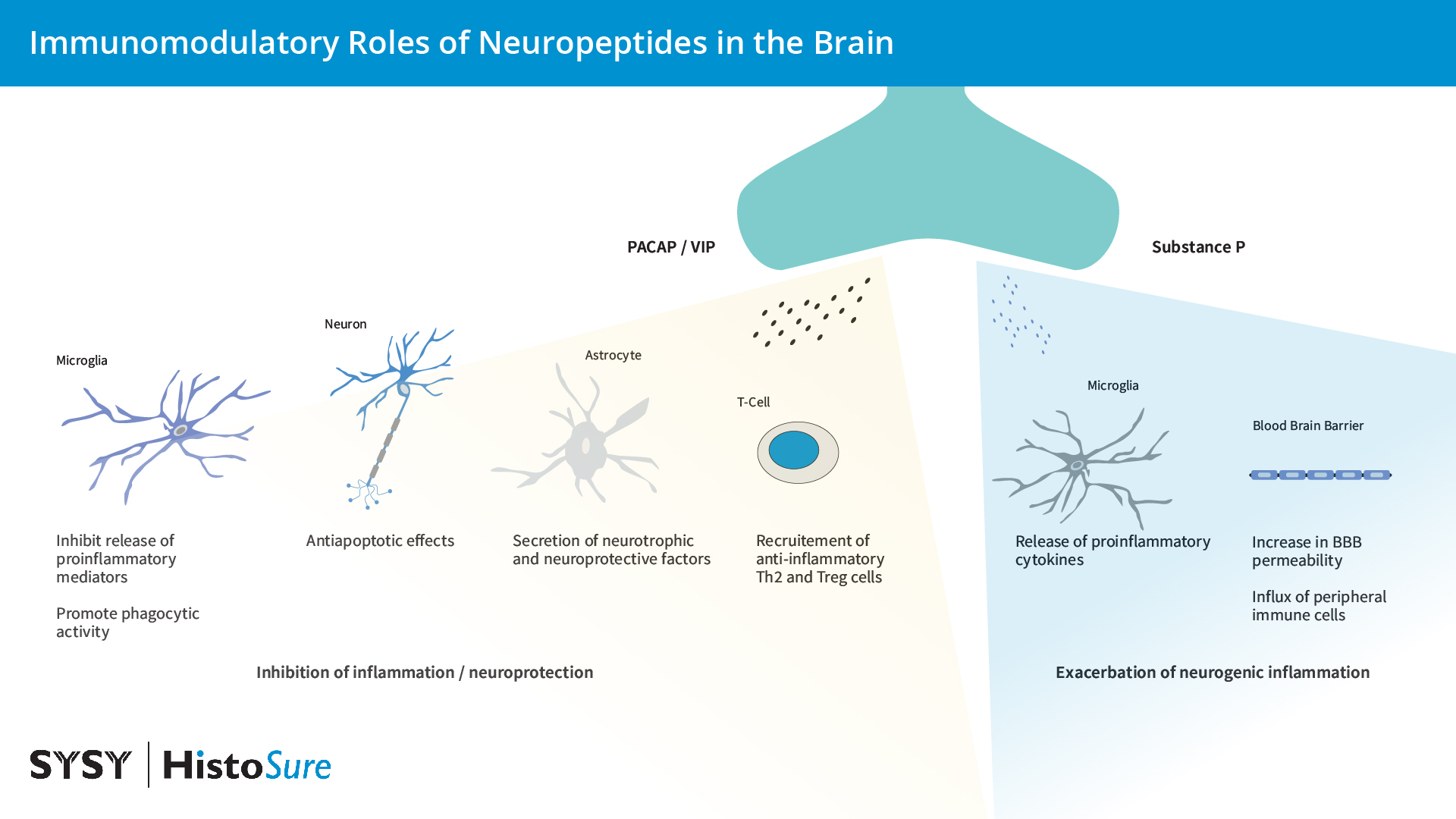
图16:大脑中神经肽PACAP、VIP和P物质的免疫调节作用。
现已显示,P物质和促肾上腺皮质激素(CRH)可激活小胶质细胞和肥大细胞,从而导致促炎细胞因子的释放,这会提高血脑屏障的通透性。通过增加血脑屏障通透性、上调P物质以及缓激肽、神经紧张素会加剧中风病理(Yeo et al., 2022)。
神经肽活性的紊乱与多种神经系统疾病有关。据报道,阿尔茨海默症患者的大脑皮层中NPY和P物质减少。据称由于NPY可以减轻Aβ累积的毒性作用,因此NPY被认为是治疗AD的潜在选择(Yeo et al., 2022)。神经肽参与炎症反应,也在疼痛反应中发挥关键作用。偏头痛和头痛是在由传入神经末梢释放的降钙素基因相关肽(CGRP)和P物质后引起的血管舒张而出现的(Carr and Frings, 2019)。
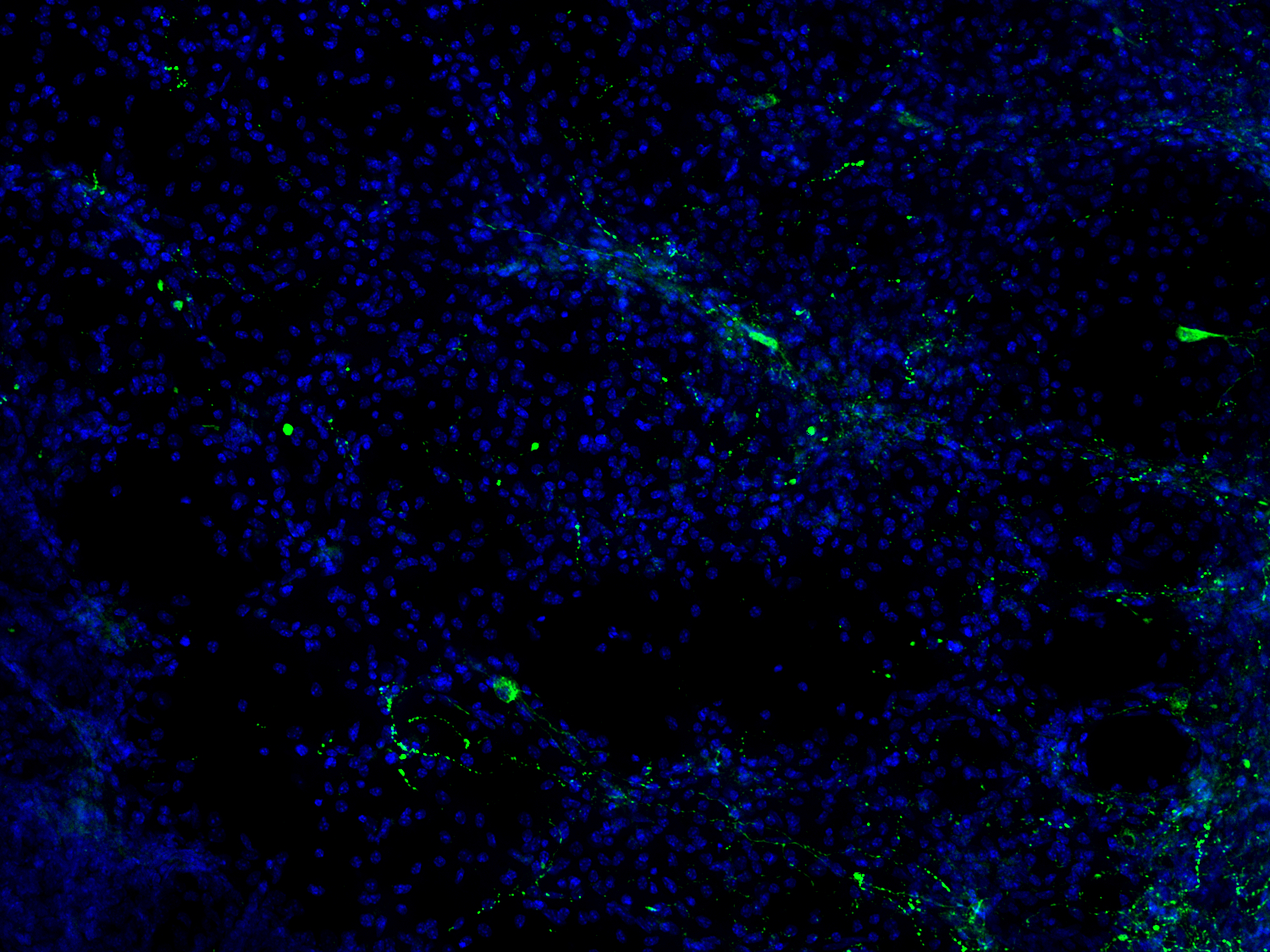
图17:NPY是一种具有促炎特性的神经肽,在中枢和周围神经系统中大量产生。NPY可通过调整关键的免疫细胞功能来调节炎症,并在中风损伤区域周围上调。使用用鸡抗-NPY (cat. no. 394 006, 1:500, 绿色)抗体,对经PFA固定小鼠脑切片(在MCAO14天后)进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
神经炎症的三幕交响曲:对急性缺血性脑中风的深刻见解
神经炎症复杂性涉及多种因素的一个例子是急性缺血性中风后的炎症过程。研究表明,中风后的炎症过程分为三个阶段:(1)急性期:在最初的几分钟到几小时内,小胶质细胞和巨噬细胞以及初始中性粒细胞内流会消除坏死细胞,(2)亚急性期:在缺血损伤后的前几天内,小胶质细胞激活和白细胞浸润解决炎症过程,以及(3)晚期:炎症细胞帮助星形胶质细胞和小胶质细胞修复过程(图18)(Jurcau and Simion, 2022)。
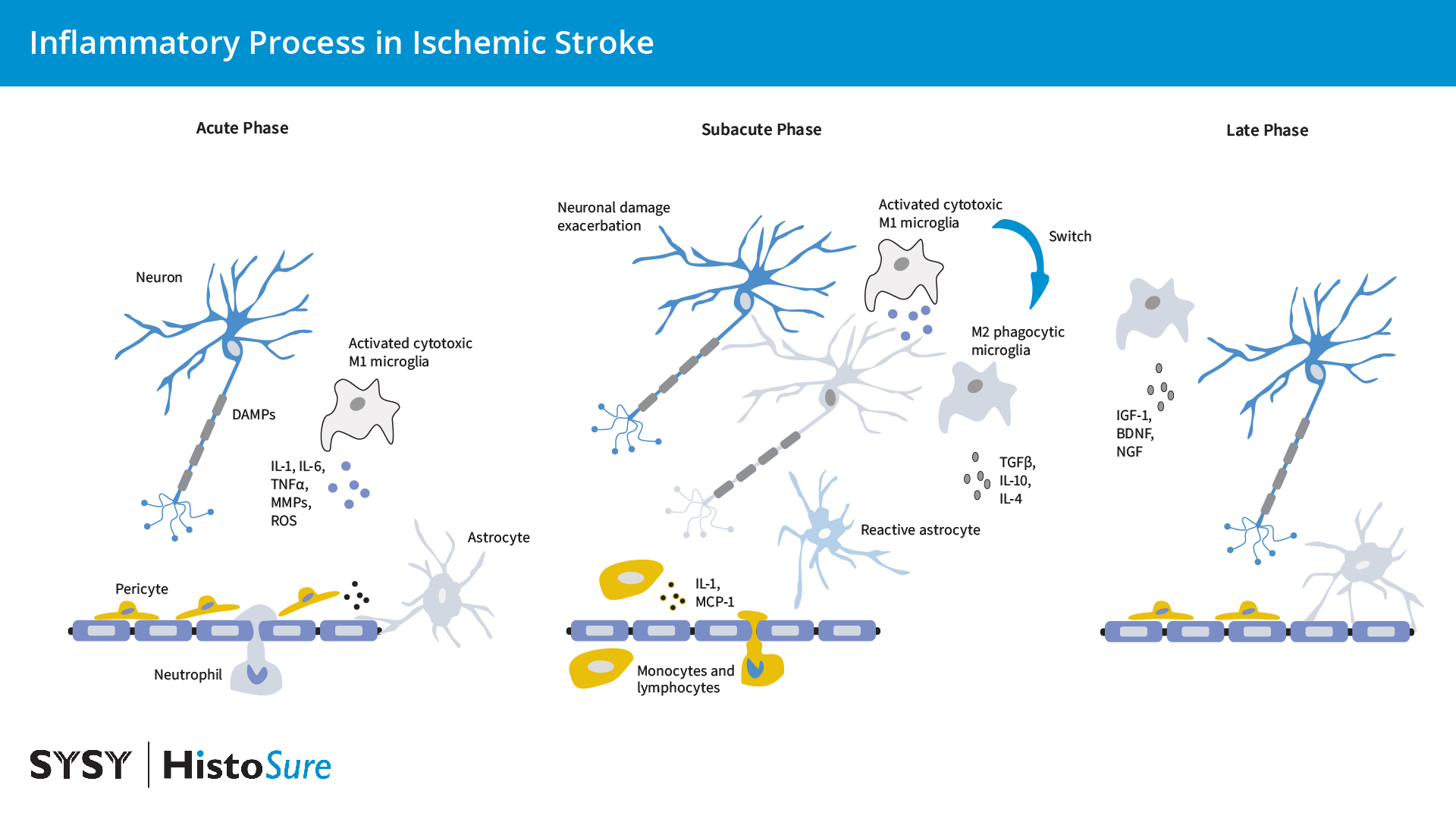
图18:缺血性脑中风中的炎症过程。改编自(Jurcau and Simion., 2022)。在缺血性中风刚发生后的急性期,受损的神经元会释放DAMPs,这导致小胶质细胞和内皮细胞的激活和中性粒细胞的浸润。细胞毒性小胶质细胞释放促炎白介素、MMPs和ROS,从而削弱血脑屏障。周细胞和星形细胞足突从血脑屏障基底膜上被抬起。在亚急性期,白细胞和单核细胞浸润通过“渗漏”的血脑屏障,在那里它们产生促炎因子并加剧神经元损伤。在亚急性晚期,小胶质细胞转变为吞噬型M2表型,并清除组织碎片。在后期,抗炎介质和神经营养因子的释放促进BBB修复、神经形成、星形胶质细胞形成、少突胶质细胞发生和血管生成。
作者:Christel Bonnas博士和Roser Ufartes
博士Christel和Roser在组织病理学方面有深厚的背景,致力于了解人类疾病的起源和发展,特别是免疫系统和癌症。他们负责我们的HistoSure癌症和免疫学产品线的抗体开发,验证和质量控制。
参考文献
Ahn et al., 2021. B Cells in Neuroinflammation: New Perspectives and Mechanistic Insights. PMID: 34206848
Alghamri et al., 2021. Targeting Neuroinflammation in Brain Cancer: Uncovering Mechanisms, Pharmacological Targets, and Neuropharmaceutical Developments. PMID: 34084145
Almolda et al., 2015. Alterations in microglial phenotype and hippocampal neuronal function in transgenic mice with astrocyte-targeted production of interleukin-10. PMID: 25449577
Angiulli et al., 2021. Blood-Based Biomarkers of Neuroinflammation in Alzheimer's Disease: A Central Role for Periphery? PMID: 34573867
Benmamar-Badel et al., 2020. Protective Microglial Subset in Development, Aging, and Disease: Lessons From Transcriptomic Studies. PMID: 32318054
Beschorner et al., 2007. Expression of EAAT1 reflects a possible neuroprotective function of reactive astrocytes and activated microglia following human traumatic brain injury. PMID: 17330806
Carr and Frings, 2019. Neuropeptides in sensory signal processing. PMID: 30377783
Chaney et al., 2021. PET Imaging of Neuroinflammation. doi: 10.1016/B978-0-12-816386-3.00047-8.
Chang et al., 2021. Divergent Functions of Tissue-Resident and Blood-Derived Macrophages in the Hemorrhagic Brain. PMID: 33840225
Chiareli et al., 2021. The Role of Astrocytes in the Neurorepair Process. PMID: 34113618
Constant et al., 2022. Role of Dendritic Cells in Viral Brain Infections. PMID: 35529884
Dahlmanns et al., 2023. Glial Glutamate Transporter-Mediated Plasticity: System xc-/xCT/SLC7A11 and EAAT1/2 in Brain Diseases. PMID: 37005761
Dermitzakis et al., 2023. CNS Border-Associated Macrophages: Ontogeny and Potential Implication in Disease PMID: 37232741
Escartin et al., 2021. Reactive astrocyte nomenclature, definitions, and future directions. PMID: 33589835
Figueiredo et al., 2022. The neuropeptide PACAP alleviates T. gondii infection induced neuroinflammation and neuronal impairment. PMID: 36403002
Finger et al., 2022. Age-related immune alterations and cerebrovascular inflammation. PMID: 34711943
Ganea et al., 2015. The neuropeptide vasoactive intestinal peptide: direct effects on immune cells and involvement in inflammatory and autoimmune diseases. PMID: 25422088
Garcia-Revilla et al., 2022. Galectin-3, a rising star in modulating microglia activation under conditions of neurodegeneration. PMID: 35859075
George et al., 2018. Extracellular Matrix and Traumatic Brain Injury. PMID: 29344975
Gerganova et al., 2022. CNS border-associated macrophages in the homeostatic and ischaemic brain. PMID: 35667516
Giles et al., 2018. CNS-resident classical DCs play a critical role in CNS autoimmune disease. PMID: 30226829
Haddadi et al., 2022. Aldolase C Profiling in Serum after Mild Traumatic Brain Injury: A Prospective Cohort Study. PMID: 35017775
Hall et al., 2014. Capillary pericytes regulate cerebral blood flow in health and disease. PMID: 24670647
Han and Jiang et al., 2020. Evolution of blood-brain barrier in brain diseases and related systemic nanoscale brain targeting drug delivery strategies. PMID: 34522589
Hao et al., 2010. Central nervous system (CNS)–resident natural killer cells suppress Th17 responses and CNS autoimmune pathology. PMID: 20696699
Higashino et al., 2009. Immunohistochemical analysis of brain lesions using S100B and glial fibrillary acidic protein antibodies in arundic acid- (ONO-2506) treated stroke-prone spontaneously hypertensive rats. PMID: 19657585
Hussain et al., 2021. Blood–Brain Barrier Breakdown: An Emerging Biomarker of Cognitive Impairment in Normal Aging and Dementia. PMID: 34489623
Jain et al., 2021. B cells in central nervous system disease: diversity, locations and pathophysiology. PMID: 34903877
Jäkel and Dimou, 2017. Glial Cells and Their Function in the Adult Brain: A Journey through the History of Their Ablation. PMID: 28243193
Jurcau and Simion, 2022. Neuroinflammation in Cerebral Ischemia and Ischemia/Reperfusion Injuries: From Pathophysiology to Therapeutic Strategies. PMID: 35008440
Jurga et al., 2020. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. PMID: 32848611
Kang et al., 2022. An update on Ym1 and its immunoregulatory role in diseases. PMID: 35967383
Kölliker-Frers et al., 2021. Neuroinflammation: An Integrating Overview of Reactive-Neuroimmune Cell Interactions in Health and Disease. PMID: 34158806
Liddelow et al., 2017. Reactive Astrocytes: Production, Function, and Therapeutic Potential. PMID: 28636962
Lima et al., 2022. Microglial Priming in Infections and Its Risk to Neurodegenerative Diseases. PMID: 35783096
Liu et al., 2021. NK Cells in Autoimmune Diseases: Protective or Pathogenic? PMID: 33777006
