蛋白质含量测定
美国科学家研究出一种简单的测试方法,通过检测血液中某些蛋白质的含量,就能发现患者身体对移植器官的排异反应。
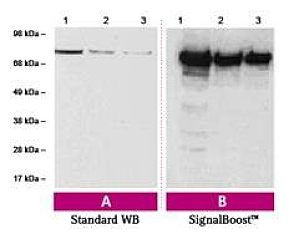
Western Blot、ELISA等实验是目前实验室最常用的检测蛋白量的实验方法。然而许多研究人员都会在这些实验过程中遇到背景过高或信号太弱等问题,影响了结果分析和实验进度。如何更好地解决实验中遇到的这些问题?许多研究者花费了大量的时间和经费优化实验条件以求得到更好的结果,结果却往往差强人意。
本文主要介绍了蛋白质浓度测定的另外两种方法:二奎啉甲酸(BCA)检测法和斑点滤膜结合法。
本文主要介绍了蛋白质浓度测定的几种方法。
使用EpochTM 微孔板分光光度计进行检测。和传统标准BCA方法(BCA工作缓冲液和蛋白质样品体积比为20:1)相比,该方法的蛋白检测灵敏度有明显的提高。相比与Mini-BCA分析方法,原位分析方法更加精确。
Bradford 方法基于考马斯亮蓝G-250 有红蓝两种不同的形式。在一定浓度的乙醇及酸性条件下,可配成淡红色的溶液,当与蛋白质结合后,产生蓝色化合物,反应迅速而稳定。反应化合物在465-595nm处有最大的光吸收值,化合物颜色的深浅与蛋白浓度的高低成正比关系,因此可检测595nm的光吸收值的大小计算蛋白的含量。
Bradford 的dye-binding method 是利用Coomassie brilliant blue G-250 (CBG) 可与蛋白质结合而变色的特性来定量。(Bradford, 1976);若试样中的蛋白质量较多,则结合到蛋白质而变色的CBG 也多,因而呈色较深。下例是以一组标准蛋白质为对象,制作一条蛋白质量与吸光度的标准校正线。
酶活性分析法检定蛋白质:表现出来的酶GUS可以水解其基质衍生物pNPG,所产生的黄色生成物p-nitrophenol,可供活性测定 (Jefferson et al, 1986);
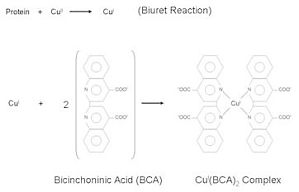
该方法是双缩脲法的发展,包括两步反应:(1)在碱性条件下,蛋白质与铜作用生成蛋白质—铜络合物。(2)此络合物将试剂磷钼酸—磷钨酸(FolIn试剂)还原,混合物深蓝色(磷钼蓝和磷钨蓝混合物),颜色深浅与蛋白质含量成正比。此方法操作简便,灵敏度比双缩脲法高100倍,定量范围为5~100μg蛋白质。FolIn试剂显色反应由酪氨酸、色氨酸、半胱氨酸引起,因此样品中若含有酚 ...
LoWry法是双缩脲法(BIureT)和福林酚法(Folin-酚)的结合与发展。其原理是蛋白质溶液用碱性铜溶液处理后,碱性铜试剂与蛋白质中的肽键作用产生双缩脲反应,形成铜—蛋白质的络合盐。再加入酚试剂后,在碱性条件下,这种被作用的蛋白质上的酚类基团极不稳定,很容易还原酚试剂中的磷钨酸和磷钼酸(PHosPHoMolyBdATe & PHosPHoTungsTATe),使之生成磷钨蓝和磷钼蓝的混合物。这种溶液蓝色的深浅与蛋白的含量成正相关,所以可以用于蛋白质含量的测定。LoWry法除使肽链中酪氨酸、色氨酸和半胱氨酸等显色外,还使双缩脲法中肽键的显色效果更强烈,其显色效果比单独使用酚试剂强3~15倍,约是双缩脲法的100倍。由于肽键显色效果增强,从而减少了因蛋白质种类不同引起的偏差。LoWry法适于微量蛋白的测定,对多个样品同时测定较为方便。但对不溶性蛋白和膜结合蛋白必须进行预处理(如加入少量的SDS)。
一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。 ...
一)实验原理 这种蛋白质测定法是最灵敏的方法之一。过去此法是应用最广泛的一种方法,由于其试剂乙的配制较为困难(现在已可以订购),近年来逐渐被考马斯亮兰法所取代。此法的显色原理与双缩脲方法是相同的,只是加入了第二种试剂,即Folin—酚试剂,以增加显色量,从而提高了检测蛋白质的灵敏度。这两种显色反应产生深兰色的原因是:在碱性条件下,蛋白质中的肽键与铜结合生成复合物。Folin&mdas ...
紫外吸收法测定蛋白质/DNA浓度的最大特点就是操作简单、测量迅速,而且不需要引入试剂;但是它也面临着很多问题,诸如测量准确性的问题。本节将讨论影响测定的一些主要因素。 (1)蛋白质的不同对测定结果的影响。 由于蛋白质是生物大分子,而紫外吸收往往是其分子内的小基团所引起的,例如酪氨酸、苯丙氨酸,色氨酸和肽键等等。因此当蛋白质不同,其包含的上述小基团含量发生变化时,就会影响蛋白质含量的测定。然而蛋白质 ...
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。 紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH ...
蛋白质分子中含有共轭双键的酪氨酸、色氨酸等芳香族氨基酸。它们具有吸收紫外光的性质,其吸收高峰在280nm波长处,且在此波长内吸收峰的光密度值与其浓度成正比关系,故可作为蛋白质定量测定的依据,但由于各种蛋白质的酪氨酸和色氨酸的含量不同,故要准确定量,必需要有待测蛋白质的纯品作为标准来比较,或且已经知道其消光系数作为参考。另外,不少杂质在280nm波长下也有—定吸收能力,可能发生干扰。其中 ...
1、凯氏定氮法仍然是建立各个具体方法时采用的参考标准方法。 2、双缩脲比色法是目前首先推荐的蛋白质定量方法。方法操作简便,虽然双缩脲试剂有大同不异。其中酒石酸钾纳可以稳定在碱性溶液中的铜离子,含有碘化物作为抗氧化剂。双缩脲反应生成的复合物其吸收峰为540nm。可采用公认的标准牛血清白蛋白作为标准品,经精确称量,必要时用凯氏定氮法标定。各地质控中心提供的混合标准血清可作为第二参考,血清用量100&m ...
Considerations for use The Bradford assay is very fast and uses about the same amount of protein as the Lowry assay.It is fairly accurate and samples that are out of range can be retested within minut ...
Considerations for use The principle of the biuret assay is similar to that of the Lowryhowever it involves a single incubation of 20 min.There are very few interfering agents (ammonium salts being on ...
Considerations for use The bicinchoninic acid (BCA)assay is available in kit form from Pierce (RockfordIll.).This procedure is very applicable to microtiter plate methods.The BCA is used for the same ...
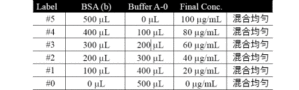
主要特点: · 准确灵敏:BCA试剂的蛋白质测定范围是20-2000μg/ml采用加强方法可检测到5μg/ml;MicroBCA试剂测定范围是0.5-20μg/ml。 · 快速:45分钟内完成测定,比经典的Lowry法快4倍而且更加方便。 · 经济实用:除试管外,测定可在微孔板中进行,大大节约样品和试剂用量。 · 不受样品 ...