蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收高峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。 紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如生化制备中常用的(NH ...
蛋白质分子中含有共轭双键的酪氨酸、色氨酸等芳香族氨基酸。它们具有吸收紫外光的性质,其吸收高峰在280nm波长处,且在此波长内吸收峰的光密度值与其浓度成正比关系,故可作为蛋白质定量测定的依据,但由于各种蛋白质的酪氨酸和色氨酸的含量不同,故要准确定量,必需要有待测蛋白质的纯品作为标准来比较,或且已经知道其消光系数作为参考。另外,不少杂质在280nm波长下也有—定吸收能力,可能发生干扰。其中 ...
1、凯氏定氮法仍然是建立各个具体方法时采用的参考标准方法。 2、双缩脲比色法是目前首先推荐的蛋白质定量方法。方法操作简便,虽然双缩脲试剂有大同不异。其中酒石酸钾纳可以稳定在碱性溶液中的铜离子,含有碘化物作为抗氧化剂。双缩脲反应生成的复合物其吸收峰为540nm。可采用公认的标准牛血清白蛋白作为标准品,经精确称量,必要时用凯氏定氮法标定。各地质控中心提供的混合标准血清可作为第二参考,血清用量100&m ...
1、蛋白质样品的特征: 复杂,含盐或其他污染物 易被蛋白酶降解 动态范围宽(>X106) 溶解性不均一(疏水性/亲水性) 分子量、等电点的范围宽(10-500KDa,pH2-14) 2、样品分离的基本要求: 高灵敏度和分辨率 宽动态范围 小样品体积 高通量 合适的温度和pH 避免蛋白酶降解 适合与高灵敏度的质谱联用 尽量少的操作步骤减少污染和损失 3、样品缓冲液的组成: 3.1 尿素:一种中 ...
A. 实验过程 一、实验原理: 2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。这样就可以得到蛋白质等电点和分子量的信息。 二、实验步骤: 1.样品的溶解 取纯化后的晶体蛋白3.0mg,加入300μl裂解液(1mg蛋白:100μl裂解液)振荡器上振荡10min左右,共处理一个小时。其中每隔10~ ...
(一)第一向等电聚焦 1.从冰箱中取-20℃冷冻保存的水化上样缓冲液(I)(不含DTT,不含Bio-Lyte)一小管(1ml/管),置室温溶解。 2.在小管中加入0.01g DTT,Bio-Lyte 4-6、5-7各2.5ml,充分混匀。 3.从小管中取出400ml水化上样缓冲液,加入100ml样品,充分混匀。 4.从冰箱中取-20℃冷冻保存的IPG预制胶条(17cm pH 4-7),室温中放置1 ...
电泳法,是指带电荷的供试品(蛋白质、核苷酸等)在惰性支持介质(如纸、醋酸纤维素、琼脂糖凝胶、聚丙烯酰胺凝胶等)中,于电场的作用下,向其对应的电极方向按各自的速度进行泳动,使组分分离成狭窄的区带,用适宜的检测方法记录其电泳区带图谱或计算其百分含量的方法。 电泳技术的基本原理和分类 在电场中,推动带电质点运动的力(F)等于质点所带净电荷量(Q)与电场强度(E)的乘积。F=QE质点的前移同样要受到阻力( ...
几乎所有蛋白质电泳分析都在聚丙烯酰胺凝胶上进行,而所有条件总要确保蛋白质解离成单个多肽亚基并进可能减少其相互间的聚集,最常用的就是SDS-PAGE电泳技术,关于大家在此过程中经常遇到的问题进行一些讨论:Q:SDS-PAGE电泳的基本原理?A:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠), SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多 ...
问 题 可能原因 建议解决方法 推荐电压条件下电泳时间过 ...
二维聚丙烯酰胺凝胶电泳技术结合了等电聚焦技术(根据蛋白质等电点进行分离)以及SDS-聚丙烯酰胺凝胶电泳技术(根据蛋白质的大小进行分离)。这两项技术结合形成的二维电泳是分离分析蛋白质最有效的一种电泳手段。 通常第一维电泳是等电聚焦,在细管中(φ1~3 mm)中加入含有两性电解质、8M的脲以及非离子型去污剂的聚丙烯酰胺凝胶进行等电聚焦,变性的蛋白质根据其等电点的不同进行分离。而后将凝胶从管中取 ...
电泳法,是指带电荷的供试品(蛋白质、核苷酸等)在惰性支持介质(如纸、醋酸纤维素、琼脂糖凝胶、聚丙烯酰胺凝胶等)中,于电场的作用下,向其对应的电极方向按各自的速度进行泳动,使组分分离成狭窄的区带,用适宜的检测方法记录其电泳区带图谱或计算其百分含量的方法。 电泳技术的基本原理和分类 在电场中,推动带电质点运动的力(F)等于质点所带净电荷量(Q)与电场强度(E)的乘积。F=QE质点的前移同样要受到阻力( ...
免疫共沉淀和亲和层析共分离: 免疫共沉淀是证明蛋白质-蛋白质相互作用的最直接最经典和最有效的方法,如蛋白A能与B相互作用结合成异源二聚体,无论用抗A或抗B的抗体或与A或B的亲和物偶联的agarose小珠都能把A和B沉淀下来。因此广泛用于蛋白质相互作用研究。 常用的小珠: GST-Agarose(不需要抗体) ProteinA-Agarose(用时需加抗体) 基本方法: 1.表达蛋白质A 2.蛋白质 ...
亲和层析(Affinity ChromatographyAC)是利用偶联亲和配基的亲和吸附介质为固定相亲和吸附目标产物使目标产物得到分离纯化的液相层析法。亲和层析已经广泛应用于生物分子的分离和纯化如结合蛋白、酶、抑制剂、抗原、抗体、激素、激素素受体、糖蛋白、核酸及多糖类等;也可以用于分离细胞、细胞器、病毒等。 亲和层析技术的最大优点在于.利用它可以从粗提物中经过一些简单的处理便可得到所需的高纯度活 ...
本实验利用超氧化物歧化酶的解离性质,在一定缓冲液条件下与离子交换纤维素吸附和解吸的能力不同于溶液中杂蛋白,进而除去杂蛋白。实验中选用DE-32离子交换纤维素。相关原理请参见实验教材中离子交换层析一章。 1、试剂 (1)DE-32 (2)缓冲液Ⅰ:2.5mmol/L K2HPO4-KH2PO4(pH7.6) (3)缓冲液Ⅱ:200mmol/L K2HPO4-KH2PO4(pH7.6) 2、器 ...
采用离子交换柱纯化蛋白时,洗脱采用的离子强度的大小范围应该如何确定,可以根据什么来调整洗脱时的离子强度? 离子交换纯化是利用离子交换剂上的可解离基团(活性基团)对各种离子的亲和力不一样人达到分离的目的的一种分离技术。离子交换剂是含有若干活性基团的不溶性物质,即在不溶性母体上引入若干可解离基团而成,根据引入解离基团的不同,可以分为阳离子交换剂和阴离子交换剂。各种离子对离子交换剂的亲和力各不相同,亲和 ...
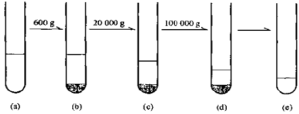
离心技术的类型 最大速度方法 (1)移动界面超速离心法 含几个组分的样品在足够高的离心场中离心时,每种颗粒都达到其最大沉降速度,这时样品开始分离。离心管的上层逐渐形成透明的上清液,并形成对应于样品各组分的一系列浓度界面,界面的移动相对于每种组分来说是特征的。 虽然利用这种方法不一定能实现组分的纯化分离,但可以通过监测界面的移动来测定各组分的沉降速度。要想实现组分间的分离,必须在所需样品沉降之后停止 ...
离心是蛋白质、酶、核酸及细胞亚组分分离的最常用的方法之一,也是生化实验室中常用的分离、纯化或澄清的方法。尤其是超速冷冻离心已经成为研究生物大分子实验室中的常用技术方法。 离心机(centrifuge)是实施离心技术的装置。离心机的种类很多,按照使用目的,可分为两类,即制备型离心机和分析型离心机。前者主要用于分离生物材料,每次分离样品的容量比较大,后者则主要用于研究纯品大分子物质,包括某些颗粒体如核 ...
简介 离子交换层析(Ion Exchange Chromatography简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。1848年,Thompson等人在研究土壤碱性物质交换过程中发现离子交换现象。本世纪40年代,出现了具有稳定交换特性的聚苯乙烯离子交换树脂。50年代,离子交换层析进入生物化学领域,应用于氨 ...
SephadexG-10葡聚糖凝胶 G-10 分离范围<700 适用于脱盐、肽与其它小分子的分离 Sephadex G-15 葡聚糖凝胶 G-15 分离范围<1500 适用于脱盐、肽与其它小分子的分离 Sephadex G-15 葡聚糖凝胶 G-15 分离范围<1500 适 ...
生物分子下游纯化的对象一般包括蛋白、酶、重组蛋白、单抗、抗体及抗原、肽类、病毒、核酸等。纯化前首先需要测定生物分子的各物理和化学特性,然后通过实验选择出最有效的纯化流程。 1.测定------分子量、PI 当目标蛋白的物理特性如分子量、PI等都不清楚时,可用PAGE电泳方法或层析方法加以测定。分离范围广阔的Superose HR预装柱很适合测定未知蛋白的分子量。用少量离子交换介质在多个含不同PH缓 ...