相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
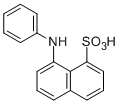
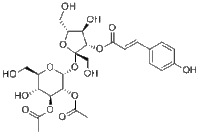
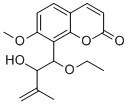
- 详细信息
- 文献和实验
- 技术资料
- 保存条件:
室温,12个月
- 保质期:
12个月
- 库存:
100
- 供应商:
上海研生
- 规格:
100ml
特点:
1、采用全进口原料:高效、灵敏、特异,严格引进国际技术标准进行批量。
2、先进的优化方案:重复性高,可靠性强,效果稳定。
3、购买本公司的溶液,提供免费代测技术服务的,有技术疑问可以提供一对一的解答,存在质量问题可申请退换。
4、技术服务:专业,及时,耐心。
标准溶液配制:
1。先將PH7.00同PH4.00藥粉分別倒入250毫升蒸餾水中,充分溶解,用兩支玻璃瓶密封保存,做 好標簽。
2 。在校正前,準備ORP標準溶液。
3 。86毫伏:取50至100毫升PH7.00標準溶液置入一玻璃杯中,再加入稍許醌氫醌,充分攪拌。
4 。256毫伏:取50至100毫升PH4.00標準溶液置入一玻璃杯中,再加入稍許醌氫醌,充分攪拌。 5。 ORP標準液保存期為72hour。
注意事项:
1.根据实验具体要求操作,以说明书为准。
2.一般植物细胞筛选浓度在20~200μg/ml,动物细胞筛选浓度50~1000μg/ml,应根据具体实验选择最佳筛选浓度。
3.做好预防颠倒,摔坏的措施和管理体制。
4.必须戴好防护用具,小心翼翼进行操作。
5.购买试剂时要想到一次性用完。若估算不足有剩余的话,要更加注意其保管和管理。
6.对于使用后的废弃物,不要或旧的试剂,应按照相关法律法规正当处理。
使用方法:
1. 常用筛选浓度
注意:用来筛选稳转株的工作浓度需要根据细胞类型,培养基,生长条件和细胞代谢率而变化,推荐使用浓度为50-1000μg/mL。对于第一次使用的实验体系建议通过建立杀灭曲线(kill curve),即剂量反应性曲线,来确定最佳筛选浓度。
一般而言,哺乳动物细胞50-500μg/mL;细菌/植物细胞20-200μg/mL;真菌300-1000μg/mL。
2. 杀灭曲线的建立
注意:为了筛选得到稳定表达目的蛋白的细胞株,需要确定能够杀死未转染宿主细胞的抗生素最低浓度,可通过建立杀灭曲线(剂量反应曲线)来实现,至少选择5个浓度。
1) 第一天:未转化的细胞按照20-25%的细胞密度铺在合适的培养板上,37℃,CO2培养过夜;注:对于需要更高密度来检测活力的细胞,可增加接种量。
2) 根据细胞类型,设定合适范围内的浓度梯度。以哺乳动物细胞为例,可设定50,100,250,500,750,1000μg/mL。先用去离子水或者PBS buffer按照1:10的比例将母液稀释到5 mg/ml,然后按照下表稀释到相应浓度的工作液。
3) 第二天:替换旧的培养基,换用新鲜配制的含有相应浓度药物的培养基。每个浓度做三个平行孔。
4) 接下来每3-4天更换新的含药物培养基。
5) 按照固定的周期(如每2天)进行活细胞计数来确定阻止未转染细胞生长的恰当浓度。选择在理想的天数(通常是7-10天)内能够杀死绝大多数细胞的最低浓度为稳定转染细胞筛选用的工作浓度。
3. 稳定转染细胞的筛选
1) 转染48h后,用含有适当浓度的潮霉素B筛选培养基来传代细胞(直接传代或者稀释后传代)。
注意:细胞处于活跃分裂状态时抗生素的杀伤效果最好。则当细胞过于稠密,其效率会降低。为了得到较好的筛选效果,最好将细胞稀释至丰度不超过25% 2) 每隔3-4天更换含有药物的筛选培养液。
3) 筛选7天后观察并评估细胞克隆(集落)的形成情况。集落的形成可能还需要一周或者更多的时间,这取决于宿主细胞类型,转染,以及筛选效果。 4) 挑取并转移5-10个抗性克隆于35mm细胞培养板,继续用含药物的筛选培养液维持培养7天。
5) 之后更换正常培养基培养即可。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验0.25%(W/V)考马斯亮蓝G溶液2.5ml,加12.%(W/V)三氯醋酸溶液至10ml。 (6)稀染色液 取上述染色液2ml,加12.5%(W/V)三氯醋酸溶液至10ml。 (7)脱色液 7%醋酸溶液。 3.操作法 (1)制胶 取溶液A2ml,溶液B5.4ml,加尿素2.9g使溶解,再加水4ml,混匀,抽气赶去溶液中气泡,加0.56%过硫酸铵溶液2ml,混匀制成胶液,立即用装有长针头的注射器或细滴管将胶液沿管壁加至底端有橡皮塞的小玻璃管(10×0.5cm)中,使胶层高度达6~7cm
,分子又立即得到正电荷或负电荷,从而又向pI迁移。因此,这些分子总会是处于不断扩散和抗扩散的平衡中,在pI处得以“聚焦”. 二、仪器与试剂 1.材料:蛋白样品 2.试剂: 聚丙烯酰胺、甲乙聚丙烯酰胺、两性电解质、尿素、NP-40、teiton-100 电极液:1M磷酸(阳极液)、1M氢氧化钠(阴极液) 固定液:100g三氯乙酸、10g磺基水杨酸溶于500ml,定容为1000ml 染色液:0.35g考马斯亮蓝R-150溶于300ml脱色液中,加热到60-70℃,加入0.3g
完整蛋白质从 SDS-PAGE 胶中的电洗脱及其 MALDI-TOF MS 分析
地降低电洗脱过程中的蛋白质产率(表 27-2 和 图 27-2)。以 BSA 为例,我们发现其产率降低了 30%。固定处理导致的产率损失似乎对大分子质量蛋白质的作用更剧烈。对于磷酸酶 B 来说,当凝胶经过固定后蛋白质回收率下降了 89%。因此,去掉固定凝胶步骤对于从 SDS-PAGE 凝胶中回收的完整蛋白质有益。如果可能,应使用非固定的考马斯亮蓝染色。已有一些市售的基于考马斯亮蓝的胶体染色液,它们具有很好的灵敏度,而且对蛋白质没有或仅有很少的固定作用。这些染色液包括 Qbiogen 公司生产
 技术资料
技术资料暂无技术资料 索取技术资料