相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 库存:
999
- 英文名:
详细见优宁维
- CAS号:
详细见优宁维
- 保质期:
详细见优宁维
- 供应商:
absin
- 保存条件:
本试剂盒4℃保存,1年有效
- 规格:
50T
产品规格:50tests
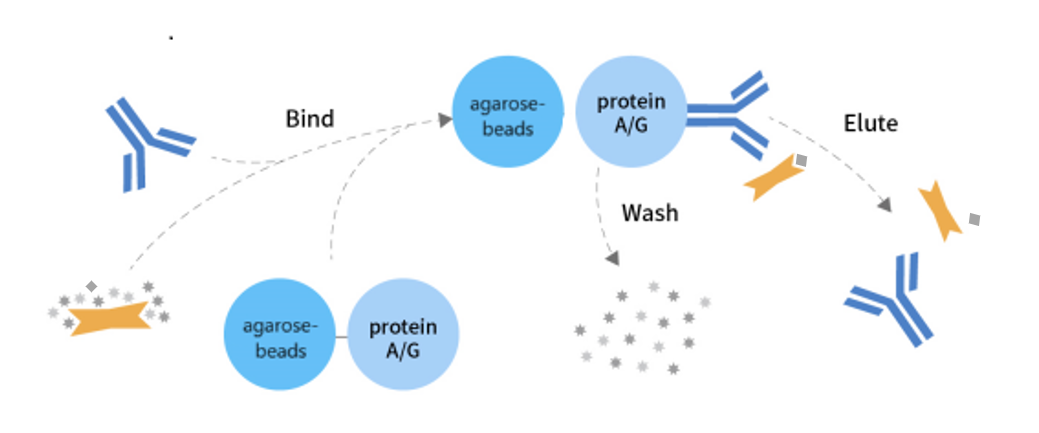
免疫(共)沉淀(IP/CoIP)试剂盒是基于抗体和蛋白的特异性亲和作用开发,通过捕获与蛋白或抗原特异性结合的抗体,进而从复杂的样品中捕获及富集目标蛋白,同时可以测定与之相互作用的蛋白或其它生物大分子。
实验前:为了获得更好的实验结果,所有的步骤均需要根据实际情况进行优化。
例如:根据细胞系或被捕获的抗原后续用途的不同可选择更加合适的细胞裂解条件。对于没有细胞壁结构的哺乳动物细胞,可以直接使用去污剂进行裂解,但其它细胞,则需要一些机械剪切力辅助,例如超声破碎。以下列出的(包括裂解液、孵育时间、体积及浓度)是作为初始尝试的条件建议,最终的优化需要根据实际情况调整。
另外,细胞裂解物在进行免疫(共)沉淀前,可先进行蛋白免疫印迹法检测,以此来确定细胞裂解物里存在目标蛋白。
一、试剂盒组分
| 试剂名称 | 体积 | 保存条件 |
| Lysis buffer | 30ml | 4 ℃ |
| 10*Wash buffer | 50ml | 4 ℃ |
| 1*SDS 样品缓冲液 | 1ml*2 | 4 ℃ |
| Protein A 琼脂糖珠 | 250ul | 4 ℃ |
| Protein G 琼脂糖珠 | 250ul | 4 ℃ |
A. 制备细胞裂解物
1. 吸干培养基。添加含有调节分子的新鲜培养基,使其在预定的时间内对细胞进行处理。
2. 收集细胞,去除培养基后用冰预冷的 1 X PBS 洗涤细胞一次。
3. 去除 PBS 并在每个细胞板上(10 cm)加入 0.5 ml 冰预冷的 Lysis buffer,并在冰上孵育至少5分钟。
4. 从板上刮下细胞,把提取物转移至微量离心管。置于冰上。
5. 在冰上进行 3 次超声破碎,每次 5 秒。(PS:超声条件需根据液体量、探头直径以及最大功率调整。以200W功率超声仪器为例,用 3 mm 的探头。我们一般推荐使用 35%-40% 的最大功率进行 3 次超声脉冲, 每次超声之间停顿 10 秒。)
6. 在 4 °C,在 14,000 x g 条件下,微量离心10分钟,将上清转移到新管中。上清液即为细胞裂解物。如有必要,裂解物可保存在 -80 °C。
注:细胞裂解物制备好之后,可先进行蛋白免疫印迹法检测,以此来确定细胞裂解物里存在目标蛋白。
B. 免疫沉淀法
a) 细胞裂解物预清除(可选步骤)
1. 向 500 μl(含总蛋白 200 -1000 ug)细胞裂解物中添加 5 μl Protein A 和 5 μl Protein G。
2. 在 4 °C 下,旋转孵育 30 - 60 分钟。
3. 4°C 条件下 12000g 离心1分钟,保留上清,待用。
b) 抗原抗体结合
1. 在新的离心管内加入 500 μl (含总蛋白 200 – 1000 ug)细胞裂解物(可以是预清洗后的细胞裂解物)。
2. 加入目标蛋白的单克隆/多克隆抗体(1 – 5 μg)。
3. 同时采用非特异免疫的同源抗体作为对照。
4. 在 4 °C 轻柔混合过夜。
c) 免疫复合物沉淀
1. 抗体孵育过夜后,加入 5 μl Protein A 和 5 μl Protein G。
2. 在 4 °C 温和地混匀1- 3小时或过夜。
3. 12,000 g 离心1 分钟,保留沉淀。
4. 使用 0.5 ml 1*Wash buffer 清洗沉淀,12,000 g 离心1分钟,保留沉淀。
5. 重复第4步,共计清洗3次。
注:清洗,去上清的时候需要注意避免吸走填料
C. 用蛋白免疫印迹法进行分析
1. 在 20 - 40 μl 1*SDS 样品缓冲液中重悬沉淀物,涡旋振荡,然后再微量离心30秒,以使附着管壁的珠子和液体到管底。
2. 将样品加热至 95 - 100 °C 并持续2 - 5分钟,然后在 14,000 g下瞬时离心1分钟,取上清液。
3. 将样品(15 – 30 μl)上样到 SDS-PAGE 凝胶上。
4. 用蛋白质印迹法分析样品。
注意:Protein A和Protein G的基质为20%乙醇,较易挥发,使用时应注意密封,如出现挥发情况,可使用20%乙醇重悬。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验最近 WB 的结果趋势不是很理想,因为给了蛋白 B 的抑制剂蛋白 B 却没有明显变化。于是大伙儿一合计,可能需要再看看蛋白质之间的相互作用,会不会是抑制剂影响了蛋白 B 和蛋白 C 之间的结合,而不是直接导致蛋白 B 的降解。大家都知道研究蛋白质相互作用的三大经典方法是:酵母双杂交(Y2 H),免疫共沉淀(CoIP)和 GST pulldown。结合我们课题组的这个实验,因为只需看看蛋白 B 和 C 之间的结合,而且已知蛋白 B 和 C 是会结合的,所以可能用 CoIP 最简便。那么问题
相关专题 免疫沉淀(IP)是一种利用的抗原 抗体反应的原则,确定具体反应中混合物的抗体蛋白数量及具体物理特性的方法。而免疫共沉淀(Co-IP) 则作为分析蛋白质间的相互作用而被广泛认知。下面是这两种实验方法的具体操作步骤。 Steps of IP: 1. Form the antigen-antibody complex (immune complex) by incubating specific antibody
序列的相互作用;从研究一个目的蛋白与DNA的相互作用,发展到研究两个蛋白与DNA共同结合的相互作用;从研究启动子区域的组蛋白的修饰,发展到研究结合在DNA序列上的蛋白复合物。随着对基因功能研究的不断深入,这项技术正越来越多的被应用于科研的各个领域。目前已经有成熟的ChIP试剂盒出售,如Millipore公司提供的EZ-ChIP试剂盒,使得越来越多的研究者更容易地采用染色质沉淀技术在许多研究领域取得了成功。ChIP技术的原理染色质免疫沉淀技术的原理是:在生理状态下把细胞内的DNA与蛋白质交联
 技术资料
技术资料暂无技术资料 索取技术资料