相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 库存:
100
- 国食药监械注册号:
无
- 保修期:
12个月
- 现货状态:
大鼠面部测痛固定器,大鼠三叉神经刺痛仪
- 供应商:
玉研仪器公司
玉研仪器深耕动物实验领域14年,深入研究不同体重大小鼠体型,定制开发尾静脉注射或取血专用固定器,优选多种材质可选,做工精良不易磨损,款式众多操作方便,一推一旋,动物即可完美固定,独特注射预留口,腹腔注射,皮下注射方便易操作,动物舒适不挣扎,大小尺寸可根据客户需求定制,适合不同动物和实验。
大鼠面部测痛实验固定器
可用于大鼠的面部、背部、腹部的刺痛实验;
可根据老鼠的体重订做合适的尺寸;

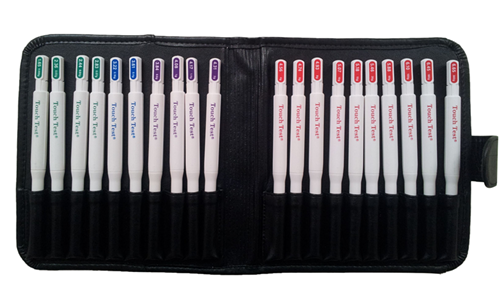
根据实验需要,可选择Von Frey纤毛机械刺激针 进行触觉测试实验:
Von Frey纤毛机械刺激针Von Frey Hairs(Von Frey test触觉测量套件Von Frey filaments, Touch Test,纤维丝疼痛测试仪,纤维丝刺激针套件,触觉感应测量套装,纤毛机械刺激针Von Frey Hairs20根套装)
Von Frey纤毛机械刺激针Von Frey Hairs是由20根Von Frey Hairs纤毛机械刺激针组成,英文中称为Von Frey filaments 或 Semmes-Weinstein monofilaments,主要用于von Frey test评估皮肤的机械痛阈或触觉阈测量 ,是非常受欢迎的非侵入式实验器材。
Von Frey纤毛机械刺激针可提供0.008g-300g的触觉刺激力。(进行von Frey test使用方便,可对多种动物进行定量的机械痛阈或触觉阈测量,敬请来电咨询)
如需进行大小鼠的足底测痛实验,可选择凿孔实验台:
可配合测试支架和大小鼠测试笼,对动物足底进行测试:大小鼠触觉测试笼(老鼠足底触觉痛觉测试凿孔台)
包含凿孔台和鼠笼两部分,凿孔台又均匀分布、由激光切割的多孔板支架制作,光滑平整,对老鼠足底没有额外的刺激;
鼠笼为全透明亚克力材质,上下通气,利于实验人员观察的同时,也给老鼠营造了一个安全舒适的测试环境。

小鼠与测试平台

小鼠与测试平台

十字测试网格

加高型测试支架

标准型测试支架与电子式测痛仪
根据需求,可以配合45°倾角的镜子使用,让观察更加方便;

还可以根据需要,选择面部疼痛评估仪:
大小鼠面部疼痛评估仪采用创新的方法,基于自愿行为的疼痛评估操作系统,允许对热刺激或机械刺激进行测试。
大鼠或小鼠在标准的笼子里接受训练和测试,口鼻通过特制的开口来舔奖励瓶,老鼠会在接触到热刺激垫片或机械刺激探针的时候被刺痛。
动物在诱导过敏的治疗后(如三叉神经结扎或注射)进行测试,以确定治疗对喂养行为和奖励的影响。受试敏感性(通过局部和全身施用止痛药,由炎症引起的喂养行为下降和超敏反应逆转)喂食行为与机械或热刺痛动物的口面部伤害感受密切相关,因为动物必须接触刺激物才能获得食物奖励。设备可以比较治疗组与未治疗组之间的表现,以及不同疾病之间和病变组之间的表现来做成评估和分析。

型号:31300
热刺激器或机械刺激器安装在刺激/检测模块上,该模块还包括饮水瓶,配套管路和传感器。
刺激/检测模块安装在标准饲养笼具中
· 口面部刺激测试仪通过软件测量和记录断束次数和持续时间(包括最小值、最大值和平均值)来量化进食行为;
· 可同时从多达16个笼子中获取数据;
· 测试数字实时显示,可以图形格式显示;
· 数据可根据时间轴分析,可查阅16个通道中的一个通道;
· 所有测试结果可以表格的形式提供,可以使用其他程序中进一步分析;
软件测试界面
· 热刺激器使用循环水浴系统进行温度控制,温控范围从室温到70°C,达到热伤害阈值。
· 更换不同的适配器来切换测试大鼠和小鼠;
· 机械刺激器在测试孔两侧安装有金属刺激丝。该模块配有几个测试,每个测试上有不同数量的金属刺激丝,以便对动物施加不同的刺激力度。
用于热刺激和机械刺激的面部刺激适配器套件
“评估口面部、热刺激和机械刺激敏感性的系统和方法”(美国临时专利申请61/235590)出自费伦巴赫,亨利和哈格里夫斯,位于圣安东尼奥大学哈 格里夫斯博士实验室,并由Ugo Basile研发部进行商业开发。费伦巴赫博士现在在IUPUI。
部分应用文献:
l K. Thibault et alia: “Orofacial Neuropathic Pain Leads to a Hyporesponsive Barrel Cor-tex with Enhanced Structural Synaptic Plasticity” PlosOne 0160786, 2016
l Q. Zhang et alia: “Chemokine CXCL13 Mediates Orofacial Neuropathic Pain via CXCR5/ERK Pathway in the Trigeminal Ganglion of Mice“ J. Neuroinflammation 183: 2-13, 2016
l A.A. Abd-Elsayed et alia: “KCNQ channels in nociceptive cold-sensing trigeminal gan-glion neurons as therapeutic targets for treating orofacial cold hyperalgesia” Molecular Pain 45: 2-11, 2015
l M. Prochazkova et alia: “Activation of Cyclin-Dependent Kinase 5 Mediates Orofacial Mechanical Hyperalgesia” Molecular Pain 9:66: 1-12, 2013
l X.Z. Zuo et alia: “Operant Behavioral Responses to Orofacial Cold Stimuli in Rats with Chronic Constrictive Trigeminal Nerve Injury: Effects of Menthol and Capsazepine” Molecular Pain 28: 2-8, 2013
l M. Cha et alia: “Assessment of Chronic Trigeminal Neuro¬pathic Pain by the Orofacial Operant Test in Rats” Behav. Brain Research
234: 82-90, 2012




敬请来电咨询

风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验· K. Thibault et alia: “Orofacial Neuropathic Pain Leads to a Hyporesponsive Barrel Cor-tex with Enhanced Structural Synaptic Plasticity” PlosOne 0160786, 2016
· Q. Zhang et alia: “Chemokine CXCL13 Mediates Orofacial Neuropathic Pain via CXCR5/ERK Pathway in the Trigeminal Ganglion of Mice“ J. Neuroinflammation 183: 2-13, 2016
· A.A. Abd-Elsayed et alia: “KCNQ channels in nociceptive cold-sensing trigeminal gan-glion neurons as therapeutic targets for treating orofacial cold hyperalgesia” Molecular Pain 45: 2-11, 2015
· M. Prochazkova et alia: “Activation of Cyclin-Dependent Kinase 5 Mediates Orofacial Mechanical Hyperalgesia” Molecular Pain 9:66: 1-12, 2013
· X.Z. Zuo et alia: “Operant Behavioral Responses to Orofacial Cold Stimuli in Rats with Chronic Constrictive Trigeminal Nerve Injury: Effects of Menthol and Capsazepine” Molecular Pain 28: 2-8, 2013
· M. Cha et alia: “Assessment of Chronic Trigeminal Neuro¬pathic Pain by the Orofacial Operant Test in Rats” Behav. Brain Research 234: 82-90, 2012
,如果小鼠挣扎,有可能弄破尾端。 在进行解剖、手术、心脏采血、尾静脉注射时,可将小鼠用线绳捆绑在木版上,或固定在尾静脉注射架及粗试管中。 引自:Victoria solberg:Laboratory manual for animal technicians 二、大鼠的抓取保定 抓取大鼠前最好戴上防护手套,右手轻轻抓住大鼠尾巴的中部并提起,迅速放在笼盖上或其他粗糙面上,左手顺势按、卡在大鼠躯干背部,稍加压力向头颈部滑行,以左手拇指和食指捏住
一、实验动物的标记 1. 染色法 适用于小动物,如兔子、大鼠、小鼠等。此方法是将化学药品涂在动物的被毛上,以不同颜色来区分动物。常用的化学药品有:3%~5%苦味酸溶液(黄色)、0.5%中性品红(红色)、2%硝酸银(咖啡色)。标记的原则是:先左后右,从上到下。如果动物编号是二位数或三位数,那相应的用二种或三种不同的颜色,不同颜色代表不同位数(个位、十位、百位),标记的原则同上。 2. 挂牌法 常用于大动物。写有编号的金属牌挂在动物的颈上来区分动物。对于猴、狗、猫等动物
大鼠,体重150~300g;尾动脉测压系统,系统由包括尾动脉测压仪、脉搏传感器、加压尾套、尾部加热器及动物固定装置等组成。 3. 实验方法与步骤 不同厂家,不同型号的尾动脉测压系统操作步骤上有些小的差异,但基本操作步骤是一致的。 (1)大鼠固定和加温:加温采用大鼠全身或鼠尾局部加温。固定一般采用有机玻璃制成的固定器。 (2)确定起始脉搏水平:将加压尾套、脉搏换能器依次套在鼠尾合适位置。 (3)测定血压:用橡皮球充气加压,使加压尾套内的压力升高至脉搏完全
 技术资料
技术资料