相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 国食药监械注册号:
无
- 库存:
100
- 供应商:
玉研仪器公司
- 现货状态:
热板镇痛仪,热板疼痛测试仪,热板仪
- 保修期:
12个月
- 规格:
敬请来电咨询
小动物冷热板测痛仪是评估小动物冷、热痛觉异常性疼痛和痛觉过敏研究的经典工具,适用于大鼠、小鼠麻醉、镇痛、神经性的药物筛选,为相关镇痛药物研究提供科学依据;常用于慢性疼痛、神经病理性疼痛等镇痛药物研发、筛选和药效评估实验中。
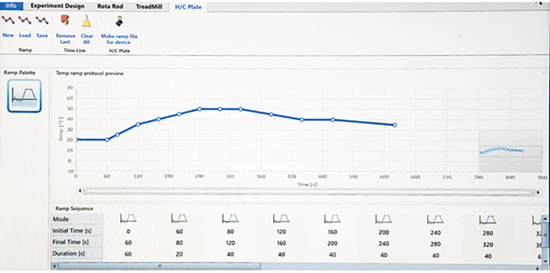
在动物疼痛研究中,冷热板测试一直是啮齿动物冷、热痛试验的金标准。除了常用的恒温方法外,研究者越来越偏爱能够以给定的时间速率将温度从起始点提高/降低到终点的设备,以区分伤害感受器亚型,从而检测痛觉过敏和异常性疼痛的差异。
玉研仪器公司的冷热板测试仪具有温度变化范围广、多阶段测试可调等优点,可以灵活地进行从大小鼠痛觉过敏到异常性疼痛的多种疼痛实验。设备的静音运行模式可将实验动物的干扰降到**,保证动物每次的伤害性反应都可在无拘束的自然条件下得出;并可通过U盘将实验数据导出为CSV文件,方便数据统计与处理。
在主机设置初始温度和目标温度后,将大鼠(小鼠)放置在冷热板上,冷热板会以稳定的速率进行降温或加热,当温度达到疼痛的敏感性节点时,引起动物伤害性反应(后爪舔舐、退缩或跳跃)
主要特色:
· 具备冷板和热板两种功能:能将生理性疼痛实验与病理性疼痛实验在同一台仪器上完成的仪器;
· 动物在无拘束状态下进行测试,能够准确反映动物的痛觉行为,可对动物行为的潜伏期和固定时间内舔足次数进行准确统计;

型号:35150
产品特点:
· 具备冷板和热板两种工作模式,具有较宽的温度可调范围;
· 热板测试:根据著名的热板测试设计者N.B. Eddy 和D. Leinbach,进行麻醉类镇痛药快速精准筛查;
· 冷板痛觉测试:可用于研究冷感受器和冷异常性疼痛;
· 两种工作模式可选:固定温度,按照一定的升温/降温速度进行测试;
· 可额外选配的连接主机的辅助板,为老鼠提供测试之前的适应环境;
· 配备小鼠、大鼠通用的透明测试笼,配备防止凝雾的盖板;
· 配备测试软件,可用于管理结果的管路和统计;
采用的新技术:
· 具有更快的升温和降温速度;
· 加温和降温过程具备更好的稳定性和均匀性;
· 分析软件作为了标准配置,可提供远程诊断和互联网接入;
· 操作员可以在电脑上组织实验,可通过U盘对数据进行拷贝;
· 测试指标、实验分组和各种参数(温度、模式等)可以快速设置并保存;
数据收集和管理:
· 可在触摸屏上查看历史测试数据
· 测试参数和测试数据可以Text、Excel或Pdf格式导出;
· 可通过DropBox、OneDrive、GoogleDrive保存到云端;
· 数据可过USB数据线传输到电脑,测试结果在电脑软件中会被更加完整的显示;
· 在软件中可根据参数与测试结果对数据进行分类;
· 用户可以在测试之前和之后添加信息,结果可以树状结构显示,可以进行拖放和重新布局;
敬请关注玉研仪器微信号

风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验1.Orthofer, Michael, et al. "Identification of ALK in Thinness." Cell 181.6 (2020): 1246-1262.doi: 10.1016/j.cell.2020.04.034
IF 66.85
2.Trendafilova, Teodora, et al. "Sodium-calcium exchanger-3 regulates pain “wind-up”: From human psychophysics to spinal mechanisms." Neuron 110.16 (2022): 2571-2587. doi:
IF 18.69
3.Cao, Chenxi, et al. "Cholesterol-induced LRP3 downregulation promotes cartilage degeneration in osteoarthritis by targeting Syndecan-4." Nature Communications 13.1 (2022): 7139. doi: 10.1038/s41467-022-34830-4
IF 17.69
4.Prieto, Martin, et al. "Light activated pulsatile drug delivery for prolonged peripheral nerve block." Biomaterials 283 (2022): 121453. doi: 10.1016/j.biomaterials.2022.121453
IF 15.30
5.Hou, Yiwen, et al. "Coordinated activity of a central pathway drives associative opioid analgesic tolerance." Science Advances 9.6 (2023): eabo5627. doi:
IF 14.96
6.Xing, Lei, et al. "Expression of human‐specific ARHGAP11B in mice leads to neocortex expansion and increased memory flexibility." The EMBO journal 40.13 (2021): e107093. doi:
IF 14.01
7.Cetin, Zeynep, et al. "The Role of Hydrogen Sulfide in the Development of Tolerance and Dependence to Morp*hine in Mice." Neuropsychobiology 80.3 (2021): 264-270. doi: 10.1159/000511541
IF 12.33
8.Ford, Neil C., et al. "Role of primary sensory neurone cannabinoid type-1 receptors in pain and the analgesic effects of the peripherally acting agonist CB-*13 in mice." British journal of anaesthesia 128.1 (2022): 159-173.doi:10.1016/j.bja.2021.10.020
IF 11.72
9.Blomqvist, Kim J., et al. "Systemic hypertonic saline enhances glymphatic spinal cord delivery of lumbar intrathecal morp*hine." Journal of Controlled Release 344 (2022): 214-224. doi:10.1016/j.jconrel.2022.03.022
IF 11.47
10.Gan, Zheng, et al. "Repetitive non-invasive prefrontal stimulation reverses neuropathic pain via neural remodelling in mice." Progress in neurobiology 201 (2021): 102009. doi: 1
IF 10.89
11.Alejo, Teresa, et al. "Nanogels with high loading of anesthetic nanocrystals for extended duration of sciatic nerve block." ACS Applied Materials & Interfaces 13.15 (2021): 17220-17235. doi:
IF 10.38
12.Li, Miao, et al. "Activation of VIP interneurons in the prefrontal cortex ameliorates neuropathic pain aversiveness." Cell reports 40.11 (2022): 111333.doi: 10.1016/j.celrep.2022.111333
IF 10.00
13.Morelli, Chiara, et al. "Identification of a population of peripheral sensory neurons that regulates blood pressure." Cell Reports 35.9 (2021): 109191. doi 10.1016/j.celrep.2021.109191
IF 10.00
14.Huang, Weiyuan, et al. "TRESK channel contributes to depolarization-induced shunting inhibition and modulates epileptic seizures." Cell Reports 36.3 (2021): 109404. doi: 10.1016/j.celrep.2021.109404
IF 10.00
15.Ouyang, Handong et al. “The YTHDF1-TRAF6 pathway regulates the neuroinflammatory response and contributes to morp*hine tolerance and hyperalgesia in the periaqueductal gray.” Journal of neuroinflammation vol. 19,1 310. 22 Dec. 2022, doi:10.1186/s12974-022-02672-y
IF: 9.59
大小鼠转棒仪该仪器用于研究药物对动作协调性和抗疲劳特性的影响,对相关药物筛选有重要价值。实验时将动物放置在滚筒上并避免滑落,转动滚筒后,如果动物滑落下来就会相应停止下面的传感平台进行结果记录,可以同时进行五个大鼠或小鼠实验,大鼠采用直径3.75英寸的滚筒,小鼠采用直径为1.25英寸的滚筒。仪器采用数字控制: 5个标准通道,测试时间可调; 启动速度可调,最终速度可调; 加速度可调,前进反转两种模式选择; 测量距离可记录,标准计算机打印口输出; RS232 串口输出。大小鼠疲劳测试仪
药理学实验 镇痛实验(热板法) 【目的】 1.掌握镇痛药的实验法。 2.观察罗通定的镇痛作用。 【原理】将小鼠置于一定温度的热板上,热刺激小鼠足部产生痛反应,即舔足反应。以小鼠出现舔足的时间作用为痛反应指标,判断药物是否具有镇痛作用。 【器材】 热板仪、天平、注射器等。 【动物】 ♀小鼠 【药品】 0.2%罗通定、生理盐水(NS) 【方法】 1.预选动物:预选
实验概要 本实验是通过抓力测试仪对小鼠前肢力量进行测定。 主要设备 抓力测试仪 实验材料 小鼠 实验步骤 1.将小鼠放置于透明平台上,抓竿的前方。 2.抓住小鼠尾部,向后直线拉拽。动物
 技术资料
技术资料










