相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 国食药监械注册号:
无
- 库存:
100
- 供应商:
玉研科学仪器有限公司
- 现货状态:
定位仪适用手术保温毯,动物手术保温毯
- 保修期:
12个月
- 规格:
敬请来电咨询
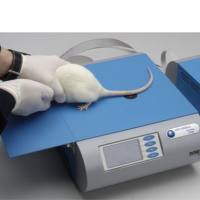
体温维持仪(动物手术保温毯)采用反馈控制的原理进行工作:实时测量动物的体温,通过动物体温的波动和实时的情况,来反馈控制加热毯的工作状态。(非常适合对手术过程中的大鼠和小鼠进行体温维持工作)
动物手术保温毯具有测温、控温和电加热功能,用于维持试验动物正常体温。本仪器测、控精度高,响应迅速快,工作稳定可靠,对实验环境无电磁干扰。
主要用途:
· 测量动物体温(肛温或者组织温度);
· 加热和控温,为手术中的动物进行保温;
主要技术参数:
· 测温范围:0.0℃~99.9℃
· 控温范围:0℃~80℃
· 测量和控温精度:0℃~80℃ 范围内误差≤±0.2℃
· 加热电源额定输出功率:40W
· 设定按键:触摸按键
· 数字显示
· 工作电源:50Hz AC220V±10%
· 仪器尺寸:250×195×100mm
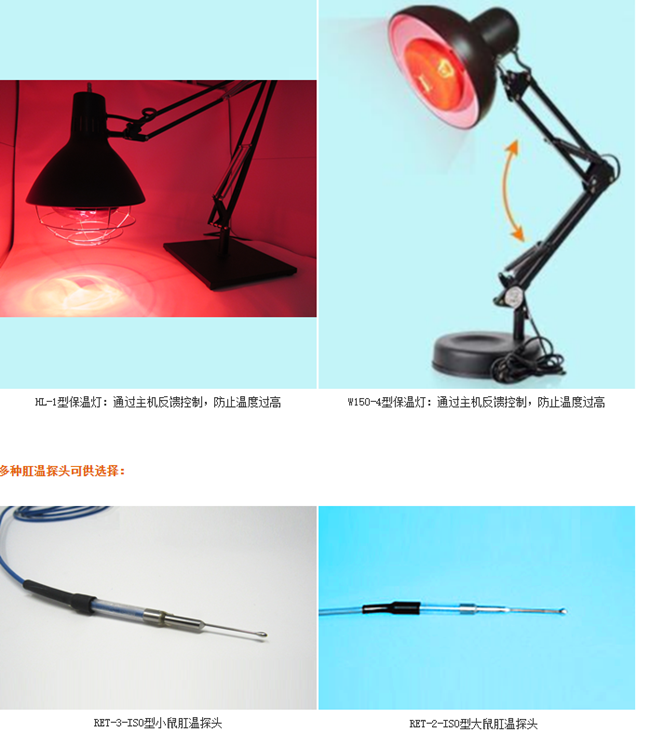
· 多种保温板、保温毯、红外灯、体温探头可供选择
型号:TCAT-2
使用方法:
1、 仪器连接;
2、 温度的设定;
3、 肛温探头安放到位;
通过温度探头的反馈数据,控制设备的运行状态:多种保温板、保温毯可供选择。


可根据需要,选择水浴式保温毯:
水浴保温系统非常用于对术中、术后的动物进行体温维持,多种尺寸的水浴毯子和手术板可供选择。
· 可在小动物手术过程中,防止动物身体热量过度流失,进行体温维持;
· 也可在手术和术后恢复过程中保持低温;
· 温度可调可控,配置灵活,操作方便;
· 多种毯子和手术板可选
· 一台主机可以配多个毯子和板子:不同的毯子和手术板可以串联也可以并联,扩展方便;
主要特点:
· 在手术过程中防止身体热量流失,并在手术和恢复过程中保持低温;
· 温控范围为20-50℃;
· 使用安全可靠,有安全报警装置;
· 管路连接方便,使用安全,易于清洁;
· 大鼠不锈钢水浴板尺寸:33*20*2.5cm
· 小鼠不锈钢水浴板尺寸:25*10*2.5cm
· PVC材质保温毯尺寸:38*40cm
· PVC材质保温毯尺寸:160*65cm
型号:2020
型号:TP700
主机搭配保温毯、保温板来实现动动物的体温维持,多种款式可选: 
玉研仪器公司自研脑立体定位仪十四年,适用于大鼠、小鼠等实验动物,经典十字操作臂实现精准定位,精度可达10微米,特制螺纹精密螺杆,稳固不晃动实现对特定脑区的精确定位,是神经环路研究、神经系统性疾病、神经药理等领域内的重要研究设备,性价比高,适合全国各大科研院校,医院,高新企业,药企,医疗机构等科研单位。
大鼠、小鼠脑立体定位仪有多种不同的型号可供选择:单臂型,双臂型,数显型,数控型,敬请来电咨询
轻便型脑立体定位仪:

标准型:

动物脑立体定位仪产品特点:
操作灵活、简便,标配大鼠适配器;
脑立体定位仪标尺是由激光雕刻,清晰易读:手动款式精确度为0.1mm,数字显示型号精度为0.01mm;
脑立体定位仪操作臂移动范围(上下,左右,前后):三方向移动距离80mm;
垂直方向可90度转动,并随时锁定位置;
扩充能力很强,可增加操作臂,增加注射装置及颅钻等;
可以根据需要增加不同的固定器,用于多种动物;
脑立体定位仪具有以下优势:
- 标尺易读数
- 移动平滑
- 全方位调节
- 电生理操作方便
- 配件多样,可选配各种动物适配器,麻醉罩以及颅钻
大鼠脑立体定位仪的主要构造:

数字显示型脑立体定位仪,类似数显型的游标卡尺,可自动读取XYZ轴的滑动距离。
数显型脑立体定位仪主要特点:
1.适用于小鼠、新生大鼠、鸟类等动物的研究(请根据需求选择合适的配置);
2.无U型底座设计,操作空间最大化;
3.读数精度采用游标卡尺方式,读数精度为10μm;
4.操作臂上下、前后、左右移动范围可达80mm;垂直方向移动90°可锁住;
5.配有鼻子适配器、三种不同型号的耳棒等;
6.三角形的导轨使之能够进行快速定位。其通用的接点便于实验者横向或纵向移动电极,锁定装置能够将电极以任何角度固定,不会滑脱。
7.扩充能力很强,可增加操作臂、增加注射装置及颅钻等,也可以根据需要增加不同的固定器;
8.目标定位的调零功能:在任意一个位点,每条轴方向上的显示都可以归零,这样就可以使操作简化,阅读方便。实际操作中,如果要定位一个特殊位点,可以先找到参考点,然后归零,再移动数显型脑立体定位仪操作臂到希望到达的点上,调低电极,夹持器或微管到位点上即可。
小鼠及幼大鼠脑立体定位仪适配器
该小鼠适配器耳杆采用树脂材料,对尖端进行适合的锥度处理,能够牢固的夹紧小鼠头部又避免了采用不锈钢作为耳杆对小鼠颅骨的损伤,两侧耳杆的高度和门齿夹的高度均可自由进行调节,并带有刻度,适合不同的角度进行实验。
多种型号可供选择:
标准脑立体定位仪(小鼠)
双臂标准脑立体定位仪(小鼠)
数显标准脑立体定位仪(小鼠)
数显双臂标准脑立体定位仪(小鼠)
标准脑立体定位仪(大鼠)
双臂标准脑立体定位仪(大鼠)
数显标准脑立体定位仪(大鼠)
数显双臂标准脑立体定位仪(大鼠)
电动标准脑立体定位仪(大鼠)
定位仪基座
大鼠头部固定器
小鼠头部固定器
SA-100系列 标准型大鼠脑立体定位仪:
SA-100系列 标准型小鼠脑立体定位仪:

SA-150系列 数显型脑立体定位仪(大鼠)

单臂、数显标准脑立体定位仪(小鼠)

双臂、数显双臂标准脑立体定位仪(大鼠、小鼠)

脑立体定位仪相关配件及可选配件:

1. Albéri, L., Lintas, A., Kretz, R., Schwaller, B., & Villa, A. E. (2013). The calcium-binding protein parvalbumin modulates the firing 1 properties of the reticular thalamic nucleus bursting neurons. Journal of neurophysiology, 109(11), 2827-2841.
2. Sonati, T., Reimann, R. R., Falsig, J., Baral, P. K., O’Connor, T., Hornemann, S., Aguzzi, A. (2013). The toxicity of antiprion antibodies is mediated by the flexible tail of the prion protein. Nature, 501(7465), 102-106.
3. Ali, I., O’Brien, P., Kumar, G., Zheng, T., Jones, N. C., Pinault, D., O’Brien, T. J. (2013). Enduring Effects of Early Life Stress on Firing Patterns of Hippocampal and Thalamocortical Neurons in Rats: Implications for Limbic Epilepsy. PLOS ONE, 8(6), e66962.
4. Bell, L. A., Bell, K. A., & McQuiston, A. R. (2013). Synaptic Muscarinic Response Types in Hippocampal CA1 Interneurons Depend on Different Levels of Presynaptic Activity and Different Muscarinic Receptor Subtypes. Neuropharmacology.
5. Bolzoni, F., Bączyk, M., & Jankowska, E. (2013). Subcortical effects of transcranial direct current stimulation (tDCS) in the rat. The Journal of Physiology.
6. Bolzoni, F., Bączyk, M., & Jankowska, E. (2013). Subcortical effects of transcranial direct current stimulation (tDCS) in the rat. The Journal of Physiology.
7. Babaei, P., Tehrani, B. S., & Alizadeh, A. (2013). Effect of BDNF and adipose derived stem cells transplantation on cognitive deficit in Alzheimer model of rats. Journal of Behavioral and Brain Science, 3, 156-161.
8. Gilmartin, M. R., Miyawaki, H., Helmstetter, F. J., & Diba, K. (2013). Prefrontal Activity Links Nonoverlapping Events in Memory. The Journal of Neuroscience, 33(26), 10910-10914.
9. Feng, L., Sametsky, E. A., Gusev, A. G., & Uteshev, V. V. (2012). Responsiveness to nicotine of neurons of the caudal nucleus of the solitary tract correlates with the neuronal projection target. Journal of Neurophysiology, 108(7), 1884-1894.
10. Clarner, T., Diederichs, F., Berger, K., Denecke, B., Gan, L., Van der Valk, P., Kipp, M. (2012). Myelin debris regulates inflammatory responses in an experimental demyelination animal model and multiple sclerosis lesions. Glia, 60(10), 1468-1480.
11. Girardet, C., Bonnet, M. S., Jdir, R., Sadoud, M., Thirion, S., Tardivel, C., Troadec, J. D. (2011). Central inflammation and sickness-like behavior induced by the food contaminant deoxynivalenol: A PGE2-independent mechanism.Toxicological Sciences, 124(1), 179-191.
12. Hruška-Plocháň, M., Juhas, S., Juhasova, J., Galik, J., Miyanohara, A., Marsala, M., Motlik, J. (2010). A27 Expression of the human mutant huntingtin in minipig striatum induced formation of EM48+ inclusions in the neuronal nuclei, cytoplasm and processes. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.
13. Brooks, S., Jones, L., & Dunnett, S. B. (2010). A29 Frontostriatal pathology in the (C57BL/6J) YAC128 mouse uncovered by the operant delayed alternation task. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A10.
14. Yu, L., Metzger, S., Clemens, L. E., Ehrismann, J., Ott, T., Gu, X., Nguyen, H. P. (2010). A28 Accumulation and aggregation of human mutant huntingtin and neuron atrophy in BAC-HD transgenic rat. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.
15. Baxa, M., Juhas, S., Pavlok, A., Vodicka, P., Juhasova, J., Hruška-Plocháň, M., Motlik, J. (2010). A26 Transgenic miniature pig as an animal model for Huntington’s disease. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A8-A9.
敬请关注玉研仪器微信号

风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验玉研仪器公司体温维持仪相关文献:
[1] Hu B, Jin C, Zeng X, et al. γδ T cells and adipocyte IL-17RC control fat innervation and thermogenesis[J]. Nature, 2020, 578(7796): 610-614.
[2] Zeng X, Ye M, Resch J M, et al. Innervation of thermogenic adipose tissue via a calsyntenin 3β–S100b axis[J]. Nature, 2019, 569(7755): 229-235.
[3] Nguyen K D, Qiu Y, Cui X, et al. Alternatively activated macrophages produce catecholamines to sustain adaptive thermogenesis[J]. Nature, 2011, 480(7375): 104-108.
[4] Yamada M, Miyakawa T, Duttaroy A, et al. Mice lacking the M3 muscarinic acetylcholine receptor are hypophagic and lean[J]. Nature, 2001, 410(6825): 207-212.
[5] Gao Q, Mezei G, Nie Y, et al. Anorectic estrogen mimics leptin's effect on the rewiring of melanocortin cells and Stat3 signaling in obese animals[J]. Nature medicine, 2007, 13(1): 89-94.
[6] Bona E, Hagberg H, Løberg E M, et al. Protective effects of moderate hypothermia after neonatal hypoxia-ischemia: short-and long-term outcome[J]. Pediatric research, 1998, 43(6): 738-745.
[7] Arsenijevic D, Onuma H, Pecqueur C, et al. Disruption of the uncoupling protein-2 gene in mice reveals a role in immunity and reactive oxygen species production[J]. Nature genetics, 2000, 26(4): 435-439.
[8] Hamada F N, Rosenzweig M, Kang K, et al. An internal thermal sensor controlling temperature preference in Drosophila[J]. Nature, 2008, 454(7201): 217-220.
[9] Kathuria S, Gaetani S, Fegley D, et al. Modulation of anxiety through blockade of anandamide hydrolysis[J]. Nature medicine, 2003, 9(1): 76-81.
[10] Xiang Y, Yuan Q, Vogt N, et al. Light-avoidance-mediating photoreceptors tile the Drosophila larval body wall[J]. Nature, 2010, 468(7326): 921-926.
[11] Scheller E L, Doucette C R, Learman B S, et al. Region-specific variation in the properties of skeletal adipocytes reveals regulated and constitutive marrow adipose tissues[J]. Nature communications, 2015, 6(1): 1-15.
[12] Yoneshiro T, Wang Q, Tajima K, et al. BCAA catabolism in brown fat controls energy homeostasis through SLC25A44[J]. Nature, 2019, 572(7771): 614-619.
[13] Chen Y, Ikeda K, Yoneshiro T, et al. Thermal stress induces glycolytic beige fat formation via a myogenic state[J]. Nature, 2019, 565(7738): 180-185.
的同时或者给药后继续对目标脑区进行光刺激。应用范围:人类神经性疾病动物模型、高级脑功能、情感、认知等相关研究。三、套管系统配套(单管)套管系统组配套(双管)四、动物实验(材料准备)1. 仪器设备与配件:异氟烷气体麻醉系统(包括定位仪专用麻醉面罩和气体回收系统)、脑立体定位仪、显微镜、冷光源、保温装置(电子或水浴保温)、颅骨水平校准器、颅钻(包括钻头)、颅钻夹持器、套管、套管夹持器、PE 管、小螺钉、微量注射泵、微量注射器、手术器械包、大小鼠剃毛器、凝血器、手术垫、快速灭菌器2. 试剂碘伏、酒精、酒精
骤停。术中应密切观察和监测,及时发现和处理。 (三)体温异常 1、体温降低: (1)原因:室温低,手术野及体表散热多,输入低温液体和血液。 (2)处理:保持室温24-26℃;大量输库存血时应加温;必要时应用保温毯保温。 2、体温升高: (1)原因:室温高;覆盖过多所致散热障碍;脱水、感染、塞战或呼吸做功增加等。 (2)处理:治疗病因,必要时采用体表物理降温。
:1.3.1小动物麻醉、脑立体定位(生产厂家:瑞沃德公司)1.3.2显微外科手术器械包(型号:SP0003-R,生产厂家:瑞沃德公司)1.3.3 561 mm 黄绿光激光器(型号:R-LG561-100-A5,生产厂家:瑞沃德公司):用于对动物头部进行光刺激造模。1.3.4 小动物保温箱(型号:912-001,生产厂家:LYON/USA),供动物手术后护理。1.3.5 SMART3.0 小动物行为视频追踪系统(生产厂家:Panlab/Spanish),供造模后通过动物行为评判神经功能。1.3.6脑模具(生产
 技术资料
技术资料