相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
ScreenFect A+
DNA & siRNA 转染试剂

通过点击化学开发的新型脂质体!!
ScreenFect ™A plus(也称作ScreenFect ™A+)是通过点击化学(Click Chemistry)筛选※1出的新型阳离子脂质体组成的转染试剂,适用于各种真核生物来源的细胞,也可直接添加至含有抗生素或者血清的培养基中。
使用 ScreenFect ™A plus转染试剂可将DNA和siRNA导入通用实验细胞系(HeLa、HepG2、MDCK等)、干细胞(小鼠ES细胞等)、血细胞(巨噬细胞、THP-1、RAW264.7等)、小胶质细胞、原代细胞(原代培养)和昆虫细胞中。其细胞毒性低,因此转染后无需更换培养基。另外,试剂成分中不含有任何有毒有害物质。
※1 Biomaterials. 2012 Nov; 33(32):8160-6. 2012
特点
● DNA和ScreenFect ™A plus试剂混合比例可选范围更广
● 使用一步法缩短分析时间至1天
● 可高效转染难以导入的细胞
● 成本低
ScreenFect ™A plus 转染性能
 |
|

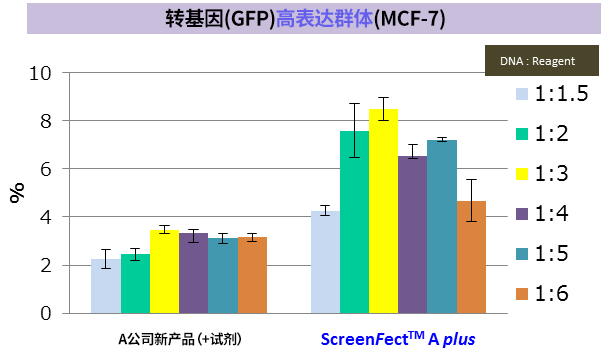
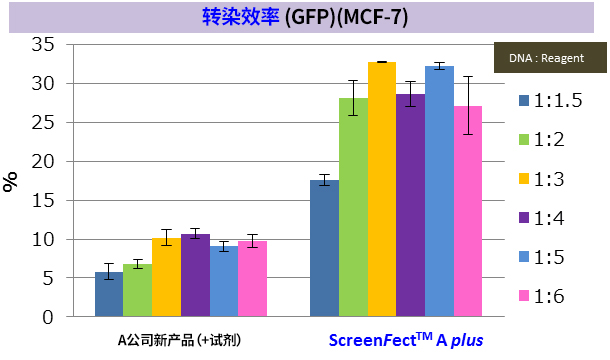
※ MCF-7:人乳腺癌来源细胞(上皮细胞样形态)(贴壁系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
|
改善难以导入的细胞的转染效率! |
|
|
|
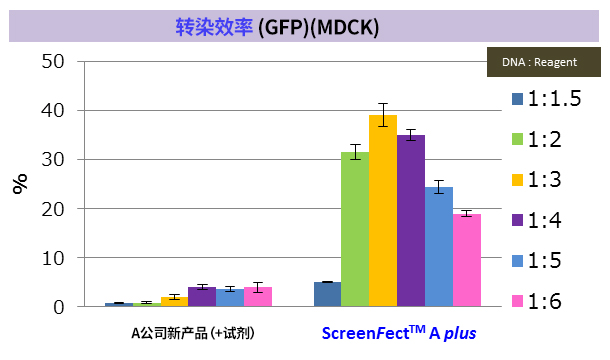
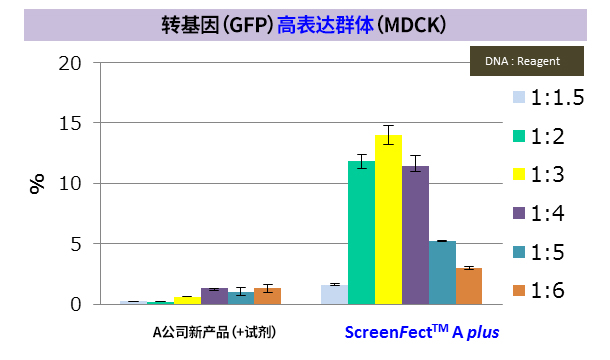
※ MDCK:狗肾小管上皮细胞来源(贴壁系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
|
改善难以导入的细胞的转染效率! |
|
|
|
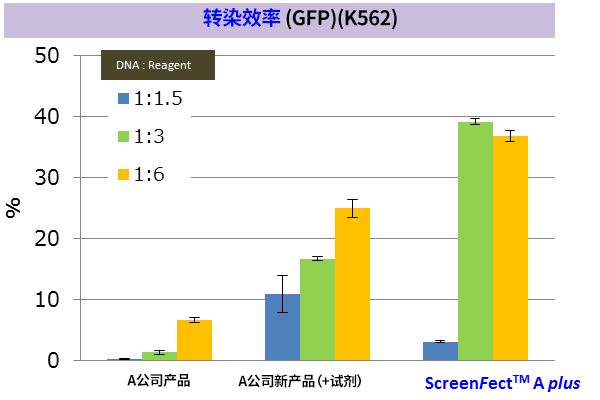
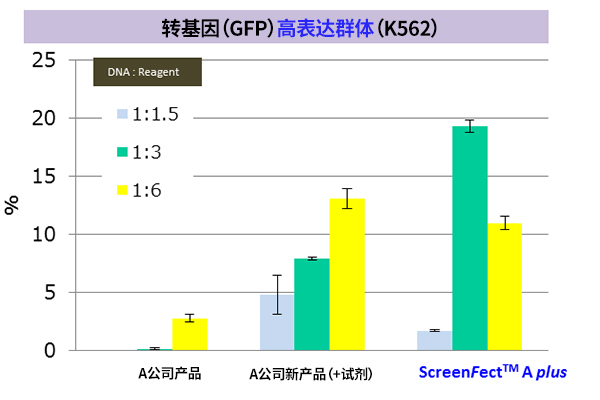
※ K562:人慢性髓性细胞白血病细胞来源(悬浮系)
※ 导入方法:A公司新产品 → 2步法,ScreenFect ™A plus → 1步法
|
改善难以导入的细胞的转染效率! |
◆应用数据
1. 向LNCaP细胞(贴壁系)中导入YFP融合基因的实验
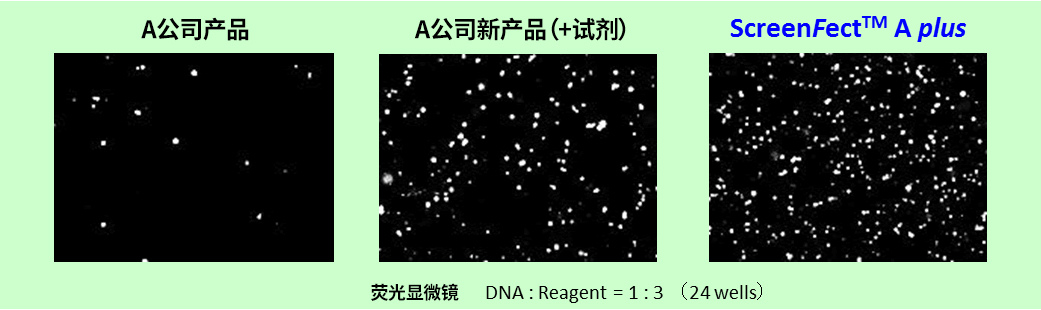
进行向LNCaP细胞(贴壁系)中导入YFP融合基因的实验,在荧光显微镜下比较导入基因的表达效率。
使用ScreenFect ™A plus和增强剂SFA P-reagent,可以观察到与其他公司产品相同或更高的表达效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
LNCap (人前列腺癌) 中的性能比较
 |
 |
|
〔接种细胞数〕3×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 3 〔孔板〕24孔板 |
〔接种细胞数〕1.5×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 3 〔孔板〕24孔板 |
2. 向HeLa细胞(贴壁系)中导入EGFP_mRNA的实验
进行向HeLa细胞(贴壁系)中导入EGFP_mRNA的实验,在荧光显微镜下比较EGFP的表达效率。
使用ScreenFect ™A plus和增强剂SFA P试剂(产品编号:191-18331、197-18333),可以观察到与其他公司产品相同或更高的表达效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
HeLa细胞中的mRNA转染性能比较

〔接种细胞数〕0.7 x 105 cells/well
〔mRNA量〕0.1 µg/assay
〔转染试剂混合比例〕mRNA量 (µg) : ScreenFect ™ A plus 试剂(µL) = 1 : 4
〔检测时间〕转染后48 h
〔曝光时间〕2 s
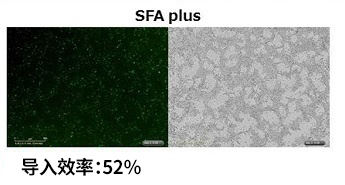
3. 向hiPSC(201B7株)中导入GFP融合基因的实验
进行将hiPSC(201B7株) 通过反向转染(1-STEP)导入GFP融合基因的实验,在荧光显微镜以及流式细胞仪下比较导入基因的表达效率。
使用反向转染法转染hiPS细胞的效果优异,在StemSure® hPSC培养基Δ和mTeSR™ 1两个培养基中,ScreenFect ™A plus表现出与其他公司产品相同或更高的导入效率。
※ 数据刊登于BioWindow No.144 (2016年6月号)
hiPSC(201B7株)中的性能比较
|
1-step 使用StemSure® hPSC培养基Δ |
|
 |
 |
|
ScreenFect™A plus的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕4 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 0.5 〔孔板〕12孔板 〔备注〕SFA plus reagent以及pDNA使用了Opti-MEM® 进行稀释。 |
其他公司产品的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕2 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 2 〔孔板〕12孔板
|
|
1-step 使用mTeSR™1培养基 |
|
 |
 |
|
ScreenFect™A plus和其他公司产品的转染条件 〔细胞数〕5×105 cells/well 〔质粒DNA量〕1 µg/assay 〔转染试剂混合比例〕 pDNA量 (µg) : ScreenFect ™A plus reagent (µL) = 1 : 2 〔孔板〕12孔板 〔备注〕SFA plus reagent以及pDNA使用了Opti-MEM® 进行稀释。 |
|
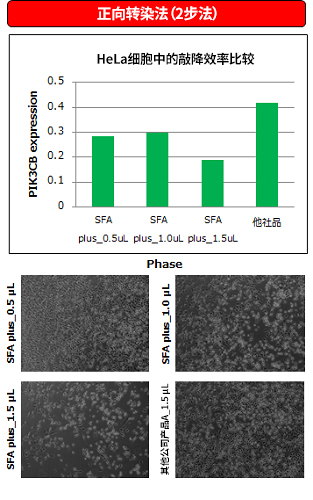
4. 向HeLa细胞(贴壁系)中导入PIK3CB siRNA的实验
使用反向转染(1-STEP)法以及正向转染(2-STEP)法进行向HeLa细胞中导入PIK3CB siRNA的实验,通过实时定量PCR测量PIK3CB mRNA的表达水平。
在定量结果的基础上与其他公司产品比较敲降效率,结果显示ScreenFect ™A plus表现出与其他公司产品相同或更高的敲降效率。
※ 数据刊登于BioWindow No.149 (2017年3月号)
HeLa细胞中的性能比较
 |
 |
|
〔接种细胞数〕1×105 cells/well 〔siRNA〕5 pmol/assay 〔转染试剂混合比例〕ScreenFect ™A plus reagent = 0.5~1.5 µL 其他公司产品 = 1.5 μL 〔孔板〕24孔板 〔检测时间〕48 h后进行确认 |
〔接种细胞数〕0.5×105 cells/well 〔siRNA〕5 pmol/assay 〔转染试剂混合比例〕ScreenFect ™A plus reagent = 0.5~1.5 µL 其他公司产品 = 1.5 μL 〔孔板〕24孔板 〔检测时间〕48 h后进行确认 |
◆使用方法、拥有使用实绩的细胞
1-Step与2-Step 操作比较
|
产品 |
ScreenFect™A plus |
A公司新产品(+reagent) |
A公司的新产品 |
|
各条件 |
1-Step |
2-Step |
|
|
实验方案天数 |
2 Days |
3 Days |
|
|
DNA量 |
少 |
多 |
|
|
是否需要调整细胞数 |
可随时调整 |
取决于预培养条件 |
|
|
是否需要胰蛋白酶处理 |
转染时 |
预培养时 |
|
|
基于HTS细胞检测的可操作性 |
+++++ |
+ |
|
|
是否需要更换培养基 |
取决于细胞 |
||
ScreenFect ™A plus一步法概要
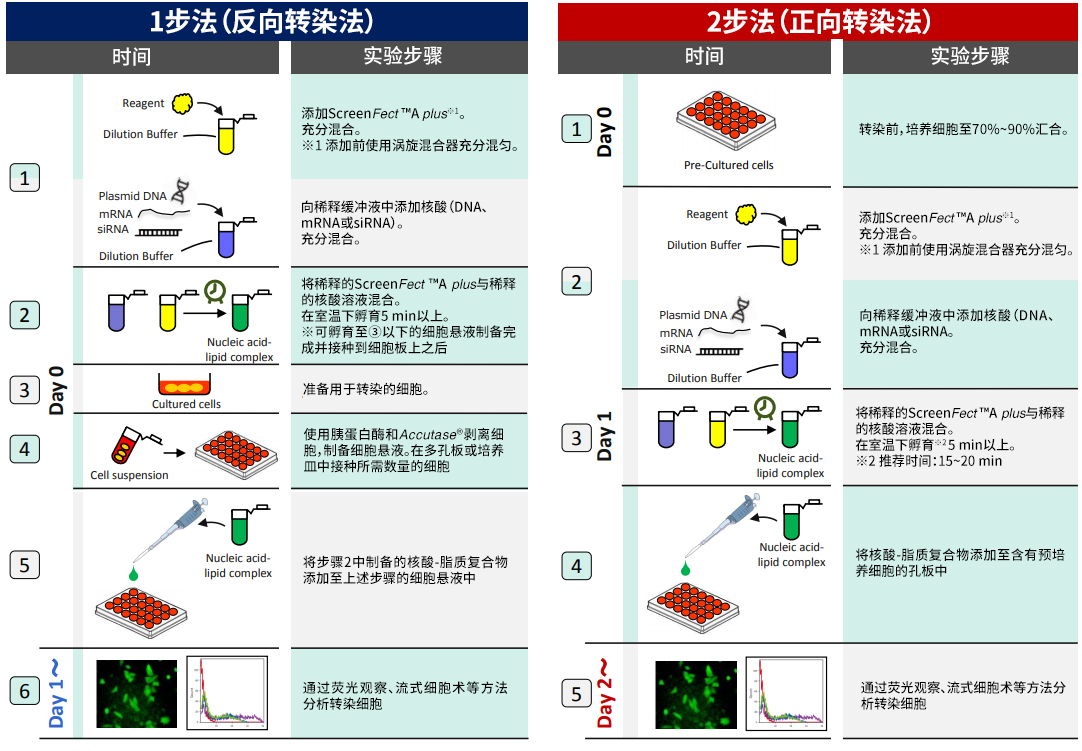
1步法 → 从转染到本分析的时间可缩短24 h!
ScreenFect ™A plus 转染条件
DNA转染
| DNA 转染 (/well) | |||||
| 孔板类型 | 表面积 | 培养基体积 |
SF-DNA 复合物 的总体积 |
DNA/稀释buffer | 转染试剂/稀释buffer |
| 96 wells | 0.3 cm2 | 100 µL | 10 µL | 50 ng/5 μL | 0.15 or 0.2 μL/5 μL |
| 24 wells | 2 cm2 | 500 µL | 50 µL | 250 ng/25 μL | 0.75 or 1.0 μL/25 μL |
| 12 wells | 4 cm2 | 1,000 µL | 100 µL | 500 ng/50 μL | 1.5 or 2.0 μL/50 μL |
| 6 wells | 10 cm2 | 2,000 µL | 250 µL | 1,250 ng/125 μL | 3.75 or 5.0 μL/125 μL |
注:进行大规模转染时,请在转染前准备多个微管,之后再进行转染。
例:10 cm培养皿转染相当于 → 5~6个样品(6孔板)
▼ ScreenFect ™A plus 推荐实验方案
产品随附的说明书中提供了简易的实验方案,请确认“相关资料”中的文件。
ScreenFect™A plus推荐使用1步转染法。在试剂方面,为保证充分的转染效率,推荐质粒DNA与转染试剂的混合比例为1 : 3~1 : 4。另外,如希望进一步抑制转染时的细胞毒性,请使用60~80%汇合度的细胞。
siRNA转染
| siRNA 转染 (/well) | |||||
| 孔板类型 | 表面积 | 培养基体积 |
SF-siRNA 复合物 的总体积 |
siRNA/稀释buffer | 转染试剂/稀释buffer |
| 96 wells | 0.3 cm2 | 100 µL | 10 µL | 1 pmol/5 µL | 0.1~0.3 µL/5 µL |
| 24 wells | 2 cm2 | 500 µL | 50 µL | 5 pmol/25 µL | 0.5~1.5 µL/25 µL |
| 12 wells | 4 cm2 | 1,000 µL | 100 µL | 10 pmol/50 µL | 1.0~3 µL/50 µL |
| 6 wells | 10 cm2 | 2,000 µL | 250 µL | 25 pmol/125 µL | 2.5~7.5 µL/125 µL |
注:虽然ScreenFect ™A plus也可以用于siRNA转染,但更推荐使用ScreenFect ™ siRNA 进行siRNA转染。
拥有ScreenFect ™A & A plus 应用实例的细胞
更多详细资料请联系富士胶片和光。
| No. | 细胞名称 | No. | 细胞名称 | No. | 细胞名称 | No. | 细胞名称 |
| 1 | 143BTK | 22 | GP2-293 | 43 | LLC-MK2 | 64 | OLHNI-2 |
| 2 | 786-O | 23 | H9C2 | 44 | LO2 | 65 | Mouse overy cell |
| 3 | A2058 | 24 | HCT116 | 45 | LoVo | 66 | PC12 |
| 4 | A375 | 25 | HEK293 | 46 | MC3T3 | 67 | Plat-E |
| 5 | A549 | 26 | HEK293 TN | 47 | MC3T3-E1 | 68 | PLC8024 |
| 6 | B16 | 27 | HEK293A | 48 | MCF-10 | 69 | Primary Fibroblast |
| 7 | B16F10 | 28 | HEK293F | 49 | MCF-10A | 70 | RAW264.7 |
| 8 | Ba/F3-CH1 | 29 | HEK293FT | 50 | MCF-7 | 71 | SH-SY5Y |
| 9 | BEAS-2B | 30 | HEK293T | 51 | MDCK | 72 | SK-Hep1 |
| 10 | BEL-7402 | 31 | HeLa | 52 | MEF | 73 | SKOV3 |
| 11 | BT549 | 32 | HeLa S3 | 53 | mES | 74 | T98G |
| 12 | C2C12 | 33 | HEp-2 | 54 | mHSC | 75 | TE-13 |
| 13 | Cell line from killifish 来自鳉鱼的细胞系 |
34 | HepG2 | 55 | Microglia 小胶质细胞 | 76 | THP-1 |
| 14 | CHO-K1 | 35 | hiPSC | 56 | MLEC | 77 | U-251 MG |
| 15 | COS-7 | 36 | HK2 | 57 | MS-1 | 78 | U2OS |
| 16 | DB lymphoma DB淋巴瘤 |
37 | HKC | 58 | Myeloid dendritic cell (MDC) 骨髓树突状细胞 |
79 | U937 |
| 17 | DC 2.4 | 38 | HL7704 | 59 | NB1RGB | 80 | Vero |
| 18 | Du145 | 39 | HuH-7 | 60 | NCI-H1703 | 81 | Drosophira ovary somatic cell |
| 19 | EL4 | 40 | HUVEC | 61 | NE3 | 82 | HT1080 |
| 20 | Endothelium cell 内皮细胞 |
41 | Ins-1 | 62 | NIH 3T3 | 83 | RH7777 |
| 21 | EPC(carp) | 42 | L428 | 63 | NK92 | 84 | HaCaT |
富士胶片和光将实时更新ScreenFect™数据库中的使用实例,如对上述内容有疑问,欢迎随时联系进行咨询。
◆产品列表
| 产品编号 | 产品名称 | 产品规格 |
| 293-73201 | ScreenFect™ A | 0.2 mL |
| 299-73203 | 1 mL | |
| 297-73204 | 1 mL×5 | |
| 293-75901 | ScreenFect™ mRNA | 0.2 mL |
| 299-75903 | 1 mL | |
| 299-75001 | ScreenFect™ siRNA | 0.2 mL |
| 295-75003 | 1 mL | |
| 290-80203 | ScreenFect™ UP-293 | 1 L用 |
| 294-80201 | 100 mL用 | |
| 191-18331 | SFA P-reagent | 100 μL |
| 197-18333 | 500 μL | |
| 194-18181 | ScreenFect™ Dilution Buffer | 50 mL |
【相关资料】
◆一步法和两步法实验流程的比较
|
产品名称 |
ScreenFect ™ A plus |
A厂家新产品 (+试剂) |
A厂家产品 |
|
推荐的实验流程 |
一步法 |
两步法 |
|
|
实验用时 |
2天 |
3天 |
|
|
所需DNA量 |
低 |
高 |
|
|
细胞数目调整 |
灵活 |
不灵活 |
|
|
胰酶消化 |
需要 |
需要 |
|
|
适于高通量筛选 |
+++++ |
+ |
|
|
培养基的更换 |
取决于细胞系 |
||
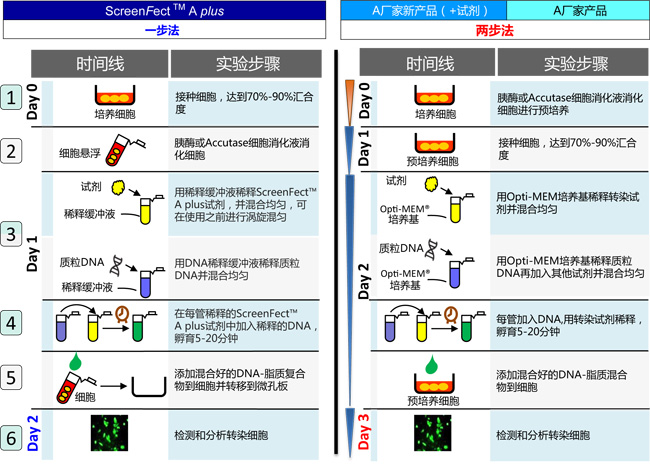
一步法比两步法节省24小时!
高性价比的高性能基因导入试剂
ScreenFect ™ 通信
基因导入人 iPS 细胞实验数据
介绍使用 ScreenFect ™A plus 将基因导入人iPS细胞的实验结果和操作步骤。本文记载了作为 iPS 细胞支架使用的 Matrigel 孔板包被方法、配制含有 Y-27632 的细胞悬浮液的操作步骤以及推荐的试剂比例,以供参考。
◆导入人iPS细胞(201B7株)的转染操作实例
在这里,我们将介绍一些使用 StemSure® hPSC 培养基Δ(产品编号:197-17571)的操作实例。该操作步骤的完整版和使用 mTeSR1 培养基的操作步骤,请查看 FUJIFILM Wako 公司的官网。
<转染试剂的配制>
将 2.0 μL 的 ScreenFect ™ A plus reagent、4.0 μg 的质粒 DNA 加入到 160 μL 的 Opti-MEM 中制成 DNA-lipid complex。
< Matrigel 包被孔板>
1. 4°C下溶解 Matrigel hESC-Qualified Matrix 。为防止发生凝固,请避免在室温下溶解。
2. 用 25 mL 冷却的 D-MEM/Ham's F-12 稀释 300μL 的 Matrigel。
3. 稀释后的 Matrigel 溶液按照 1 mL/well 加入到 12 孔板中。
4. 在室温下孵育1小时以上。
<细胞悬液的配制>
1. 将 StemSure® hPSC 培养基Δ在 2-8℃ 下放置数小时或过夜缓慢融解。不要在 37° C下解冻,并在一周内使用。
2. 将 bFGF(产品编号:064-05381,068-05384)按照终浓度 35-100ng/mL 添加到融解后的 StemSure® hPSC 培养基△中,配制成完全培养基(以下称为 sshPSC 培养基)。
3. 使用前将 sshPSC 培养基恢复至室温。不要使用温水浴。
4. 将 Y-27632 按照终浓度 10 μmol/L 添加到 sshPSC 培养基中(以下称为 ROCKi+培养基)。
5. 去除 hiPS 细胞培养孔板中的培养基,用 PBS(-)清洗细胞一次。
*请在细胞汇片达到80%且处于对数增殖期时进行细胞转染。
6. 除去 PBS(-),添加 Stempro Accutase。
7. 在 37°C,5%CO2 培养箱中静置5分钟。
8. 用 1 mL 微量移液枪添加 ROCKi+培养基,将细胞从培养板上分离并吹散成单细胞。
9. 转移至 15 mL离心管中。
10. 室温下 1000 rpm(约170×g)离心3分钟。
11. 去除上清,用ROCKi+培养基重悬细胞。
12. 计算活细胞的数量。
13. 用 ROCKi+培养基将细胞浓度调整至 5×105 cells/mL。
<转染>
添加 1 mL 配制好的 DNA-lipid complex 到细胞悬液中,使用移液器充分混匀,并接种在 12 孔板中。
※要点
接种 24 小时后请更换培养基。此时的培养基不需要含有 Y-27632。
◆实验数据
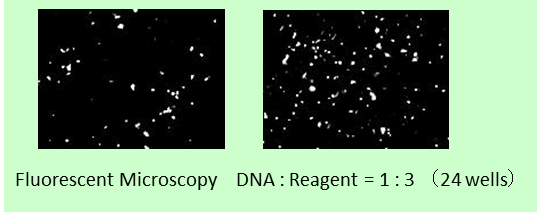
通过反向转染(1-STEP)将 GFP 融合基因导入 hiPS 细胞(201B7株),并通过荧光显微镜比较基因的导入效率。
® hPSC 培养基Δ的使用>
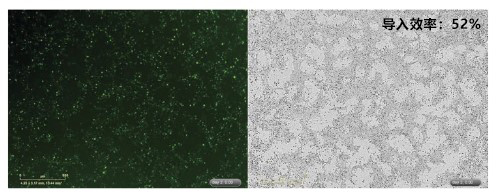
细胞数:5×105 cells/well
质粒 DNA 量:4 μg/assay
转染试剂混合比例:DNA 量(μg):ScreenFect ™ A plus reagent (μL)=1 : 0.5
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。

细胞数:5 x 105 cells/well
质粒 DNA 量:1 μg/assay
转染试剂混合比例:DNA数量(μg):ScreenFect ™ A plus reagent (μL)=1 : 2
容器:12 孔板
备注:用 Opti-MEM 稀释 ScreenFect ™ A plus reagent 和 DNA。
◆使用上的注意
● 建议在单细胞状态下进行人iPS细胞的基因导入。
● 建议基因导入时的细胞数约为 5×105 cells/well。
● 当质粒 DNA 量多时,导入基因的表达量高会引起细胞死亡。

请点击【相关资料】查看PDF
◆Q&A
Q1. 基因导入效率低怎么办?
A1. 通过优化DNA量和试剂用量可提高效率。另有优化Protocol(日语版/英语版),可联系富士胶片和光获取。此外,使用ScreenFect™和SFA P-reagent(产品编号:191-18331)也可提高基因导入效率。
Q2. 如何提高表达效率?
A2. 使用ScreenFect™和SFA P-reagent(产品编号:191-18331)可提高表达水平。
Q3. 转染试剂对细胞毒性强怎么办?
A3. 使用ScreenFect™和SFA P-reagent(产品编号:191-18331)可降低细胞毒性。
Q4. 从哪些条件实验开始比较好?
A4. 可参考各ScreenFect™产品的快速Protocol(日语版/英语版),请联系富士胶片和光获取。
Q5. 转染过程是否需要更换培养基?
A5. 更换培养基不是必须的,但在添加转染试剂前更换新鲜的培养基可提高基因导入效率,改善细胞状态。
Q6. 培养基中能否含有血清和抗生素?
A6. 根据细胞类型、DNA导入量等因素,可能需要更换培养基,以适时控制培养基含或不含血清/抗生素。请根据实验用途进行讨论。
Q7. 1-Step、2-Step是什么?
A7. 1-Step是一种反向转染方法,即转染前通过在细胞分离状态下添加试剂来导入基因。
A7. 2-Step是一种正向转染法,即提前一天进行细胞的预培养,然后在细胞上添加转染试剂后导入基因。
Q8. 能否同时导入多个基因?
A8. 可以。请准备多种耐药性基因,推荐使用pEBMulti 和 pCAG。
Q9. ScreenFect ™A和ScreenFect ™A plus分别适用于哪种情况?
A9. 通常情况下推荐使用基因导入效率高的ScreenFect ™A plus。但如果其对细胞毒性强或与ScreenFect™A plus相比无性能差异时,推荐使用细胞毒性低且价格实惠的ScreenFect ™A。
Q10. 需要转染siRNA时,推荐使用哪种ScreenFect ™?
A10. 可使用ScreenFect ™ siRNA。视情况,ScreenFect ™A plus也能有效转染siRNA。使用ScreenFect ™siRNA无法达到预期结果时,可考虑两种试剂一同使用。
Q11. 需要转染mRNA时,推荐使用哪种ScreenFect ™?
A11. 可使用ScreenFect ™mRNA。与SFA P-reagent一同使用时,可有效转染mRNA,提高表达水平。
A11. 此外,ScreenFect ™A plus和SFA P-reagent共同使用的最适场景因细胞而异,部分情况下两者共同使用能达到最佳效果。单独使用ScreenFect ™mRNA无法达到预期结果时,可考虑上述两种试剂一同使用。
Q12. SFA P-reagent是什么?
A12. 将质粒DNA或mRNA导入各种细胞时,SFA P-reagent和ScreenFect ™一同使用可提高细胞导入率和转染分子的表达水平。此外,已确认添加SFA P-reagent还能显著降低转染试剂的细胞毒性。
Q13. 有在哪些细胞中的应用实例?
A13. 已在通用细胞系(HeLa、HepG2、MDCK、MCF-7、K562 等)、干细胞、造血细胞(巨噬细胞、THP-1、RAW264.7 等)、小胶质细胞、原代细胞、昆虫培养细胞、鱼类培养细胞及其他细胞中实现基因导入。
A11. 更多详情可查看优化Protocol(日语版/英语版),欢迎联系富士胶片和光获取。
Q14. 是否可提供试用装?
A14. 欢迎向我们联系并填写表格申请试用装。
Q15. ScreenFect ™是什么试剂?
A15. ScreenFect ™是一种由新型阳离子脂质体构成的转染试剂。
Q16. 冷冻存储会对产品性能有影响吗?
A16. 请勿使用冷冻后的产品。
Q17. 如何调整所用的质粒DNA?
A17. 推荐使用阴离子交换柱或氯化铯密度梯度离心法纯化的质粒DNA。
Q18. 血清会影响基因导入吗?
A18. 血清不会影响本产品的性能,但建议转染时避免使用EDTA 和硫酸葡聚糖等阴离子抑制剂。此外,转染时避免使用抗生素也可提高转染效率。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验|
[1] |
Diefenbacher, Markus E., et al. "The LIM Domain Protein nTRIP6 Recruits the Mediator Complex to AP-1-Regulated Promoters." PLoS ONE 9.5 (2014): e97549. |
|
[2] |
Freise, Christian, and Uwe Querfeld. "Inhibition of vascular calcification by block of intermediate conductance calcium-activated potassium channels with TRAM-34." Pharmacological Research (2014). |
|
[3] |
Hagiwara, Akane, et al. "Luteinizing Hormone-Induced Expression of Ptger4b, a Prostaglandin E2 Receptor Indispensable for Ovulation of the Medaka Oryzias latipes, Is Regulated by a Genomic Mechanism Involving Nuclear Progestin Receptor." |
|
[4] |
Peng, Yanyan, Ruidan Xu, and Xiaofeng Zheng. "HSCARG Negatively Regulates the Cellular Antiviral RIG-I Like Receptor Signaling Pathway by Inhibiting TRAF3 Ubiquitination via Recruiting OTUB1." PLoS pathogens 10.4 (2014): e1004041. (3) |
|
[5] |
Wakimoto, Hiroaki, et al. "Targetable signaling pathway mutations are associated with malignant phenotype in IDH-mutant gliomas." Clinical Cancer Research (2014). (2) |
|
[6] |
Fischer, Simon, et al. "Breaking limitations of complex culture media: Functional non-viral miRNA delivery into pharmaceutical production cell lines." Journal of biotechnology 168.4 (2013): 589-600. |
|
[7] |
Bai, Dongmei, et al. "Regulation of the HDM2-p53 pathway by ribosomal protein L6 in response to ribosomal stress." Nucleic acids research 42.3 (2014): 1799-1811. |
|
[8] |
Liu, Xing, et al. "Isocitrate dehydrogenase 2 mutation is a frequent event in osteosarcoma detected by a multi‐specific monoclonal antibody MsMab‐1." Cancer medicine 2.6 (2013): 803-814. |
the 3 hour incubation Dynabeads™ M-280 Streptaviden magnetic beads (7x107 beads, ~100µl/sample) are added to the respective samples (note 1);5.The resultant siRNA/Flag complexes are then eluted with magnetic bead binding, the solution can be discarded
胚胎干细胞的转染而设计的。胚胎干细胞的研究持续升温,但转染始终是个令人头疼的问题。胚胎干细胞似乎“百毒不侵”,抗拒着外来的DNA。Xfect mESC则是从2300多个候选者中脱颖而出的佼佼者,在干细胞转染上有着不俗的表现。经过验证,它在小鼠胚胎干细胞系E14TG2A 和D3中的转染效率均高于市场上畅销的其他试剂。Xfect mESC的价格为2375元/100次。 之后,Clontech又为人成体干细胞研究推出了Xfect™ Adult Stem Cell转染试剂。它的配方经过修改,能在人间
【原创】采用GenEscort™ 转染试剂实施RNA干扰(RNAi)实验进行肿瘤的基因治疗研究
新的策略。 本实验的GenEscort™ Ⅲ基因转染试剂发挥了重要的工具作用,这种非病毒载体相对于病毒载体有许多优点,因而被广泛使用,近年来对 PEI 的改性,已成为研究的热点,以便使其有更好的转染效率和更小的毒性。GenEscort™ Ⅲ是一种多用途的转染试剂,该试剂由可生物降解的超高分枝的PEI衍生物与其它组分复合而成。对各种贴壁细胞有较高的转染效率、也适用于转染悬浮细胞和原代细胞。可用于转染大分子DNA、小分子寡核苷酸和siRNA等。特别适用于携带质粒或DNA、RNA片段用于注射
 技术资料
技术资料需要更多技术资料 索取更多技术资料