相关产品推荐更多 >

三字母:Pro-Leu-Gly-Leu-Ala-Gly PLGLAG多肽 增强纳米颗粒的智能化
¥99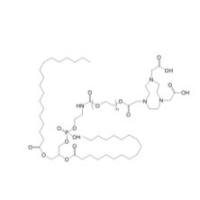
DSPE-PEG-NOTA 磷脂-聚乙二醇-氮杂环辛-烷四乙酸NOTA-PEG-DSPE
¥99
HWKAVNWLKPWT-PEG-DSPE DSPE-PEG-HWKAVNWLKPWT 内毒素亲和肽-聚乙二醇-磷脂
¥99
SRLKEIANSPTQFWRMVARNTLGNGAKQSLNEHARL-PEG-DSPE PD-L1 拮抗肽-聚乙二醇-磷脂
¥99
DSGEGDFLAEGGGVR-PEG-DSPE FpAT-PEG-DSPE DSPE-PEG-FpAT 抗血管生成活性的15肽-聚乙二醇-磷脂
¥99
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 库存:
1000
- 英文名:
DSPE-PEG-VPWMEPAYQRFL
- 保质期:
一年
- 供应商:
深圳市魅罗科技有限公司
- 保存条件:
-20°冷冻保存
- 规格:
50mg
DSPE-PEG-P160 peptide VPWMEPAYQRFL-PEG-DSPE 磷脂聚乙二醇角蛋白1(KRT1)靶向肽
关键产品信息
中文名称: 磷脂聚乙二醇角蛋白1(KRT1)靶向肽
英文名称:DSPE-PEG-VPWMEPAYQRFL
简称 : DSPE-PEG-P160 peptide
品牌: 魅罗科技(MeloPEG)
纯度:95%以上
多肽序列号:Val-Pro-Trp-Met-Glu-Pro-Ala-Tyr-Gln-Arg-Phe-Leu
注意事项
保持干燥
存储条件
-20℃以下冰冻、干燥
应用
KRT1 是一种中间丝蛋白,主要表达于表皮棘层与颗粒层,某些肿瘤细胞(如鳞癌、黑色素瘤部分亚型),炎症或损伤后的皮肤组织中表达上调。
(1)靶向功能:识别并结合 KRT1
肽 VPWMEPAYQRFL 通过序列特异性与 KRT1 蛋白表位结合,可使纳米载体或成像探针选择性富集于 KRT1 高表达的组织。
(2)改善纳米药物的生物分布
依靠 DSPE-PEG 的包覆,系统具有更长的血液循环时间,良好的胶体稳定性,能与脂质体、聚合物纳米粒、固体脂质纳米粒等兼容。
(3)降低系统性毒性,提高治疗效率
将药物精准输送至病灶,而非正常组织,可减少副作用。
(4)作为分子探针平台
可连接荧光团、放射性示踪剂或 MRI 对比剂用于成像。
作用机制
DSPE-PEG-肽 插入到纳米颗粒外膜(如脂质体),形成 “刷状” PEG 层,使靶向肽暴露于表面。
给药后,肽段 VPWMEPAYQRFL 识别 KRT1,促进纳米颗粒在靶组织的滞留,细胞摄取增强(受体介导内吞),递送的药物/探针在靶组织释放,从而实现 靶向治疗或成像。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验Angiogenic Vessel-Targeting DDS by Liposomalized Oligopeptides
of PEGylated liposomes, we synthesized a novel lipid derivative of the peptide, distearoylphosphatidylethanolamine–polyethyleneglycol–APRPG (DSPE–PEG–APRPG). The lipid derivative of APRPG peptide is expected to be readily incorporated into liposomal membrane
-受体特异性结合的方式应用于靶向药物递送系统。短肽在各种受体介导的靶向药物递送系统中的作用受到越来越广泛的研究。 (1)蛙皮素(bombesh,BN)/胃泌素释放多肽(gastrin releasing peptide,GRP)受体介导的靶向药物递送系统:Keller等应用RT-PCR技术及放射配基结合实验对3种肾癌细胞株(A498、ACHN及786-0)进行了分析,结果表明这些细胞株的细胞膜上都有BN/GRP受体的表达。将一种蛙皮素Gln-Trp-Ala-Val-Gly-His-leu-p(CH
结构 (一)二级结构是肽链的空间走向 蛋白质的二级结构是指肽链主链的空间走向(折叠和盘绕方式),是有规则重复的构象。肽链主链具有重复结构,其中氨基是氢键供体,羰基是氢键受体。通过形成链内或链间氢键可以使肽链卷曲折叠形成各种二级结构单元。复杂的蛋白质分子结构,就由这些比较简单的二级结构单元进一步组合而成。 (二)肽链卷曲折叠形成四种二级结构单元 1.α螺旋(α-helix) α螺旋模型是Pauling和Corey等研究α-角蛋白时于1951年提出的。角蛋白是动物的不溶性纤维
 技术资料
技术资料暂无技术资料 索取技术资料




