相关产品推荐更多 >
OriCell人相关干细胞成脂诱导分化试剂盒 HUXXC-90031
¥1691
Goose Ciliary Neurotrophic Factor Receptor ELISA Kit/Goose Ciliary Neurotrophic Factor Receptor ELISA Kit
询价
纤维蛋白原测试盒(半自动凝血仪)厂家现货
¥130
Donkey Pyruvate Dehydrogenase -E1 ELISA Kit/Donkey Pyruvate Dehydrogenase -E1 ELISA Kit
询价
Hamster alpha Synuclein Oligomer ELISA Kit/Hamster alpha Synuclein Oligomer ELISA Kit
询价
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 询价记录
- 文献和实验
- 技术资料
- 库存:
现货
- 英文名:
Dual-Luciferase®Reporter Assay System
- 保质期:
见包装
- 供应商:
北京智杰方远科技有限公司
- 保存条件:
-20℃
- 规格:
100 assays/1000 assays
| 规格: | 100 assays | 产品价格: | ¥1996.0 |
|---|---|---|---|
| 规格: | 1000 assays | 产品价格: | ¥12791.0 |
Promega Dual Luciferase®双萤光素酶报告基因检测系统(萤火虫/海肾萤光素酶检测试剂)E1910/E1960
|
产品名称 |
品牌 |
货号 |
规格 |
保存 |
|
Dual Luciferase®双萤光素酶报告基因检测系统 Dual-Luciferase®Reporter Assay System |
Promega |
E1910 |
100 assays |
-20℃ |
|
Dual Luciferase®双萤光素酶报告基因检测系统10-Pack Dual-Luciferase®Reporter Assay System 10-Pack |
Promega |
E1960 |
1000 assays |
-20℃ |
一、产品概述
遗传报告基因系统目前广泛用于真核基因表达和细胞生理学的研究。其应用领域包括受体活性、转录因子、细胞内信号传导、mRNA 加工和蛋白质折叠等相关研究。双报告基因常被用来提高实验准确性。“双报告基因”这一术语指在一个系统中同时表达和测量两种单独的报告基因酶。一般来说,“实验”报告基因与特定实验条件产生的效应相关,而共转染的“对照”报告基因的活性则提供了可作为基线响应的内对照。将实验报告基因的活性相对于内对照的活性进行归一化处理,可大大降低细胞活性或转染效率差异造成的实验变异性。同时也可有效消除其他造成变异性的因素(例如移液体积、细胞裂解效率和检测效率等)。因此,一般来说,双报告基因检测法可通过减少外部因素影响,实现对实验数据更为可靠的解读。
Dual-Luciferase®Reporter(DLR™)检测系统(a-c)是进行双报告基因检测的有效方法。DLR™ 检测系统可依次测量单个样品中萤火虫(Photinus pyralis)和海肾(Renilla reniformis,也称 sea pansy)萤光素酶的活性。首先通过添加Luciferase Assay Reagent II(LAR II)产生稳定的发光信号,来测量萤火虫萤光素酶报告基因。在完成对萤火虫发光的定量后,通过向同一管中添加Stop & Glo®试剂淬灭该反应并同时启动海肾萤光素酶反应。Stop & Glo®试剂也可产生源自海肾萤光素酶的稳定信号,此信号在测量过程中会缓慢衰减。在DLR™检测系统中,两种报告基因均可产生线性的检测且其灵敏度可达亚阿托摩尔级(subattomole)。而且两种报告基因在实验用宿主细胞中均无内源活性。此外,DLR™检测系统的整合模式可实现两种报告基因在转染细胞或无细胞转录 / 翻译反应体系中的快速定量。
Promega公司可提供专门为配合DLR™检测系统使用而设计的pGL4系列萤火虫和海肾萤光素酶载体。这些载体可与实验和对照报告基因结合使用,共转染哺乳动物细胞。
二、产品详细说明
1.A.Dual-Luciferase Reporter Assay化学反应过程
由于萤火虫和海肾萤光素酶的进化起源不同,因此这两种酶的结构和对底物的要求各不相同。利用这些差异,可选择性地区分其相应的生物发光反应。因此,使用DLRTM检测系统,可淬灭萤火虫萤光素酶反应的发光信号并同时激活海肾萤光素酶的发光反应。
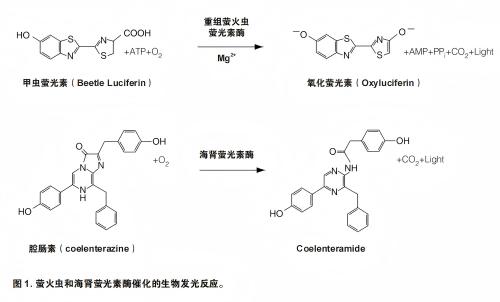
萤火虫萤光素酶是一种分子量大小为61kDa的单体蛋白,无需翻译后加工即具有酶活性(1,2)。因此,该酶在翻译后可立即作为遗传报告基因发挥功能。通过在需要ATP、Mg²和O₂的反应中氧化甲虫萤光素可实现光子发射(图1)。在常规反应条件下,氧化过程通过转换速度极为缓慢的萤光素化-AMP(luciferyl-AMP)中间体实现。因此,此检测方法的化学反应过程中可产生“闪光”型的光信号,其在底物和酶混合后会迅速衰减。
我们用于定量萤火虫萤光素酶的多种萤光素酶检测试剂均含辅酶A(CoA),以便得到更佳的总体反应动力学(3)。在CoA存在的条件下,萤光素酶检测可产生稳定的发光信号且其强度(图2)显著高于常规检测方法的化学反应过程中所产生的信号。萤火虫萤光素酶检测方法灵敏度极高,且酶浓度可涵盖至少七个数量级的线性范围(图3)。
海肾萤光素酶是一种分子量为36kDa的单体蛋白,从其天然来源海肾(Renilla reniformis)纯化得到的酶由3%的碳水化合物组成(4)。如萤火虫萤光素酶一样,该酶无需翻译后修饰即具有活性,且在翻译后可立即作为遗传报告基因发挥功能。海肾萤光素酶催化的发光反应需要氧气和腔肠动物萤光素(腔肠素)的参与(图1)。
2.A.Dual-Luciferase®Reporter Assay化学反应过程(续)
在DLRTM检测的化学反应过程中,海肾萤光素酶反应的动力学可产生稳定的发光信号,但该信号在测量过程中会缓慢衰减(图2)。海肾萤光素酶与萤火虫萤光素酶类似,其催化的发光反应的灵敏度也极高且线性范围一般可涵盖六个数量级(图3)。请注意,发光反应的有效范围可能会因所用发光检测仪的类型不同(例如96孔与单个样品)而异。
腔肠素的固有特性是它在水性溶液中可发出较低水平的自发光。最初,当酶浓度较低时此缺点影响了检测的灵敏度。此外,一些常用于制备细胞裂解物的非离子型去污剂(例如Titon°X-100)可显著增强腔肠素的自发光。DLRTM检测系统中包含专有的化学物质,可将自发光降低至除了最灵敏度的发光检测仪以外的其他设备均无法检测到的水平。Passive Lysis Buffer的配方可大大降低裂解物组分对腔肠素自发光的影响。此外,DLRTM检测系统还包括两种复溶检测试剂(Luciferase Assay Reagent IⅡ和Stop &Glo°试剂),两者结合使用可抑制腔肠素自发光信号。
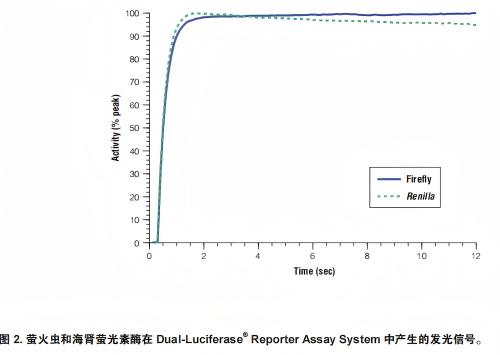
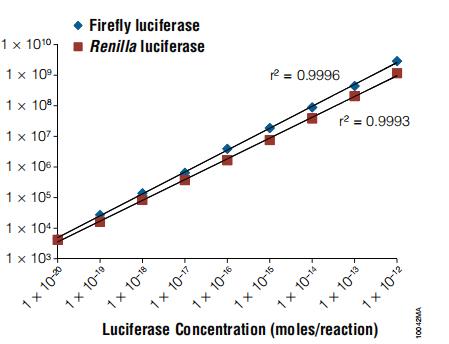
图3.萤火虫和海肾萤光素酶的线性范围比较。使用纯化的萤火虫和海肾萤光素酶混合物(用含有1mg/ml BSA的PLB制备)进行DLRT检测。使用Promega公司GloMax20/20发光检测仪测量发光信号。如图所示,使用DLRT检测系统,萤火虫萤光素酶检测的线性范围为8个数量级,且萤火虫萤光素酶报告基因酶的检测灵敏度≤0.1毫微微克(约为10²¹摩尔)。海肾萤光素酶检测的线性范围涵盖8个数量级,且可检测到约0.1毫微微克(约10²¹摩尔)的海肾萤光素酶。
3.B.Dual-LuciferaseReporter Assay检测模式
制备裂解物后可立即对来自每种萤光素酶报告基因酶的发光信号进行定量,而无需进行分样或其他处理。向LuciferaseAssay Reagent Ⅱ中加入一份裂解物后便可启动萤火虫萤光素酶报告基因检测。在萤火虫萤光素酶反应定量结束后,立即将Stop &Glo°试剂添加至样品管中,以淬灭萤火虫萤光素酶发光信号并同时激活海肾萤光素酶。加入Stop &Glo°试剂后,萤火虫反应产生的发光信号可在1秒内降低10⁵倍(至<0.001%的残余光输出信号)(图4)。与此同时,海肾萤光素酶也在这1秒内被完全激活。当使用手动发光检测仪时,定量两种萤光素酶报告基因活性所需的时间约30秒。该操作流程可概括如下:
|
所需时间 |
|
|
步骤1:将制备好的裂解物手动加入Luciferase Assay Reagent II(已预先分装至发光检测管)中;混匀。 |
约3秒 |
|
步骤2:定量萤火虫萤光素酶活性。 |
12秒 |
|
步骤3:添加Stop & Glo®试剂;混匀。 |
3秒 |
|
步骤4:定量海肾萤光素酶活性。 |
12秒 |
|
整个DLR™ Assay所需时间 |
30秒 |
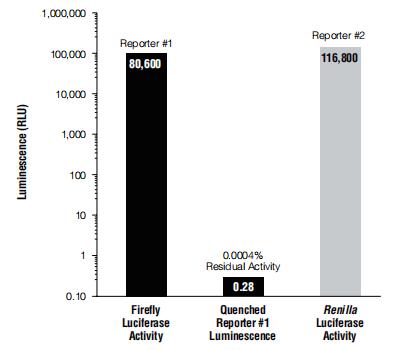
图4.添加Stop &Glo°试剂前后的萤光素酶活性测量值。DLRTM Assay可按顺序先测量萤火虫萤光素酶(报告基因#1),然后在将Stop &Glo°试剂加入反应体系后,再测量海肾萤光素酶活性(报告基因#2)。在同一裂解物样品中(从用pGL3对照载体(目录号:E1741)和pRL-SV40载体(目录号:E2231)共转染的CHO细胞制得)对两种报告基因活性进行了定量。为证明Stop &Glo°试剂可有效淬灭报告基因#1,添加了等体积的Stop &Glo°Buffer(不含海肾萤光素酶的底物)。萤火虫萤光素酶的发光信号淬灭程度超过5个数量级。
4.C.Passive Lysis Buffer
Passive Lysis Buffer(PLB)的配方经过专门的优化,可促进培养的哺乳动物细胞的快速裂解,且不需要刮取贴壁细胞或进行额外的冻融循环步骤(主动裂解)。此外,PLB还可防止样品起泡,因此非常适合高通量应用(在这种应用中,将一系列处理过的细胞在多孔板中培养、加工成裂解物并使用自动化系统进行检测)。虽然PLB是专为被动裂解应用而配制的,但当使用主动裂解方式收获在标准培养皿中培养的贴壁细胞时,其强大的裂解性能同样具有优势。对于培养的哺乳动物细胞而言,无论采用何种裂解方法,萤火虫和海肾萤光素酶报告基因酶向细胞裂解物中的释放都是定量且可靠的(图5)。
除其裂解特性外,PLB还旨在保持萤火虫和海肾萤光素酶报告基因酶的最佳性能和稳定性。与其他细胞裂解试剂不同,PLB的一个重要特征是它仅会引起极低水平的腔肠素自发光信号。因此,当使用DLRTM检测系统处理细胞以定量萤火虫和海肾萤光素酶活性时,PLB是第一选择的裂解试剂。其他裂解缓冲液(例如Glo Lysis Buffer、CellCulture LysisReagent和Reporter Lysis Buffer)会显著增加本底发光信号或不适用于进行被动裂解。如有需要,使用各种常见的化学检测方法便可很容易地定量用PLB制备的细胞裂解物中的蛋白含量。进行蛋白含量测定时,须使用合适的对照进行。建议使用水或不含去污剂或还原剂的缓冲液对裂解物进行稀释,以降低Passive Lysis Buffer对本底吸光度的影响。必须在相同的缓冲液条件下平行生成含有BSA的标准曲线。
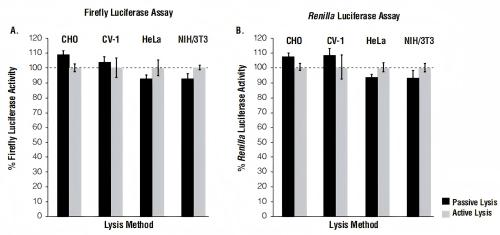
图5.使用被动裂解或主动裂解流程,在用Passive Lysis Buffer制备的细胞裂解物中测得的萤火虫和海肾萤光素酶报告基因活性的比较。将四种不同类型的哺乳动物细胞用萤火虫和海肾萤光素酶表达载体共转染。通过将贴壁细胞暴露于Passive Lysis Buffer中15分钟(被动裂解)或在Passive Lysis Buffer存在的条件下刮取贴壁细胞随后冻融一次(主动裂解)以制备裂解物。为了便于比较,将报告基因活性相对于通过主动裂解方法获得的每种类型细胞的报告基因活性进行了归一化处理。
三、核心特点
1.高灵敏度与宽线性范围
检测下限达10^-18 mol萤光素酶,动态范围跨越6-8个数量级,适合低丰度表达分析。
2.内参校正
Firefly Luciferase(实验报告基因)与Renilla Luciferase(内参报告基因)共转染,后者用于归一化数据,消除系统误差。
3.快速检测
两步反应仅需约20分钟,兼容高通量筛选(如96/384孔板)。
4.即用型试剂
提供预混的裂解缓冲液(Passive Lysis Buffer, PLB)和底物(Luciferase Assay Reagent II, LAR II;Stop & Glo® Reagent),简化操作流程。
四、实验流程
1.样本制备
转染细胞后裂解(使用PLB),离心取上清。
2.检测步骤
Firefly Luciferase活性检测:加入LAR II,测量化学发光信号(560nm)。
Renilla Luciferase活性检测:加入Stop & Glo® Reagent淬灭Firefly信号并激活Renilla信号(480 nm)。
3.数据分析
计算Firefly/Renilla信号比值,归一化后比较不同处理组的基因表达差异。
五、应用场景
◆启动子/增强子活性分析
◆miRNA或siRNA对基因表达的调控研究
◆信号通路关键因子(如转录因子)的功能验证
◆药物筛选(如靶向基因调控的小分子化合物)
六、Dual Luciferase®双萤光素酶报告基因检测系统E1910组分表
|
组分名称 |
组分号 |
规格 |
|
Stop &Glo® Substrate |
E640A |
1 × 200μl |
|
Stop &Glo® Buffer |
E641A |
1 × 10ml |
|
Passive Lysis Buffer,5X |
E194A |
1 × 30ml |
|
Luciferase Assay Substrate |
E151A |
1 × 1 vial |
|
Luciferase Assay Buffer II |
E195A |
1 × 10ml |
七、Dual Luciferase®双萤光素酶报告基因检测系统10-PackE1960组分表
|
组分名称 |
组分号 |
规格 |
|
Stop &Glo* Substrate |
E640A |
10 × 200μl |
|
Stop &Glo* Buffer |
E641A |
10 × 10ml |
|
Passive Lysis Buffer,5X |
E194A |
1 × 30ml |
|
Luciferase Assay Substrate |
E151A |
10 × 1 vial |
|
Luciferase Assay Buffer II |
E195A |
10 × 10ml |
八、注意事项
◆避免反复冻融:试剂建议分装保存,-20℃避光储存。
◆信号稳定性:Firefly信号半衰期约10分钟,需立即检测;Renilla信号更稳定。
◆兼容性:适用于多数发光检测仪(如Glomax®、SpectraMax®)。
九、储存条件
接收后,应将Dual-Luciferase® System置于-20℃存储。配制好萤光素酶检测底物后,应将其分装成单次使用的小份,并于-20℃(最长可储存1个月)或-70℃(最长可储存1年)条件下储存。理想情况下,应在每次使用前新鲜配制Stop&Glo®试剂(底物+缓冲液)。如有必要,该试剂可在-20℃储存15天(活性不会降低)。如果将该试剂在22℃储存48小时,其活性会降低 8%。如置于 4℃储存15天,则试剂活性会降低13%。最多可于室温条件下解冻Stop&Glo®试剂6次,其活性降低程度 ≤15%。
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
- 作者
- 内容
- 询问日期
 文献和实验
文献和实验1. Wood, K.V. et al. (1984) Synthesis of active firefly luciferase by in vitro translation of RNA obtained from adult lanterns. Biochem. Biophys. Res. Comm. 124, 592–6.
2. de Wet, J.R. et al. (1985) Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc. Natl. Acad. Sci. USA 82, 7870–3.
3. Wood, K.V. (1991) In: Bioluminescence and Chemiluminescence: Current Status, eds. P. Stanley and L. Kricka, John Wiley and Sons, Chichester, 11.
4. Matthews, J.C. et al. (1977) Purification and properties of Renilla reniformis luciferase. Biochemistry 16, 85–91.
5. Lorenz, W.W. et al. (1991) Isolation and expression of a cDNA encoding Renilla reniformis luciferase. Proc. Natl. Acad. Sci. USA 88, 4438–42.
6. Farr,A. and Roman, A. (1992) A pitfall of using a second plasmid to determine transfection efficiency. Nucleic Acids Res. 20, 920.
7. Sherf, B.A. et al. (1996) Dual-Luciferase? reporter assay: An advanced co-reporter technology integrating firefly and Renilla luciferase assays. Promega Notes 57, 2–9.
、RNA剪接研究。 萤光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性萤光素酶,一旦转录完成立刻就生成功能性的萤光素酶。单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。Dual-Luciferase®双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。得益于超强的光
In Vivo Dual Luciferase Reporter Assay with Chick Neural Tube In Ovo Electroporation System
luciferase reporter assay system (DLR, Promega, WI, USA) is designed to control for this technical issue by using a co-transfection approach with two separate reporter proteins that emit at distinct wavelengths: one from firefly (Photinus pyralis
被称为报告基因检测法或萤光素酶检测法(Luciferase Assay)。跟普通融合蛋白标签不同,使用荧光素酶构建的报告基因可用作目的基因的定量分析。因此常用于研究启动子、miRNA 3'UTR克隆的功能与调控,因为它们对目的基因的调控可以是渐变的,而不是简单的开和关两种状态。优点:灵敏度高,检测幅度宽;不是哺乳动物细胞内源性基因;重复性好;与HTS兼容等。萤火虫和海肾荧光素酶已经被广泛应用于协同报告并进行均一化研究。由于它们都是快速,容易和高灵敏的监测方法。而且萤火虫和海肾荧光素酶是理想的双基因报告系统