- 详细信息
- 技术资料
一、实验前准备
材料与试剂
Transwell小室(孔径8 μm,聚碳酸酯膜)310
Matrigel基质胶(需提前4℃解冻过夜)1011
无血清培养基、含10% FBS的培养基、PBS、结晶紫染色液、4%多聚jia醛或甲醇510
细胞(需提前饥饿处理18-24小时,使用无血清培养基)59
设备
显微镜、24孔培养板、移液器、棉签、镊子等910
二、实验流程
Matrigel包被Transwell膜
用预冷的无血清培养基或PBS稀释Matrigel(稀释比例1:5~1:8,需预实验优化)310
取50-100 μL稀释后的Matrigel均匀铺于Transwell膜上表面(冰上操作),37℃孵育1小时使其凝固510
细胞悬液制备
消化对数生长期的细胞,用无血清培养基重悬,调整密度至1×10⁵~5×10⁵ cells/mL(需预实验确定最佳密度)5610
组装Transwell系统
下室(24孔板)加入600 μL含10% FBS的培养基(或趋化因子)作为诱导剂910
将Transwell小室插入孔板,上室加入100-200 μL细胞悬液,避免产生气泡310
细胞培养与侵袭
37℃、5% CO₂培养箱中孵育24-48小时(时间根据细胞侵袭能力调整)510
固定与染色
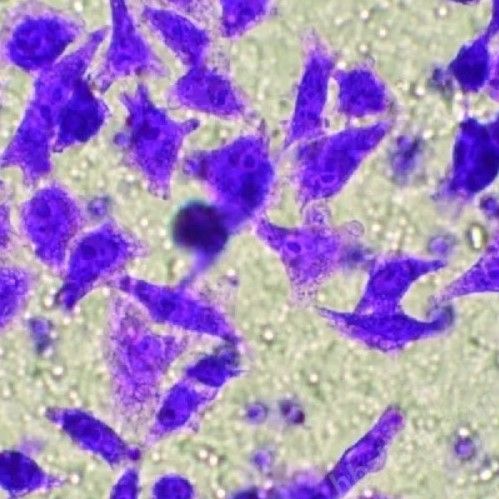
取出小室,用棉签擦去膜上表面未侵袭的细胞910
4%多聚jia醛固定20分钟,0.1%结晶紫染色15-20分钟,PBS清洗后风干510
结果观察与统计
显微镜下随机选取5个视野,计数膜下表面的侵袭细胞19
可选:用33%醋酸溶解结晶紫,570 nm测OD值定量5
三、关键注意事项
基质胶浓度与厚度
浓度过高会抑制侵袭,需根据细胞类型优化(如肿瘤细胞常用1:8稀释)610
细胞密度与活性
密度过高易导致细胞堆积,过低则数据不显著;建议饥饿处理减少增殖干扰56
对照组设置
需设置空白对照(无Matrigel)和阳性/阴性对照(如使用侵袭抑制剂)27
避免操作误差
铺胶时避免戳破滤膜,培养时防止气泡影响趋化梯度1011
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 技术资料
技术资料暂无技术资料 索取技术资料