相关产品推荐更多 >
万千商家帮你免费找货
0 人在求购买到急需产品
- 详细信息
- 文献和实验
- 技术资料
- 保存条件:
-20
- 保质期:
2年
- 英文名:
Plasmid#50661
- 库存:
100
- 供应商:
上海烜雅生物科技有限公司
- 规格:
干粉/液体
名称:pCW-Cas9哺乳编辑质粒
别称: Plasmid#50661
| 启动子: | TRE |
|---|---|
| 复制子: | pUC |
| 原核抗性: | Amp |
| 克隆菌株: | Stbl3 |
| 培养条件: | 37度 |
质粒属性
| 载体宿主: | 哺乳细胞,慢病毒 |
|---|---|
| 载体用途: | 四环素诱导,基因敲除 |
| 基因种属: | |
| 基因类型: | CRISPR,Cas9 |
| 原核抗性: | Amp |
| 真核抗性: | Puro |
| 荧光蛋白: |
质粒简介
pCW-Cas9质粒由上海烜雅生物科技有限公司提供
质粒图谱
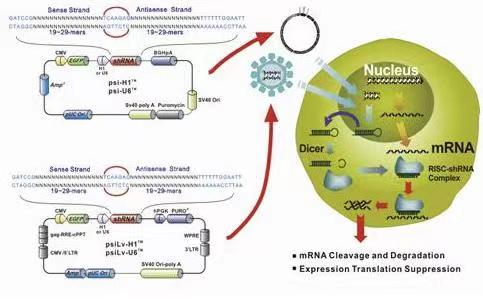
质粒序列:详询
质粒菌株产品操作说明书
一、扩增流程
收到产品后,请先根据产品管壁标签来判断产品形式,并在扩增前准确查找该质粒菌株的抗性、感受态和培养温度。
1、质粒干粉(常温运输,存于-20度,90天保质期,请务必转化挑单克隆培养,不要直接使用和测序)
①收到质粒干粉后请先5000rpm离心1min,再加入20μl ddH2O去离子水溶解质粒;
②取1支100μl 感受态于冰上解冻10min,加入2μl质粒,再冰浴30min后,42℃热激60s,不要搅动,再冰浴2min;(从第二步开始均要在超净工作台中无菌操作)
③加入900μl无抗的LB液体培养基,180rpm震荡37℃培养45min;
④6000rpm离心5min,仅留100μl上清液重悬细菌沉淀,并涂布至目标质粒抗性的LB平板上;(可使用本平台的平板涂布专用玻璃珠进行涂布,可以比传统涂布方法获得更多转化子)
⑤将平板正向培养1h,再倒置37℃培养14h。如果要求是30度则培养20h;
(菌落过多则将质粒稀释后再转化。没有菌落则加入10μl质粒转化。另不要直接转表达感受态,要先转克隆感受态,重提质粒后再导入表达感受态)
⑥挑取单菌落至LB液体培养基中,加入对应抗生素,220rpm震荡培养14h,根据实验需要和质粒提取试剂盒说明书提取质粒。
2、甘油菌种(冰袋运输,存于-80℃,保质期90天,请务必划线挑单克隆培养)
四区划线后挑单菌落培养,酵母菌需要先液体复苏再四区划线,再挑单菌落液体培养。
3、穿刺菌种(冰袋运输,存于4℃,保质期7天)
穿刺接种,液体培养后四区划线,再挑单菌落液体培养。
4、菌落平板(冰袋运输,存于4℃,保质期7天)
直接挑取单菌落至液体培养基中。
5、液体质粒(冰袋运输,存于-20℃,保质期90天)
单独提取的液体质粒收到后可直接使用。
6、滤纸质粒(常温运输,存于-20度,90天保质期,请务必转化挑单克隆培养,不要直接使用和测序)
收到货后将滤纸画圈部分剪下放入EP管中,加100ul无菌水将滤纸浸湿并浸泡5min,吸取5ul质粒转化,离心全涂。
二、转化图片

| P4840/pCIG-IDH1-R132H-EGFP人源基因质粒 |
| P2879/pSLIK-IDH2-R172K-FLAG人源基因质粒 |
| P3000/pECMV-3×FLAG-ISG15(1同义突变)人源基因质粒 |
| P3001/pCDNA3.1-FURIN(1同义突变)人源基因质粒 |
| P4841/pCDNA3.1-MCL1人源基因质粒 |
| P3029/pLNCX2-MEN1人源基因质粒 |
| P3061/IKKalpha (S176ES180E)-pcw107-V5人源基因质粒 |
| P3110/pECMV-3×FLAG-SLC6A11人源基因质粒 |
| P3111/pECMV-3×FLAG-RGS2人源基因质粒 |
| P3112/pLVX-CDC42-HA-IRES-Neo人源基因质粒 |
| P3113/pECMV-3×FLAG-RAN人源基因质粒 |
| P3114/pECMV-3×FLAG-C1orf158人源基因质粒 |
风险提示:丁香通仅作为第三方平台,为商家信息发布提供平台空间。用户咨询产品时请注意保护个人信息及财产安全,合理判断,谨慎选购商品,商家和用户对交易行为负责。对于医疗器械类产品,请先查证核实企业经营资质和医疗器械产品注册证情况。
 文献和实验
文献和实验Cell Rep:上海科技大学季泉江团队开发出高效微型 CRISPR-SpaCas12f1 基因编辑系统
CRISPR-Cas 系统是目前最常用的基因编辑工具,但是由于传统的 Cas 核酸酶分子量普遍太大,使其在在体基因治疗的应用中受限。近年来,为了解决这一难题,小的 Cas 核酸酶逐渐被发现和探究。其中,Cas12f 核酸酶是目前最紧凑的 CRISPR 效应核酸酶,比传统 Cas9 和 Cas12a 核酸酶小一半以上,在临床治疗应用中具有巨大潜力,然而高效的 Cas12f 基因编辑系统仍旧较少。 2022 年 9 月 27 日,上海科技大学季泉江教授团队在 Cell Reports 发表
诺奖得主 Science 发文:基因编辑诞生 10 年,未来将如何改变世界?
3D)。 目前,存在多种用于哺乳动物系统中 CRISPR 基因编辑的递送方式,广泛划分为进入物理递送、基于病毒的递送,以及基于合成材料的递送。常见的物理递送方法包括显微注射和电穿孔,允许控制剂量,效率递送高,但仅限于离体递送。基于病毒的递送方式包括腺病毒、腺相关病毒和慢病毒,它们以质粒 DNA 的形式通过载体传播,具有良好的效率。基于合成材料的递送方法更安全且有高水平的控制和灵活性,但其效率要低于病毒, 递送效率受到材料的体积和阳离子性质的限制,易导致间质分散不良。 因此,改进当前的递送
,从而诱导 CRISPR 结构通过这些空隙进入细胞中。在电脉冲撤离后,细胞恢复原有状态,这种物理学的方式并不影响细胞内部任何代谢及生理变化。BTX 电转和 CRISPR外源物质如何高效的进入目的细胞是进行表达修饰实验(CRISPR、基因编辑、基因工程)成功的关键。BTX 电穿孔系统由于它的易用性、重复性、高效率和低毒性,已经成为将 CRISPR 结构导入细胞(如哺乳动物细胞、细菌、酵母、植物、寄生虫等)的重要手段。使用 BTX 系统可进行多种类型转染;体外培养--贴壁细胞、悬浮细胞及原代细胞·在体·在卵