普康智合(成都)生物制品有限公司
1 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
新研究分享 | 1型猪繁殖与呼吸综合征病毒对猪具有强毒力
212 人阅读发布时间:2025-08-05 09:31
猪繁殖与呼吸综合征(PRRS)仍然是影响全球养猪业最重要的传染病之一。近期在西班牙东北部出现的高致病性PRRSV-1毒株(2020年首次检出),给疾病防控带来了新难题。虽然这些强毒株在田间的危害严重,但是其全面的实验特性尚未得到充分研究。所以本研究针对西班牙新发高致病性PRRSV-1毒株Lleida 029_22,深入开展了遗传溯源、体外复制特性及双感染途径(肌肉注射/滴鼻)致病性机制的系统研究。

近期一项发表于《Wiley Online Library》的研究分析了高致病性PRRSV-1毒株Lleida 029_22的遗传特征与猪致病性。本研究系统发育分析显示,Lleida 029_22毒株属于一个与PRRSV-1 Rosalia疫情相关的新分支,与意大利高致病毒株PR40同源。该毒株在体外能在猪肺泡巨噬细胞和PAM-KNU细胞中高效复制,但不能在MARC-145细胞中复制。
为了评估其致病性,研究通过肌肉注射(IM)和滴鼻(IN)两种途径给8周龄仔猪接种了相同剂量为2×105 TCID50的Lleida 029_22菌株,IM接种导致所有猪在14天内死亡 (100%死亡率),伴随高病毒血症、高病毒排放、显著升高的促炎细胞因子(尤其是IL-6)水平以及严重的肺部病变。相比之下,IN接种猪死亡率较低(30%),临床症状中等,存活猪在63天后康复,但表现出长时间的病毒血症和排毒,且从28天起促炎细胞因子和中和抗体水平均较低。
有趣的是,IN感染真实再现了西班牙农场由高毒力Rosalia毒株引发疫情时的临床症状,而IM感染则凸显了医源性传播的风险。
研究背景:猪繁殖与呼吸综合征病毒(PRRSV)是危害全球养猪业的重要病原,具有高变异性和多样性,导致现有疫苗效果不稳定。2020年,一种名为“Rosalia”的高毒力PRRSV-1毒株在西班牙出现并迅速传播,造成严重损失(如育成期死亡率上升)。遗传分析表明它可能源自意大利高毒株PR40,经变异重组形成。该毒株在田间导致高流产率、死亡率(>20%),但缺乏系统的实验研究数据。
研究目的与方法:本研究旨在通过体外和猪体实验,全面表征分离自Rosalia疫情的高毒力PRRSV-1毒株。特别选用肌肉注射(IM)和鼻内(IN)两种感染途径(IM为常用实验途径,IN模拟自然感染),接种8周龄仔猪。
检测指标:详细记录临床症状与死亡率;对死亡/剖检猪进行大体、显微及免疫组化病理检查;检测血清、唾液、鼻拭子、直肠拭子、组织中的病毒载量并进行病毒分离,以了解病毒动力学与传播潜力;分析PRRSV特异性抗体、中和抗体及血清细胞因子水平,评估免疫反应。
核心意义:此研究将为评估现有疫苗效力、开发新疫苗以及深入理解该高毒力毒株的致病机制提供关键的实验模型和数据基础。
材料与方法
1. 细胞与病毒株
本研究使用的细胞包括:取自5周龄仔猪肺灌洗液的原代肺泡巨噬细胞(PAMs)、采用自Applied Biological Materials公司的永生化PAMs(PAM-KNU)以及非洲绿猴肾细胞(MARC-145)。其中,PAMs和PAM-KNU细胞使用RPMI 1640培养基培养,而MARC-145细胞则使用DMEM培养基培养;所有培养基均添加了10%胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL链霉素(Gibco)。此外,PAM-KNU细胞的生长培养基还额外补充了1 mM 丙酮酸钠、非必需氨基酸、10 mM HEPES、200 µg/mL庆大霉素(Gibco)以及400 ng/mL地塞米松(Sigma-Aldrich)。所有细胞均在37°C、5% CO₂的湿润环境中培养。
本研究所用的PRRSV-1型毒株Lleida 029_22(GenBank:PQ337361)分离自2022年12月西班牙加泰罗尼亚PRRSV疫情暴发中的血清样本。由于该毒株不能在MARC-145细胞中复制,其分离与扩增均使用PAM-KNU细胞完成。为最大限度减少体外选择压力并保持遗传完整性,所有实验均使用第二代(P2)病毒储备液;经PCR检测确认,该储备液PRRSV-1呈阳性,且对PRRSV-2、猪圆环病毒2型和3型、猪细小病毒、猪流感病毒及猪附红细胞体(Mycoplasma suis)等病原体均呈阴性。
2. 全基因组测序与系统进化分析
PRRSV-1 Lleida 029_22株全基因组由PathoSense BV(比利时)基于Oxford Nanopore PromethION平台(R10化学法)测序。经PRRSV引物富集核酸后,使用MinKNOW进行碱基识别,Canu v2.2完成从头组装,Medaka v1.11.1校正。组装序列与GenBank获取的28株PRRSV-1全基因组比对,通过MEGA11的Muscle算法构建多重序列比对,采用GTR+G+I模型的最大似然法生成系统进化树(支持率经1000次自举评估)。
3.多周期生长曲线
将MARC-145、PAM-KNU及原代PAM细胞接种于24孔板(对应培养基培养24小时后),以0.1 MOI的PRRSV-1 Lleida 029_22毒株感染细胞;37℃孵育1小时完成病毒吸附,弃去接种液,用Dulbecco’s磷酸盐缓冲液(DPBS; Gibco)清洗细胞并更换新鲜培养基。分别于感染后0、1、6、24、48及72小时(hpi)收集细胞上清液,-80℃冻存备用,同步按后续流程进行细胞染色。
病毒滴度检测:取上清样品进行10倍梯度稀释,加入铺有PAM-KNU细胞的96孔板,37℃培养3天后染色,每个样品重复3次,采用Spearman-Kärber法计算50%组织培养感染剂量(TCID₅₀/mL)。
4. PRRSV免疫荧光检测
采用免疫荧光法(IFA)检测细胞培养物中的PRRSV:感染细胞经4%多聚甲醛室温固定10分钟,0.1% Triton X-100(DPBS配制)室温透化5分钟;DPBS清洗后,用10%山羊血清(Sigma)室温封闭30分钟,再次清洗后加入靶向PRRSV N蛋白的1AC7单抗。室温孵育1小时,清洗后加入Alexa Fluor 594标记山羊抗鼠IgG二抗(Invitrogen)及核染料Hoechst 33342(Invitrogen)共孵育30分钟;最后用DPBS清洗,在尼康ECLIPSE Ts2R荧光显微镜下观察。
5. 动物实验设计
25头8周龄PRRSV阴性公猪分三组独立饲养:适应期后,第1组(10头)肌肉注射2×10⁵ TCID₅₀病毒(颈部2mL),第2组(10头)鼻腔喷雾接种(每鼻孔1mL),第3组(5头)作阴性对照。每日监测临床症状(行为、呼吸消化系统症状)并记录体温(≥39.5°C持续监测),按0-3分制评分后取均值。定期采集血清等样本(0-63dpi共11次)冻存。63dpi或濒死时剖检,肺部病变0-3分评级,取多器官新鲜组织测病毒载量,福尔马林固定组织作病理分析(神经症状者加取脑组织)。
6. 组织匀浆制备
剖检组织剪碎后,经含1%双抗及两性霉素B的DPBS过筛;4℃ 5000×g离心30分钟取上清冰存,沉淀用DPBS重悬后经三次冻融再离心,合并两次上清得组织匀浆,-80℃冻存备用。
7. RT-qPCR检测病毒载量
用MagMAX CORE试剂盒提取血清等样本的病毒RNA,经VetMAX试剂盒RT-qPCR检测(Applied Biosystems 7500系统,96孔板,设阴阳对照);CT≥40判阴性,结果以40-CT值表示,并计算感染后14日内的AUCp(梯形法)。
8. 血清细胞因子检测
采集感染后0、3、7、12-14天血清细胞因子:ELISA法检IFNα试剂盒(Sigma-Aldrich)测定,Luminex 200系统(Merck)检测IL-1α/β/2/6/12采用Sigma-Aldrich MILLIPLEX猪细胞因子/趋化因子磁珠面板,按标准曲线计算浓度,双重复均值报pg/mL。
9. PRRSV特异性抗体检测
采用PRRS X3 ELISA试剂盒(IDEXX)检测感染后63天内血清的PRRSV特异性抗体,结果以S/P比值表示,比值 ≥0.4即判为阳性。
10. PRRSV中和抗体检测
在PAM-KNU细胞上进行病毒中和试验测定血清PRRSV中和抗体效价:热灭活血清从1:4起倍比稀释,与400 TCID₅₀的PRRSV-1 Lleida 029_22毒株在37°C共同孵育1 小时,将混合物转至细胞培养3天后,经IFA染色镜检,病毒中和抗体效价定义为:使荧光病灶较对照减少90%的最高血清稀释度的log₂值。
11. 动物样本病毒分离
取RT-qPCR阳性样本(血清、唾液、鼻拭子、直肠拭子及组织匀浆)进行病毒分离:样本自1:5倍比稀释,接种PAM-KNU细胞37°C吸附2小时,洗涤换液后培养3天,IFA染色镜检,任一稀释度见荧光病灶判为阳性;阳性血清进一步10倍梯度滴定测定感染性病毒量,以log₁₀(TCID₅₀/mL)表示。
12. 组织病理学评估
剖检组织经H&E染色后由双盲认证病理学家评估病变:肺部按间质性肺炎严重程度5分制评分(0=无病变;1=轻度局灶;2=中度多灶;3=中度弥漫;4=重度弥漫);淋巴器官评分:0=无病变;1=滤泡轻度增生无坏死/减少;2=增生伴多灶坏死及轻度减少;3=中度增生伴多灶坏死及中度减少;4=重度增生伴弥漫坏死及中重度减少。
13. 免疫组织化学检测PRRSV抗原
免疫组化法检测组织PRRSV抗原:3µm切片脱蜡水化后,3% H₂O₂阻断内源酶30分钟;PBS洗,0.1%蛋白酶XIV(37℃)抗原修复30分钟;10%山羊血清室温封闭30分钟;加PRRSV N单抗1AC7 4℃过夜;PBS洗后加HRP-多聚二抗孵育30分钟,DAB显色;苏木素(Sigma-Aldrich)复染,DPX封片;PRRSV PCR阳性组织为阳性对照,一抗替代为阴性对照。
14. 统计分析
数据经Shapiro-Wilk检验正态性后,各时间点三组间两两比较:正态数据用方差分析,非正态用Wilcoxon检验;感染后14天内血清、唾液、鼻肛拭子、ELISA的AUCp及感染63天死亡的动物组织学评分均按正态性选用相应检验进行组间比较;针对前14天同一动物重复测量数据(体温、临床评分、RT-qPCR、ELISA),采用线性混合模型分析(组别、天数为固定效应,动物为随机效应)。P<0.05为显著,0.05≤P<0.10为趋势。图表用GraphPad Prism 10.1.1绘制。
结 果
1. PRRSV-1毒株的系统发育特征分析及其Nsp2氨基酸序列特征
基因组特征与系统发育定位:
深度测序(286×)证实PRRSV-1 Lleida 029_22株基因组全长14,858 nt(图1A),系统发育归属PRRSV-1亚型1谱系。该毒株与另3株Rosalia疫情相关毒株构成独立分支(图1A),核苷酸同源性96.61%-97.26%,且与高致病性PR40毒株同源。
Nsp2缺失特征分析:
Lleida 029_22株Nsp2蛋白存在63个氨基酸缺失(第317-379位,相对于Lelystad毒株)(图1B)。此缺失为Rosalia分支保守特征,而其同源毒株PR40缺失区域更大(图1A),提示该遗传变异形成于分支进化早期。
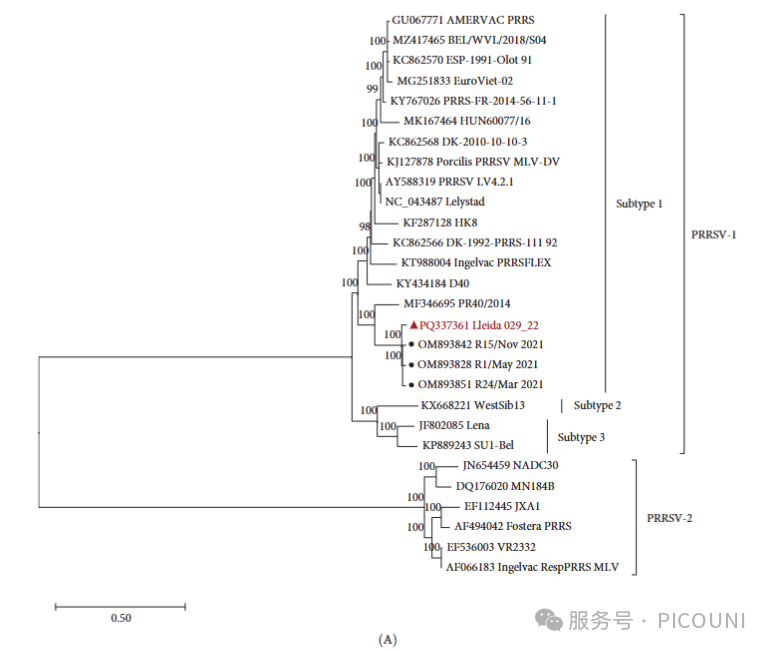

图1. PRRSV-1 Lleida 029_22株系统发育树与Nsp2序列比对
(A)基于全基因组序列构建的最大似然系统发育树(GTR模型,1000次自举检验)。
▲:本研究Lleida 029_22株;●:Rosalia疫情相关毒株。
(B)Nsp2部分氨基酸序列比对(CLUSTAL Genomics Workbench 24.0.1)。
比对毒株:Lleida 029_22、Rosalia疫情相关株、高毒力PR40株及原型株Lelystad。
*注:Nsp2,非结构蛋白2;PRRSV-1,猪繁殖与呼吸综合征病毒1型。
2. PRRSV-1 Lleida 029_22毒株的体外复制特性
首先在体外评估Lleida 029_22毒株的复制特性。该毒株在PAMs和PAM-KNU细胞中可有效复制,但在MARC-145细胞中未见复制(图2A)。三类细胞的病毒生长曲线实验显示,PAMs和PAM-KNU细胞中的病毒滴度呈现相似的复制模式,但后者的病毒滴度略低(图2B)。72小时时,两种细胞均达到约10⁵TCID₅₀/mL的病毒滴度。相比之下,MARC-145细胞无法维持病毒的有效感染,病毒滴度在72小时后降至无法检测的水平。
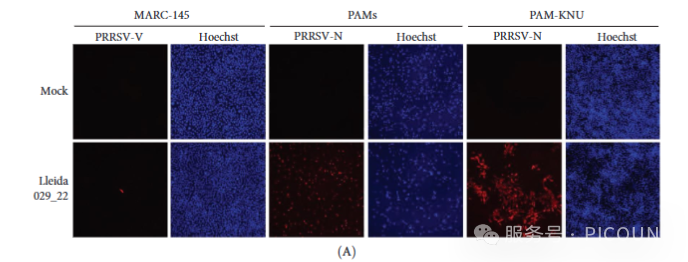
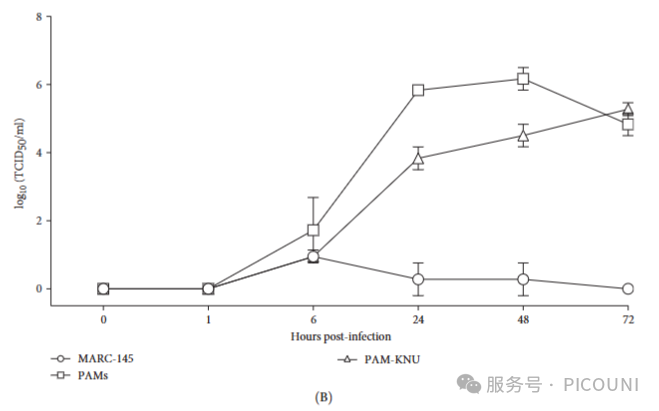
图2. PRRSV-1 Lleida 029_22株在三种细胞中的生长动力学
(A)感染72h后荧光显微观察(MOI=0.1,抗N蛋白抗体染色;20×物镜)
(B)PAM-KNU细胞中病毒滴度动态(三个独立实验均值±SD)
*注:MOI,感染复数;PAM,原代肺泡巨噬细胞;PRRSV-1,猪繁殖与呼吸综合征病毒1型。
3. Lleida 029_22毒株感染后猪的临床表现与死亡率
通过肌肉注射(IM)和鼻腔接种(IN)两条感染途径评估PRRSV-1 Lleida 029_22毒株的致病性。肌肉注射组猪只体温在1dpi开始升高,7dpi时突破41℃,并持续至13dpi。而鼻腔接种组的发热反应较弱,仅在5dpi时短暂升至41℃以上,随后呈现间歇性发热模式。对照组在整个实验期间均未出现体温异常(图3A)。
临床观察显示:IM感染组出现急性呼吸窘迫、神经症状、严重呼吸困难及耳部和阴囊发绀;IN感染组主要表现为中度持续性呼吸困难。两组感染动物均观察到被毛粗乱、水肿(以四肢和颈部明显)、关节炎症及整体体况恶化等附加临床症状,但IM组症状更为严重。这些重症临床表现主要集中在12-14dpi期间,与该阶段大量死亡或因福利原因实施的时间窗相吻合。
总体而言,IM感染组在感染后11、12和14天的临床评分显著高于IN感染组 (p<0.05),且14dpi时达到峰值(图3B)。IN组临床评分较低,13dpi时达最高值,随后症状逐渐减轻,但评分仍显著高于对照组(p<0.05)。对照组全程未观察到任何临床症状(图3B)。
通过线性混合模型分析(考虑同一动物在不同时间点的观察值非独立性)发现,前14天内组别和日别变量对体温和临床评分的影响均具有统计学差异(p<0.05)。特别需要指出的是,IM组与IN组之间,以及两个感染组与对照组之间均存在显著差异。
生存分析显示:IM感染组在14dpi前全部死亡,死亡率为100%,自然或诱发死亡集中在12-14dpi;IN感染组在63dpi时死亡率为30%,死亡时间点分别为12、21和43dpi。对照组动物全部存活至实验结束(图3C)。
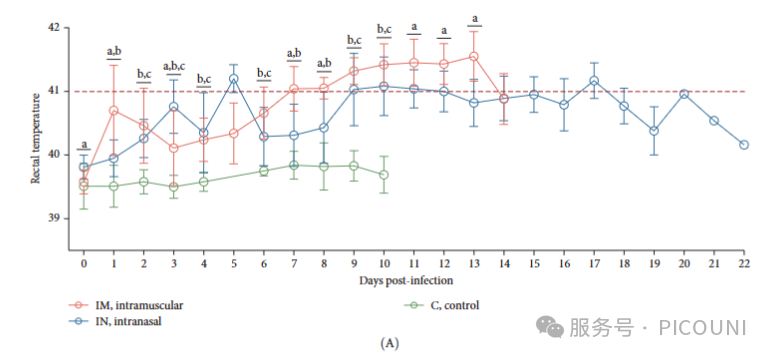
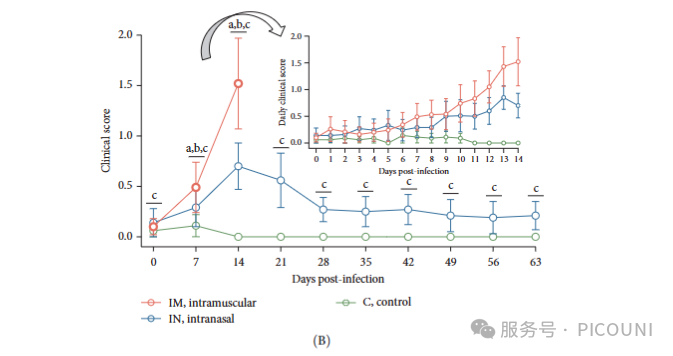
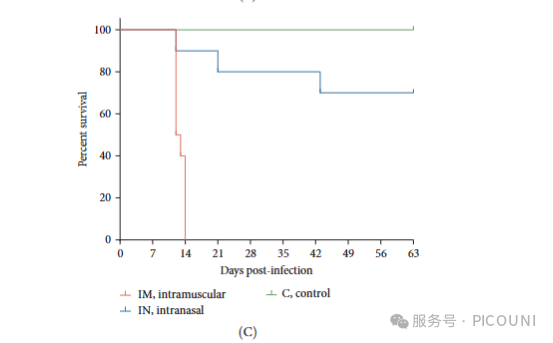
图3. PRRSV-1 Lleida 029_22株感染猪的临床结果
(A) 感染后每日直肠温度(红色虚线:发热阈值>41℃;均值±SD)
(B) 每日平均临床评分(均值±SD;相同字母示组间无显著差异,p<0.05)
(C) 实验组生存曲线
注:C,对照组;IM,肌注组;IN,鼻内组。
4. PRRSV感染动物的病毒血症与病毒排毒检测
通过RT-qPCR检测PRRSV-1 Lleida 029_22感染后的病毒血症水平。3dpi时所有感染动物血清均可检测到PRRSV RNA,IM和IN组与持续阴性的对照组相比具有显著差异(p<0.05;图4A)。IN组病毒血症在7dpi达峰值,而IM组在7和14dpi的病毒载量均显著高于IN组和对照组(p<0.05)。此后IN组病毒载量逐渐下降,但至28dpi仍显著高于对照组。
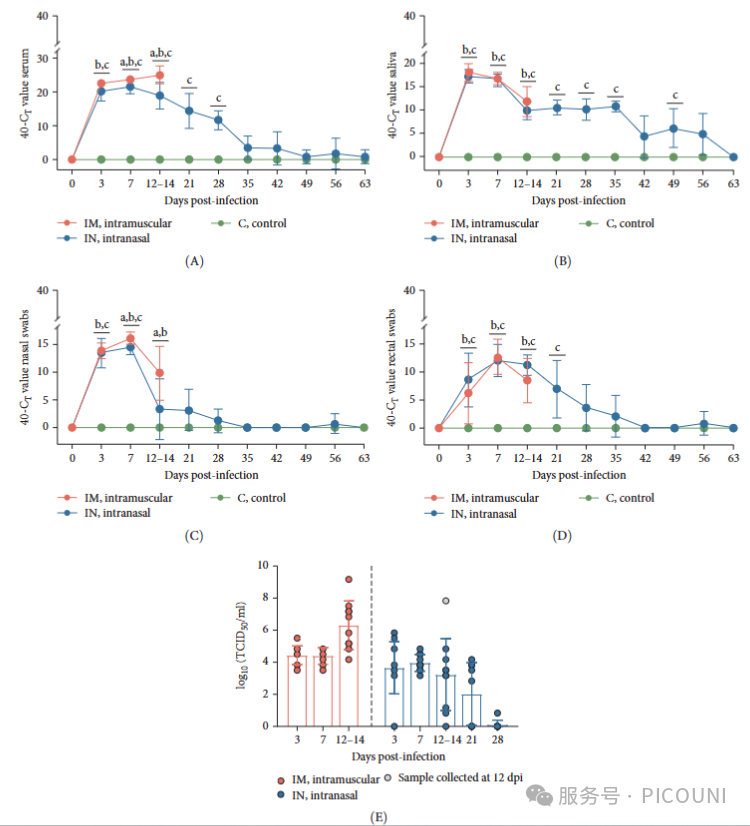
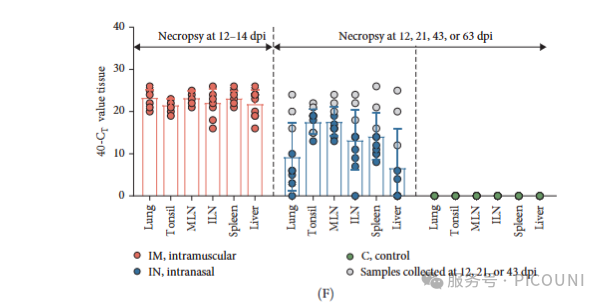
图4. 通过唾液及鼻/直肠拭子检测病毒排毒情况。所有感染动物在3dpi时唾液、鼻腔及直肠拭子均呈阳性。
唾液排毒:IM组持续至14dpi,IN组持续至实验结束(峰值3dpi;图4B)
鼻腔排毒:两组峰值在7dpi,且IM组7/14dpi载量显著高于IN组(*p*<0.05;图4C)
直肠排毒:IM组持续至14dpi,IN组至35dpi(56dpi微弱反弹),峰值均为7dpi(图4D)
AUC分析证实:感染组所有样本载量显著高于对照组,且IM组鼻拭子载量高于IN组(*p*<0.05)。综上,PRRSV感染后排毒早发且持久。
5. RT-qPCR阳性样本中传染性PRRSV的分离验证
为确认RT-qPCR阳性样本中是否存在传染性病毒,采用PAM-KNU细胞进行病毒分离(VI)实验(图5)。血清样本中,IM组在3-14dpi采集的样本病毒分离成功率为100%(10/10),IN组3-7dpi为100%(10/10),但14dpi(70%)、21dpi(55.6%)和28dpi(12.5%)时成功率逐渐下降。
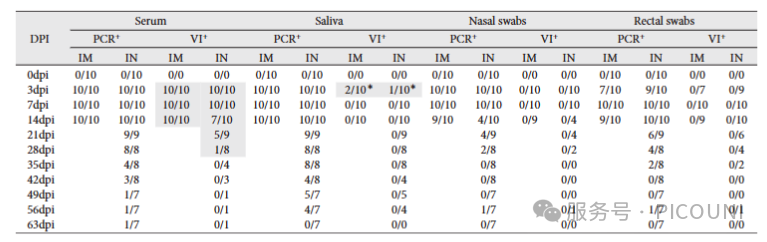
图5. 两组感染动物在3dpi采集的唾液样本经两代培养后成功分离出3株传染性病毒。鼻拭子和直肠拭子样本均未分离到传染性病毒。
6. PRRSV-1 Lleida 029_22感染诱导的细胞因子反应
感染后前14天采集血清样本检测细胞因子水平,发现三组动物呈现显著差异(图6)。两个感染组在3、7和14dpi时IFN-α水平均显著升高(p<0.05),且IM组在14dpi时高于IN组(p<0.05)。促炎细胞因子IL-1α、IL-12和IL-6呈现相似变化趋势:IN组在3dpi即出现升高且维持稳定,而IM组在7和14dpi时显著高于对照组(图6B,D-E)。特别需要指出的是,14dpi时IM组的IL-6水平显著高于IN组(p<0.05)。两组感染动物的IL-1β均呈现升高趋势,IM组在3、7和14dpi均显著高于对照组,而IN组仅在14dpi时差异显著(图6C)。
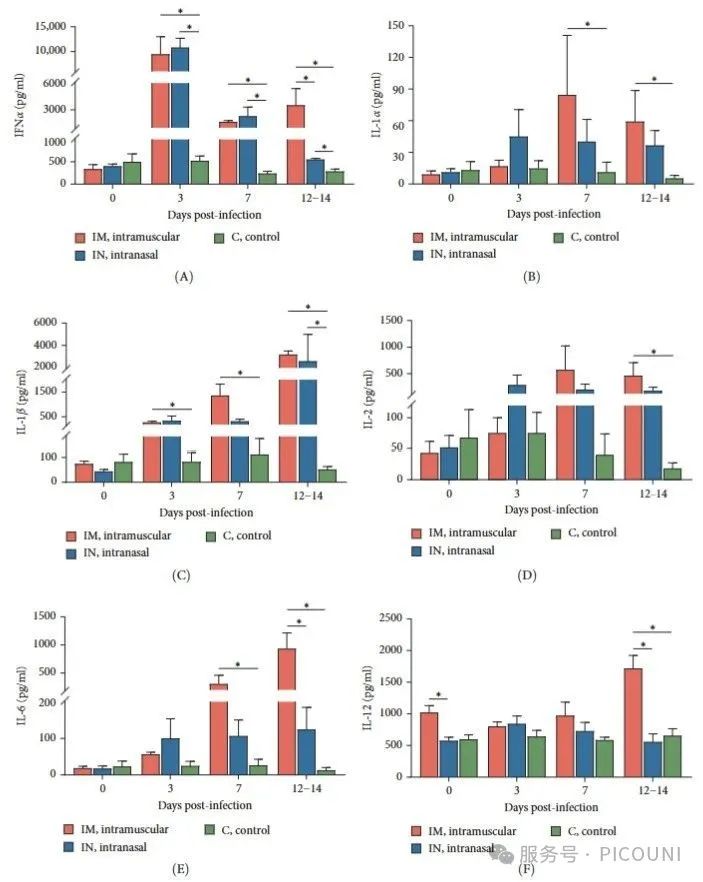
图6. IL-12在14dpi时IM组显著高于IN组和对照组(图6F),整体趋势显示IM组的促炎细胞因子反应更强,尤其在7和14dpi时的IL-6水平,这与IM组100%的高死亡率呈正相关。
7. PRRSV-1 Lleida 029_22感染动物的特异性抗体与中和抗体反应
采用商业ELISA试剂盒检测PRRSV-1和PRRSV-2特异性抗体(图7A)。IM组在14dpi时70%动物发生血清转化,IN组为90%,两组S/P比值均显著高于对照组(p<0.05)。IN组抗体水平在21dpi开始下降,42dpi时保持稳定,56dpi时回升后在63dpi轻微下降。整个实验期间对照组均保持血清学阴性(S/P<0.4)。
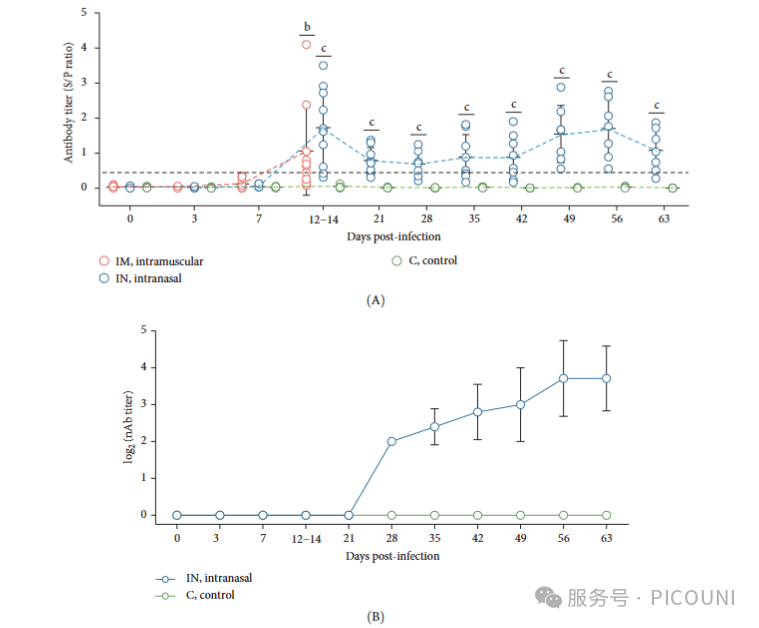
图7. 中和抗体检测显示,IN组在28dpi时仅检测到2log₂的低滴度抗体,随后逐渐升高至56dpi时的3.71 log₂(图7B)。抗体滴度在相同时间点不同个体间存在差异,中和抗体的出现与28dpi后血清中传染性病毒的清除相一致(图4B)。对照组未检测到中和抗体。
8. PRRSV-1 Lleida 029_22在组织匀浆中的检测与分离
采用RT-qPCR检测不同组织中的病毒载量(图4F)。IM组各组织病毒载量相对一致,肺、纵隔淋巴结和脾脏中载量最高。IN组不同组织载量差异显著,以扁桃体和纵隔淋巴结载量最高。正如预期,IN组整体病毒载量低于IM组,这可能与剖检时间不同有关。IN组感染动物组织载量的显著变异性也与死亡时间不同相关(12、21和43dpi的灰显样本与63dpi)。对照组所有组织样本均未检测到病毒RNA。
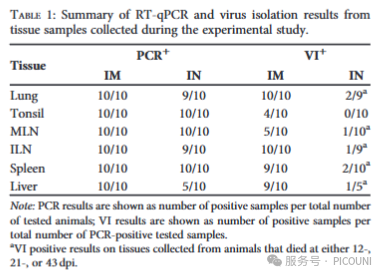
表1. 在12、21或43dpi时死亡的动物采集的组织中,aVI呈阳性结果。
(表注:表1为组织样本的RT-qPCR与病毒分离结果汇总表,"MLN"为纵隔淋巴结,"ILN"为腹股沟淋巴结)
9. PRRSV感染组织的病理学与免疫组化分析
剖检发现: 感染PRRSV后死亡的动物(尤其是12-21天死亡的)全身可见明显病变,包括皮肤发紫、全身水肿、淋巴结严重肿大、脾脏肿大(有时伴滤泡增生)以及胃出血。肺部病变显著,表现为部分塌陷不全、多灶性实变、红褐色斑块,符合间质性肺炎特征,且早期死亡动物病变更重(图8A)。约20%鼻内感染的动物还出现了继发细菌感染引起的脓肿、心包炎和关节炎。对照组动物未见肉眼病变。
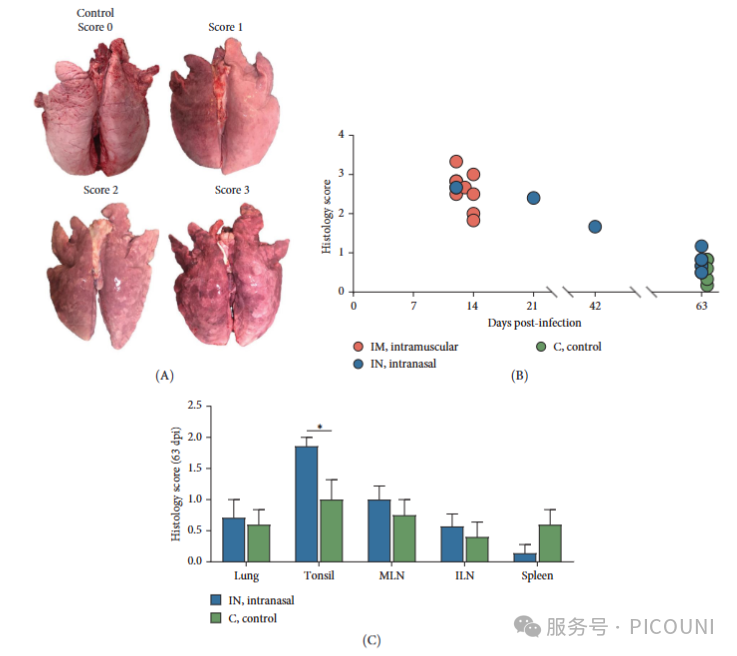
图8. 组织病理学分析显示:IM和IN组早期死亡(12-21dpi)动物的间质性肺炎病理评分在1.83-3.33分,而63dpi处死的动物病理评分显著降低(对照组0.17-0.83分,IN组0.50-1.17分)。特别需要指出,63dpi时IN组扁桃体组织学评分显著高于对照组(p<0.05),但其它组织无显著差异(图8C)。
(图注说明:图8B为组织病理学评分,图8C为63dpi时各组组织学评分对比)
显微病理学显示:感染动物肺部均显示间质性肺炎(肺泡壁增厚、细胞增生和炎症细胞浸润),肺泡内有渗出物和坏死组织,血管也有损伤迹象。淋巴组织(淋巴结、脾脏)出现淋巴细胞严重减少、坏死,并伴有血管损伤(如血栓、血管炎)。脑部白质可见血管周围炎症细胞浸润、水肿和胶质细胞增生(图9A)。
免疫组化(IHC)分析检测到
在感染动物的肺、淋巴结、扁桃体和脾脏的巨噬细胞内,以及偶尔在II型肺泡细胞内,检测到了PRRSV抗原(图9B)。脑部血管周围的炎症细胞中也检出了病毒抗原。
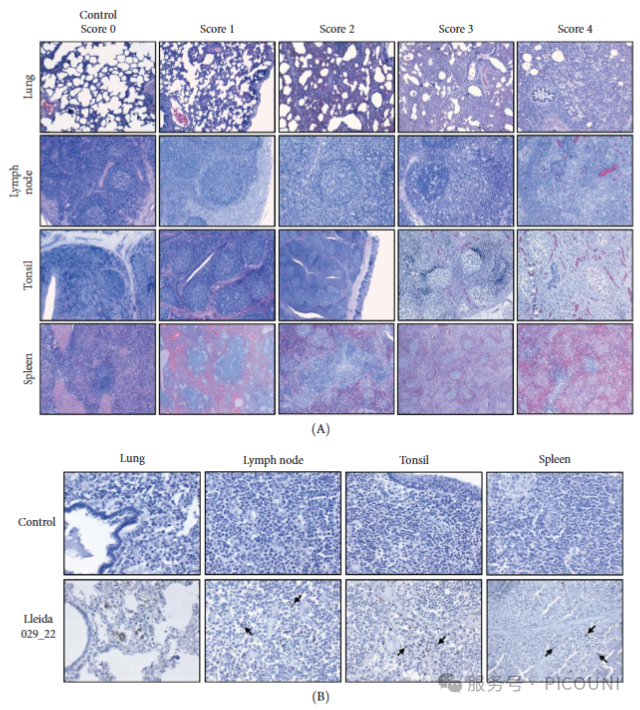
图9. PRRSV感染导致肺、淋巴组织和脑部的广泛病理损伤,并主要定位于巨噬细胞内,呈现系统性病变特征。
讨 论
PRRSV对单核细胞系具有限制性嗜性,传统上使用肺泡巨噬细胞(PAM)和 MARC-145细胞进行分离培养。然而,PAM获取困难且批次差异大,高致病性毒株也难以适应MARC-145。本研究采用对某些田间毒株敏感的永生化细胞系PAM-KNU替代 PAM,成功分离出Lleida 029_22 毒株,其生长曲线与在PAM中相似。目前尚无适用于所有PRRSV毒株的通用细胞系,未来需寻找更多适用的细胞系用于不同毒株的分离。
结 论
本研究成功建立了高毒力PRRSV-1毒株的经鼻感染模型,其临床表现(高死亡率、严重症状、持续高热、病毒血症)与田间疫情高度相似。关键发现是感染途径显著影响结果:肌注(IM)感染导致100%急性死亡,而经鼻(IN)感染死亡率仅为30%,且感染猪最终完全康复。这种巨大差异凸显了农场肌注操作可能通过医源性传播显著加剧疫情严重性的风险。
产 品 推 荐
⬇

END

地址:成都天府国际生物城(双流区凤凰路269号14栋1单元1001)






