杭州斯达特生物科技有限公司品牌商
2 年
手机商铺
- NaN
- 0.10000000000000009
- 0.10000000000000009
- 2.1
- 2.1
推荐产品
技术资料/正文
JAK/STAT信号通路研究全景:从分子机制到疾病解析,斯达特与您同行
537 人阅读发布时间:2025-08-25 09:57
JAK/STAT信号通路作为首个被发现的跨膜信号转导途径,历经30余年研究,已成为解码生命活动的核心枢纽。这条由50+种细胞因子、30+个受体、4类JAK激酶(JAK1/JAK2/JAK3/TYK2)及6种STAT蛋白(STAT1-6)构成的信号网络,不仅是细胞外刺激(如干扰素、白介素、生长因子)向核内基因表达传递的“分子桥梁”,更通过动态激活与负调控机制(如CIS/SOCS抑制、PTP去磷酸化),精准调控造血、免疫、组织修复等关键生理过程。
JAK/STAT通路机制
一、组成与功能
JAK/STAT通路是进化保守的“信号转导铁三角”,其组成可划分为四大核心模块,各模块协同完成细胞外信号向核内基因表达的传递:
第一类是配——受体复合物,作为通路的“信号入口”。配体主要为50余种细胞因子(如干扰素IFN、白介素IL-6/23、生长因子)及部分生长因子,受体则包括30余种跨膜蛋白(如IL-6R、IFNAR、EPOR),二者结合后触发受体二聚化,为后续信号传递奠定基础。
第二类是JAK激酶家族,作为“信号桥梁”。包含JAK1、JAK2、JAK3、TYK2四个成员,结构上均含FERM(与细胞骨架互作)、SH2(识别磷酸酪氨酸)及激酶结构域(含催化活性中心)。其中JAK1/2/3广泛表达于造血、免疫细胞,TYK2主要分布于淋巴系统及内皮细胞,分别介导不同细胞因子的信号转导(如JAK1/3参与IL-6/IL-23通路,TYK2调控IL-12信号)。
第三类是STAT蛋白家族,作为“转录执行者”。由STAT1-6共6个成员构成,结构包含N端(稳定二聚体)、卷曲螺旋(维持构象)、DNA结合(识别特定序列)、连接(调控活性)、SH2(结合磷酸酪氨酸)及转录激活(招募共激活因子)结构域。其中STAT1/3/5稳定性高,主要介导促炎或增殖信号;STAT4/6易被泛素降解,参与Th1/Th2分化等特异性免疫反应。
第四类是负调控因子,作为“信号刹车”。包括CIS/SOCS家族(通过结合JAK或受体抑制磷酸化、诱导降解)、PIAS蛋白(阻断STAT与DNA结合)、PTP磷酸酶(去磷酸化JAK/STAT或受体),三者共同防止通路过度激活,维持细胞稳态。
二、激活与负调控
激活流程
经典JAK-STAT信号通路的激活起始于细胞外信号分子与靶细胞表面受体的特异性结合,这一结合触发受体发生二聚化,暴露其胞内段的酪氨酸磷酸化位点。此时,与受体胞内段结合的JAK激酶被激活,通过自身激酶结构域对受体胞内段的酪氨酸残基磷酸化,形成STAT蛋白的停靠位点。随后,STAT蛋白凭借其SH2结构域识别并结合受体上的磷酸化酪氨酸位点,被JAK激酶进一步磷酸化,形成活化的STAT二聚体。最终,STAT二聚体脱离受体复合体,通过核孔进入细胞核,与特定DNA序列(如γ-干扰素激活序列γ-ISE)结合,招募转录共激活因子,启动或抑制下游靶基因的转录,从而调控细胞增殖、分化、免疫应答等生物学过程。这一过程受CIS/SOCS、PIAS等负调控因子的精密调控,防止信号过度激活,维持细胞稳态。
负调控机制
JAK-STAT通路的负调控由CIS/SOCS家族(抑制JAK活性或诱导降解)、PIAS蛋白(阻断STAT与DNA结合)及PTP磷酸酶(去磷酸化降低活性)共同介导,三者协同作用,形成“激活-抑制”的动态平衡,防止JAK-STAT信号过度激活导致的细胞功能紊乱,是维持免疫稳态、避免炎症失控及肿瘤发生的关键保护机制。
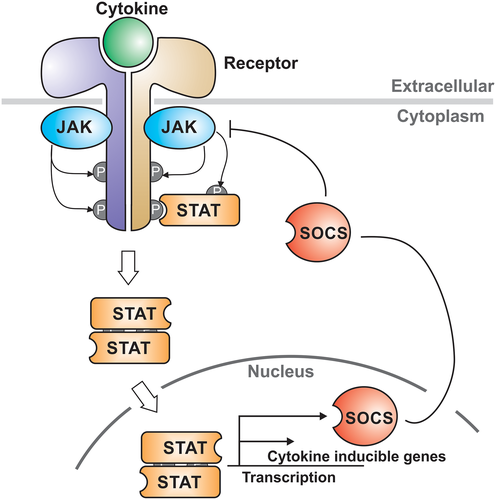
图1 JAK-STAT通路示意图。
JAK/STAT与疾病
作为连接细胞外信号与核内命运的“信号枢纽”,JAK/STAT通路既是生命科学的经典模型,更是未来创新药物研发与疾病机制解析的“黄金靶点”。每种细胞因子受体招募并使用特定的JAK激酶组合,这对各种疾病实体中JAK的治疗靶向具有重要意义。
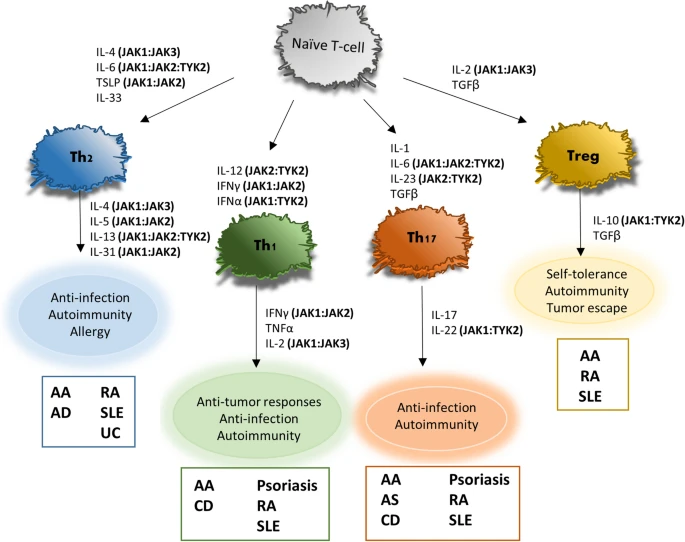
图2 参与 T 细胞分化和功能的细胞因子。
类风湿关节炎(RA)
AK-STAT通路在RA中主要通过IL-6/JAK1-STAT3轴驱动关节炎症:IL-6与关节滑膜细胞表面IL-6R结合,激活JAK1/3激酶,进而磷酸化STAT3,促进促炎因子(如TNF-α、IL-17)分泌,加剧软骨破坏与骨侵蚀。临床治疗中,泛JAK抑制剂托法替尼(抑制JAK1/3)与巴瑞替尼(抑制JAK1/2)通过阻断该通路,显著降低炎症因子水平,改善关节肿胀与疼痛(托法替尼联合甲氨蝶呤ACR50应答率约55%);靶向IL-6R的生物制剂托珠单抗则直接阻断IL-6信号传导,适用于对传统DMARDs反应不佳的患者。
炎症性肠病(IBD)
IBD(包括克罗恩病CD与溃疡性结肠炎UC)的JAK-STAT通路异常呈现亚型差异:CD以Th1/Th17型免疫应答为主,IL-12/IL-23通过JAK2/STAT4/STAT3轴激活促炎细胞因子(如IFN-γ、IL-17);UC则以Th2型为主,IL-13通过JAK1/STAT6轴诱导杯状细胞分化异常。治疗上,托法替尼(JAK1/3抑制剂)已获批用于UC(改善黏膜愈合率约30%),但对CD疗效有限(II期未达主要终点);生物制剂乌司奴单抗(抗IL-12/23)通过阻断JAK2/STAT4通路,对CD与UC均显示显著疗效(临床缓解率约40%)。此外,JAK抑制剂菲格替尼(JAK1/3)在CD II期试验中显示出黏膜愈合潜力,但需进一步验证长期安全性。
银屑病及银屑病关节炎(PsO/PsA)
PsO与PsA的核心驱动是IL-23/TYK2-STAT3轴:IL-23与树突状细胞表面IL-23R结合,激活TYK2激酶(JAK家族成员),进而磷酸化STAT3,诱导Th17细胞分化并分泌IL-17/IL-22,导致角质形成细胞过度增殖(PsO)及关节炎症(PsA)。突破性药物氘可来昔替尼(TYK2变构抑制剂)通过选择性结合TYK2假激酶结构域,阻断IL-23信号传导,显著降低PASI评分,且避免了传统JAK抑制剂(如托法替尼)的JAK2相关血液学毒性。此外,托法替尼(JAK1/3抑制剂)虽未获批PsO,但对PsA关节症状改善有效(ACR50应答率约45%)。
特应性皮炎(AD)
AD的JAK-STAT通路异常以IL-4/IL-13-JAK1-STAT6轴为主导:IL-4/IL-13与肥大细胞/嗜碱性粒细胞表面IL-4Rα结合,激活JAK1激酶,磷酸化STAT6后诱导IgE分泌及Th2细胞极化,加剧皮肤炎症与瘙痒。治疗药物中,JAK1抑制剂巴瑞替尼(抑制JAK1/2)通过阻断该通路,显著降低EASI评分);新型JAK1抑制剂PF-04965842(III期试验)在改善瘙痒与皮损方面显示更优疗效。生物制剂杜匹鲁单抗(抗IL-4Rα)则直接中和IL-4/IL-13信号,适用于中重度AD。局部用药卢索替尼乳膏(1.5%)通过抑制JAK1/3,快速缓解瘙痒(2天内起效),为轻中度AD提供便捷选择。
强直性脊柱炎(AS)
AS的JAK-STAT通路异常与IL-17/JAK1-STAT3轴密切相关:IL-17(主要由Th17细胞分泌)与脊柱成纤维细胞表面IL-17R结合,激活JAK1激酶,磷酸化STAT3后诱导促炎因子(如IL-6、CXCL8)分泌,导致骶髂关节炎症与骨赘形成。治疗中,托法替尼(JAK1/3抑制剂)在II期试验中显示可降低ASAS40应答率(约35%),但对中轴型AS疗效弱于外周型;抗IL-17单抗(如司库奇尤单抗)通过阻断IL-17信号传导,显著改善脊柱炎症(ASAS40应答率约50%),但对JAK-STAT通路的间接抑制作用有限。
系统性红斑狼疮(SLE)
SLE的JAK-STAT通路异常表现为I型干扰素(IFN-α/β)过度激活:树突状细胞分泌的IFN-α与浆细胞样树突状细胞(pDC)表面IFNAR结合,激活JAK1/2激酶,磷酸化STAT1/2后诱导大量自身抗体(如抗dsDNA)分泌,加剧多器官损伤。治疗药物中,JAK抑制剂巴瑞替尼(JAK1/2)通过阻断IFNAR下游信号,降低SLEDAI评分(约40%患者应答);新型JAK3/TEC双靶抑制剂PF-06651600则通过抑制JAK3(参与IFN信号)与TEC激酶(调控B细胞活化),在II期试验中显示更优的免疫调节效果。
JAK/STAT通路研究与斯达特的助力方案
JAK/STAT通路作为连接细胞外信号与核内命运的“分子枢纽”,其精细调控机制不仅是生命科学的核心命题,更是疾病治疗的关键突破口。斯达特作为优秀的抗体·蛋白·试剂盒的研发生产的高科技生物公司,可提供一步法ELISA试剂盒、相关蛋白、抗体,助力JAK/STAT通路研究及药物开发。
一步法ELISA试剂盒:快速量化通路关键分子
斯达特搭建的OneStep ELISA平台,开发标签抗体捕获技术,研发创新新型一步法ELISA,一小时完成实验,全程仅需一次洗板/孵育,快速高灵敏检测。
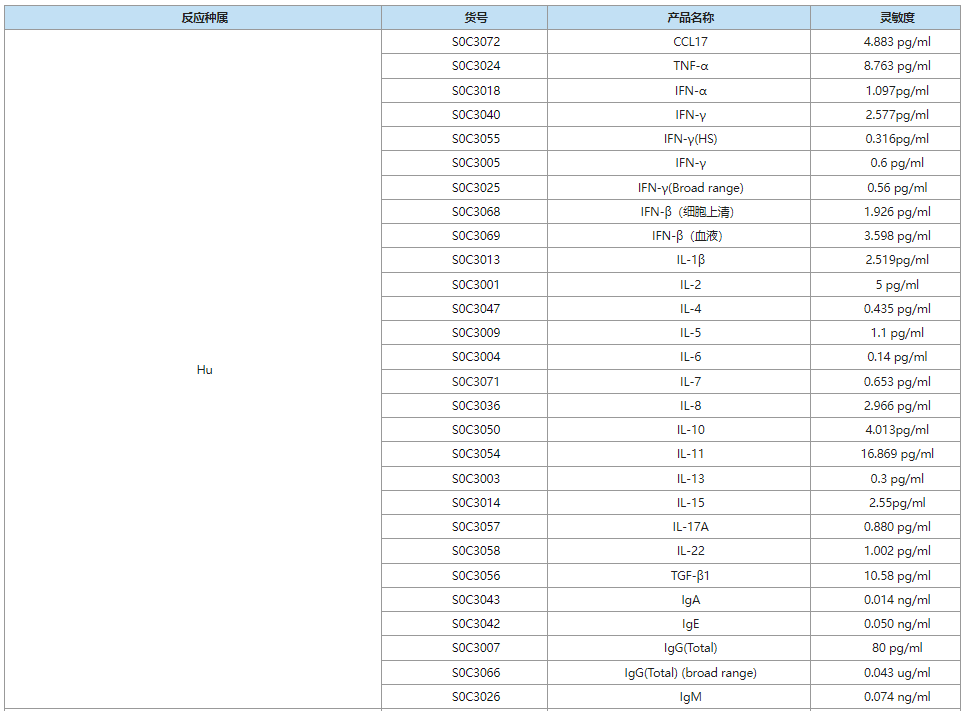
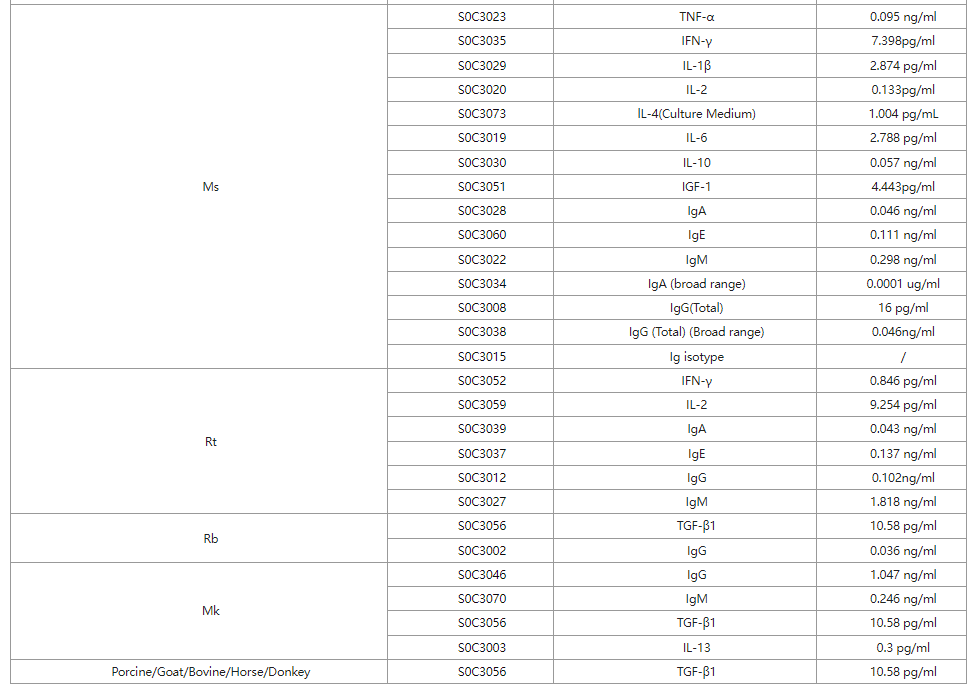
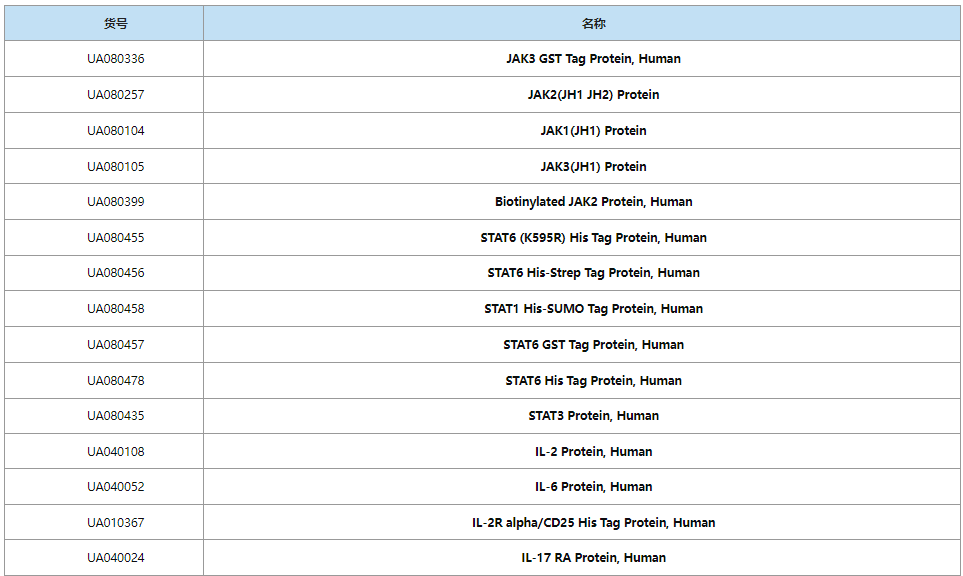
靶点蛋白&受体
高纯度,高活性,高亲和力,低内毒素!
多种属,规格灵活,高性价比!
重组兔单抗
高特异性、高亲和力、批间一致性

杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。





