杭州斯达特生物科技有限公司品牌商
2 年
手机商铺
- NaN
- 0.10000000000000009
- 0.10000000000000009
- 2.1
- 2.1
推荐产品
技术资料/正文
TGF-β1功能解析:从信号调控到疾病关联,ELISA 1h快检助您高效探索
163 人阅读发布时间:2025-08-21 09:36
TGF-β1属于TGF-β超家族(TGF-β1、TGF-β2和TGF-β3),其前体蛋白以潜伏复合物形式存在。该复合物呈环状结构,由两个前结构域(prodomain)通过"领结状"二硫键(Cys194-Cys196)连接形成二聚体,包裹两个TGF-β1生长因子单体。
TGF-β1的加工分泌与激活
加工与分泌:前TGF-β前体(pro-TGF-β precursor)由N端潜伏相关肽(latency-associated peptide, LAP)和C端成熟片段组成。pro-TGF-β precursor经弗林蛋白酶切割后,LAP二聚体与成熟TGF-β1结合,形成小潜伏复合物(small latent complex, SLC)。随后,SLC与潜伏TGF-β结合蛋白(LTBP)结合形成大型潜伏复合物(LLC),锚定于细胞外基质中。
激活机制:在细胞外基质中,纤溶酶、组织蛋白酶及MMP9/14等蛋白酶可通过切割LAP释放活性TGF-β。SLC还可通过潜伏TGF-β结合蛋白(LTBP)与ECM成分(如纤连蛋白、原纤维蛋白)结合,介导活性TGF-β通过整合素αβ(αβ-integrin)的相互作用释放。此外,SLC亦可锚定于糖蛋白A重复优势蛋白(gGARP),进一步调控TGF-β的局部激活与信号传导。
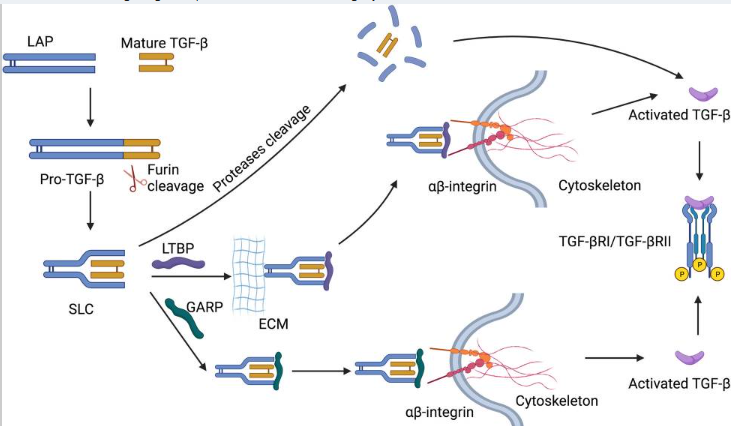
图1 加工激活机制
TGF-β1信号通路途径
TGF-β信号传导通过经典(Smad依赖性)和非经典(Smad非依赖性)两条核心途径实现,两者协同调控细胞增殖、分化、迁移及组织稳态。
1. 经典Smad依赖性通路
异源四聚体受体复合物的组装:释放的活性TGF-β1通过由两个TβRII(II型受体)和两个TβRI(I型受体)组成的异源四聚体复合物传递信号。TβRII优先结合TGF-β1的"指尖区"保守位点(Site IIa),形成氢键/盐桥网络(如Arg25-Glu119、Arg94-Asp32),这一过程具有高亲和力(KD=190 nM)。随后,TβRI通过"掌部疏水界面"(Site I)与TGF-β1结合,依赖TβRII的存在形成协同作用,最终形成稳定的2:2:2复合物结构。
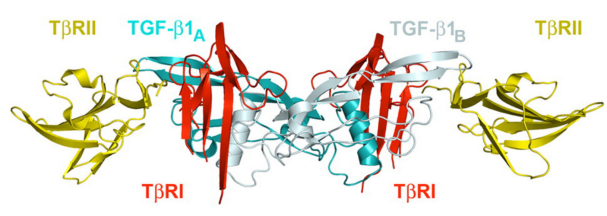
图2 TGF-β1异源四聚体复合物
受体激活后,TβRII磷酸化激活TβRI激酶域,触发Smad2/3的C端SSXS基序磷酸化。磷酸化后的Smad2/3与Smad4形成三聚体复合物,通过核定位信号(NLS)入核调控靶基因(如p21、PAI-1),转位至细胞核内表达。负反馈调控由Smad7介导,其通过结合TGF-βRI阻断Smad2/3磷酸化,并招募E3泛素连接酶(如Smurf1/2)促进受体降解。值得注意的是,整合素αvβ8可通过结合LAP的RGDLXXL/I基序,动态调节L-TGF-β1的构象熵,使其在不释放的情况下直接激活受体,这一机制在TGF-β1自分泌信号中起关键作用。
2.非经典Smad非依赖性通路
TGF-β通过TGF-βRI激活RHO家族GTP酶(如RhoA、Rac1),调控LIM激酶(LIMK)和cofilin,介导肌动蛋白重排,影响细胞迁移和粘附。此外,TGF-β激活MAPK级联反应(包括ERK、JNK、p38)和PI3K/AKT通路,分别参与细胞增殖、应激反应及存活调控。在炎症与癌症中,TGF-β通过NF-κB通路增强免疫抑制微环境,并通过RAS-ERK级联促进上皮-间质转化(EMT)和肿瘤转移。
3. 通路间的交叉调控
经典与非经典通路通过受体酪氨酸激酶(RTKs)和分泌因子(如PDGF)交互。例如,TGF-β激活的ERK可增强Smad复合物的转录活性,而PI3K/AKT通路通过调节Smad蛋白稳定性影响信号输出。这种crosstalk使TGF-β在组织修复(经典通路主导)与纤维化/癌症(非经典通路主导)中发挥双重作用。
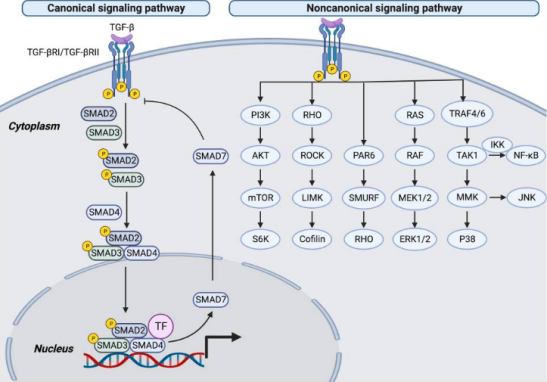
图3 TGF-β诱导典型和非典型信号通路。
TGF-β1的生物学功能
纤维化
TGF-β1在肺纤维化中扮演核心驱动因子。通过经典Smad依赖通路(磷酸化Smad2/3并与Smad4形成复合物)和非经典通路(激活mTOR、MAPK等信号)调控细胞外基质(ECM)合成与降解失衡。其作用包括:
成纤维细胞活化与ECM沉积:低浓度TGF-β1促进成纤维细胞增殖并招募至纤维化位点,通过上调胶原蛋白(如COL1A1)、纤连蛋白等ECM成分的表达,导致器官结构破坏。
巨噬细胞调控:TGF-β1作为趋化因子吸引巨噬细胞至纤维化病灶,诱导其分泌IL-11、CTGF等促纤维化因子,并通过激活WNT/β-catenin、Notch等通路增强纤维化微环境。
上皮-间质转化(EMT)与血管重塑:TGF-β1通过SMAD3/β-catenin协同作用诱导EMT,促进上皮细胞获得间质特性,同时激活Jagged1/Notch信号驱动血管内皮细胞向间质转化,加剧纤维化进程。
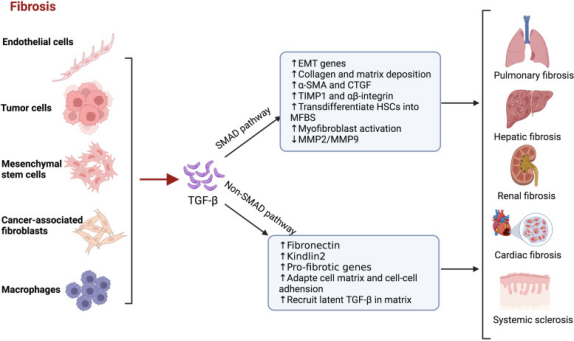
图4 TGF-β在纤维化中的功能
肿瘤微环境
TGF-β1在肿瘤微环境(TME)中扮演双重角色,其作用随肿瘤进展阶段动态演变:
早期抑癌与免疫调控:在肿瘤发生初期,TGF-βRI通过经典SMAD信号通路(如SMAD2/3磷酸化)抑制免疫抑制性细胞(如髓系来源抑制细胞MDSCs)的增殖,维持抗肿瘤免疫应答。同时,它阻断CD4⁺ T细胞向调节性T细胞(Tregs)分化,并抑制树突状细胞(DCs)的抗原呈递功能,从而限制CD8⁺ T细胞的活化和细胞因子分泌(如IFN-γ、IL-2)。
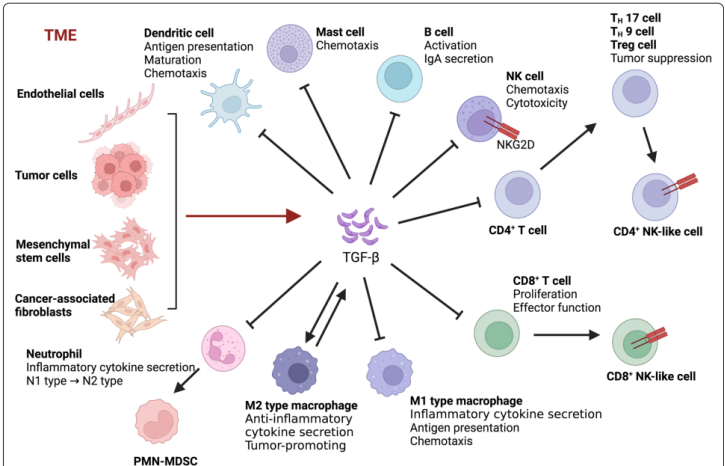
图5 TGF-β在TME中的功能
晚期促癌与免疫逃逸:在肿瘤进展期,TGF-βRI信号转为促癌。它通过非经典通路(如PI3K/AKT、RHO、JNK)诱导上皮-间质转化(EMT),促进肿瘤侵袭和转移。同时,TGF-βRI增强PD-1表达,导致T细胞耗竭,并刺激血管生成(如通过SMAD3上调血小板反应蛋白-4)。此外,TGF-βRI与酪氨酸激酶受体(如PDGF)的串扰进一步重塑TME,形成纤维化基质和免疫抑制网络。
其他类型疾病
TGF-β1在疾病中呈现多效性作用,其功能具有显著的组织和阶段依赖性。在免疫相关疾病中,TGF-β1具有双重角色:早期通过诱导调节性T细胞(Tregs)分化抑制炎症,晚期则通过促进IL-11、CTGF等促纤维化因子分泌加剧免疫抑制微环境,参与类风湿关节炎、炎症性肠病等病理过程。此外,TGF-β1在心血管疾病中通过调控平滑肌细胞表型和血管重塑,与动脉粥样硬化、高血压相关,其非经典信号(如ERK)可抑制平滑肌细胞迁移,形成病理保护性屏障。在癌症中,TGF-β1早期抑制肿瘤增殖,但晚期通过EMT和血管生成促进转移,靶向其信号通路(如Galunisertib)已成为潜在治疗策略。
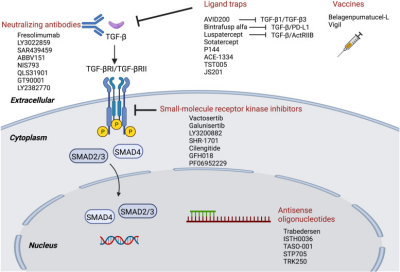
图6 基于TGF-β信号通路的疾病潜在治疗策略
TGF-β1作为多效性细胞因子的核心调控枢纽,其功能复杂性使其在生理修复与病理进展中均扮演关键角色。斯达特上新TGF-β1 OneStep ELISA Kit,适用于多个物种!OneStep ELISA仅需1h即可完成实验,高灵敏度双抗夹心检测,让您的ELISA快准稳!
货号:S0C3056
反应种属:Human/Monkey/Mouse/Rat/Rabbit/Porcine/Goat/Bovine/Horse/Donkey
样本类型:细胞上清、血清、血浆
灵敏度:10.58 pg/ml
Range:15.63 pg/mL – 1000 pg/mL
精确度:Intra-assay: 6.1%;Inter-assay: 9.7%
线性度
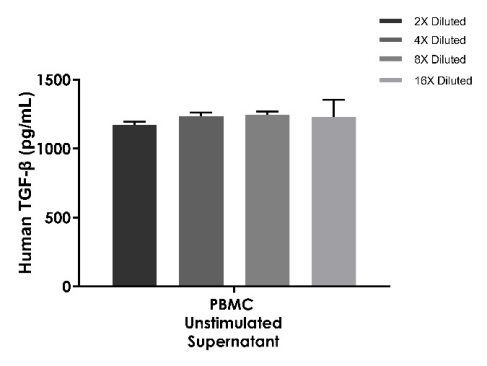
样本:人PBMC细胞
线性度
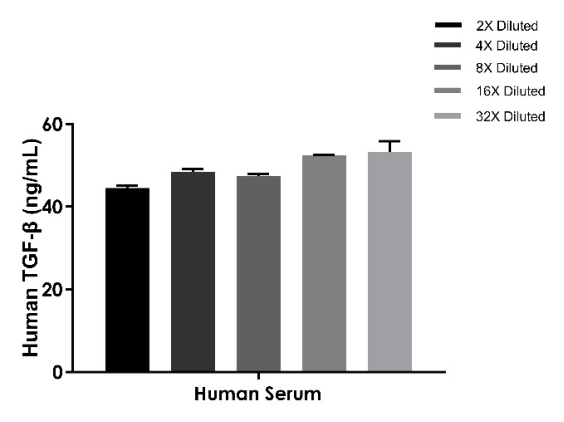
样本:人血清
线性度
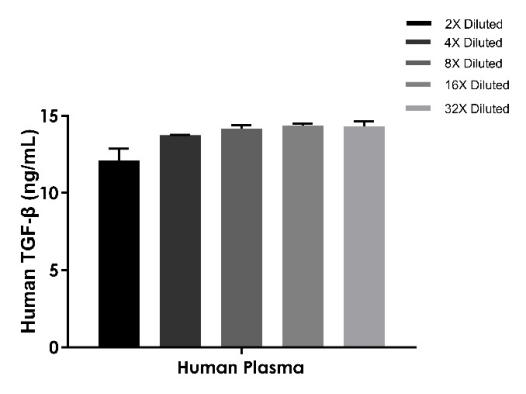
样本:人血浆
线性度
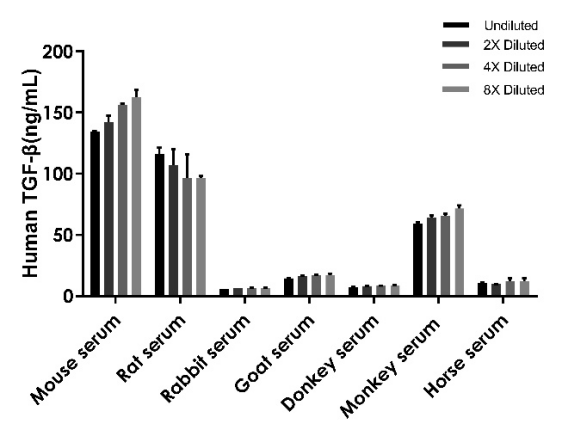
样本类型:猴血清(1.25%)、小鼠血清(0.625%)、大鼠血清(1.25%)、兔血清(5%)、驴血清(2.5%)、山羊血清(1.25%) 和马血清(5%)
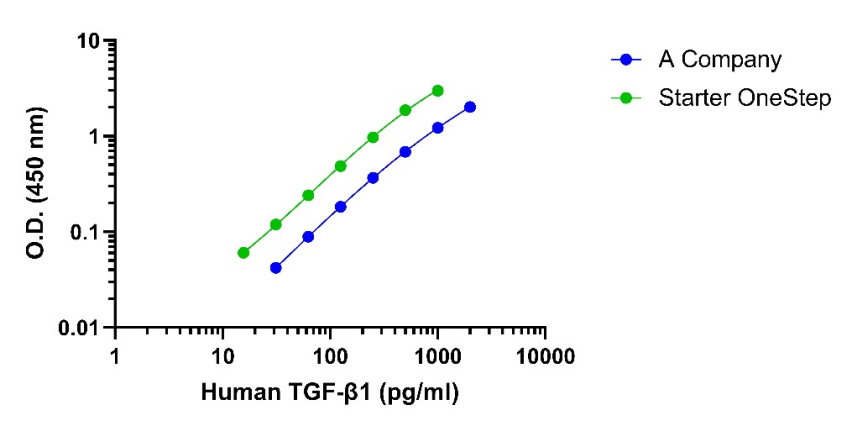
竞品比较
杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。





