慢性肾脏病(Chronic Kidney Disease, CKD)是全球范围内备受关注的重大公共卫生挑战。作为一种临床表现复杂、病理机制高度异质性的疾病,CKD的进展涉及多种病因共同或各自独特的分子通路。目前,糖尿病肾病(DKD)、高血压肾病(HTN)和肾小球肾炎(GN)是导致终末期肾病发生率持续升高的三大主要病因。尽管临床表现相似,不同病因背后的生物学过程却存在显著差异。因此,深入揭示不同病因特有的分子机制,不仅有助于理解CKD的疾病本质,也为推动精准诊断、分层管理和靶向治疗提供了关键科学依据。
文章简介
荷兰格罗宁大学医学中心Hiddo J.L. Heerspink教授团队与阿斯利康研发团队合作,通过Olink高通量蛋白质组学技术,首次系统性描绘了不同CKD病因的特异性蛋白质组学图谱。结果发表于《Nephrol Dial Transplant》杂志。
本研究依托DAPA-CKD临床试验,纳入了4,304名CKD患者,其中2,485名(57.7%)获得了合格的基线血浆样本用于蛋白质组学分析。该研究人群平均年龄62岁,33%为女性,65%患有2型糖尿病。
所有受试者均符合严格的入组标准:估算肾小球滤过率(eGFR)介于25–75 mL/min/1.73m²,尿白蛋白与肌酐比值(UACR)范围为200–5000 mg/g,覆盖了从中度到重度蛋白尿的典型CKD人群。
该研究的一大亮点是样本量大、病因分类清晰,且所有患者均接受标准治疗,保证了研究结果的临床相关性。
图解摘要
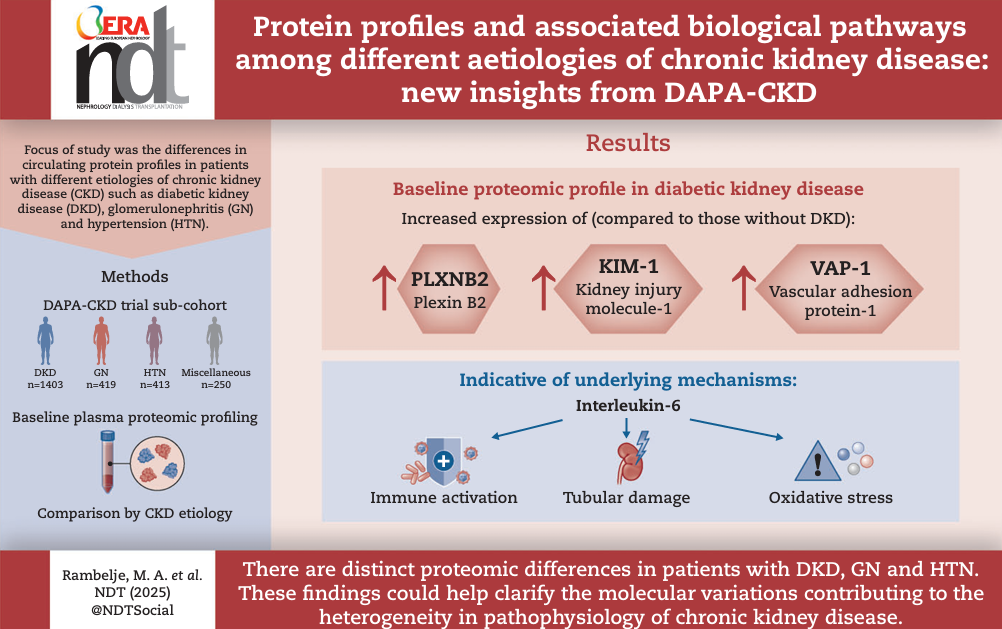
研究显示,DKD是主要的CKD病因,患者占研究人群的56%。与其他病因相比,DKD患者的基线eGFR更高,心血管疾病患病率更高,他汀类药物和利尿剂治疗率也更高。
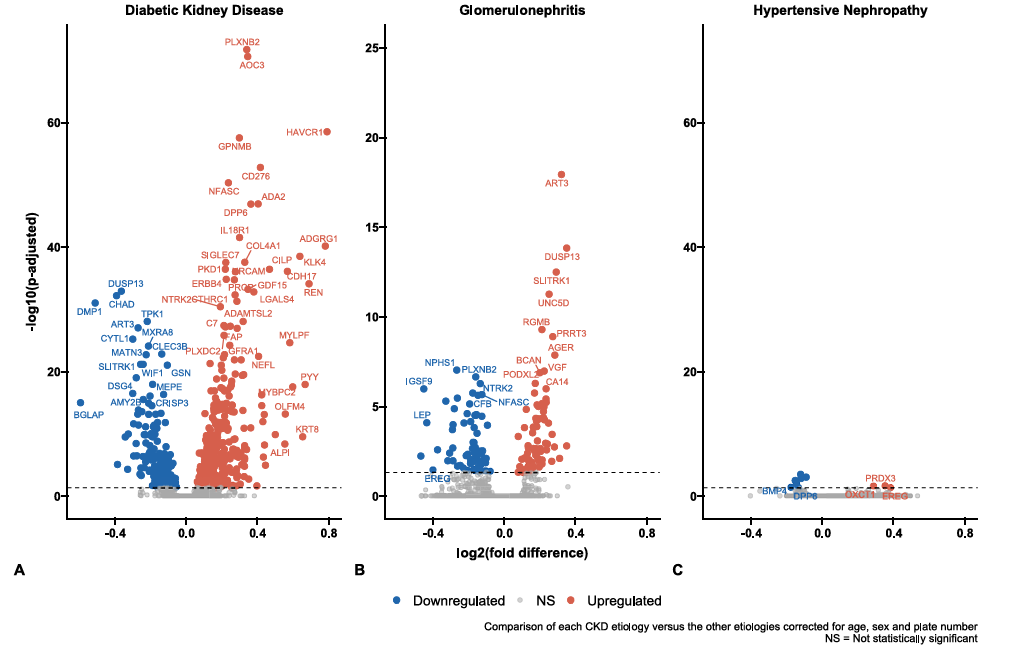
总体而言,DKD患者的蛋白质组学特征最为显著,与非DKD患者相比有574种蛋白质存在差异表达,其中422种上调,168种下调。神经丛蛋白B2(PLXNB2)、含铜胺氧化酶3(AOC3/VAP-1)和肾损伤分子-1(HAVCR1/KIM-1)在DKD患者中显著上调。其中KIM-1表现出最大的表达差异倍数,提示了肾小管损伤在DKD中的核心地位。双特异性蛋白磷酸酶13(DUSP13)和软骨粘连蛋白1(CHAD)在DKD患者中显著下调。
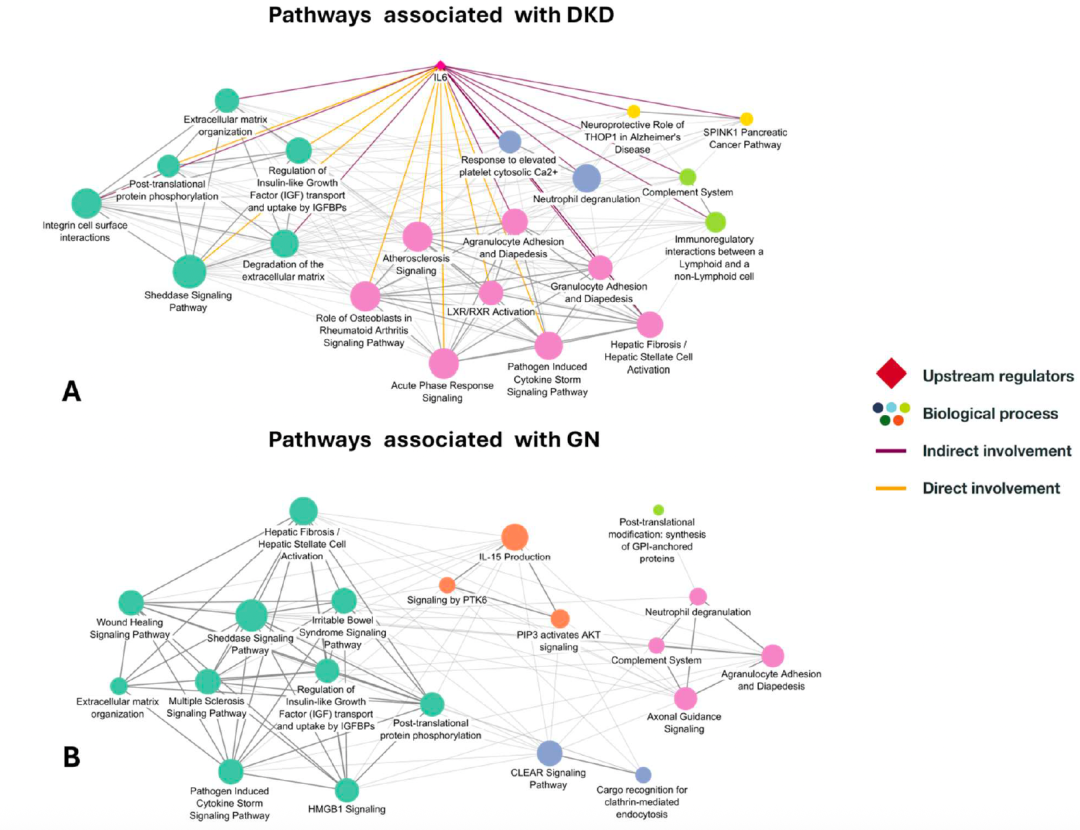
通路分析进一步揭示,胰岛素样生长因子转运调节、肝纤维化、中性粒细胞脱颗粒、病原体诱导的细胞因子风暴信号传导、粒细胞粘附和动脉粥样硬化信号通路在DKD中显著富集。此外,肝X受体-维甲酸X受体激活(LXR-RXR)通路在DKD与非DKD患者中存在差异调节。IL-6被鉴定为DKD相关所有通路的核心上游调节因子,为靶向治疗提供了新方向。
慢性肾脏病不同病因的差异蛋白火山图。y 轴表示显著性,以 -log10 校正后的 P 值表示。x 轴表示log2差异。
GN占研究人群的17%,患者通常更年轻,亚裔比例更高,心力衰竭和心血管疾病病史较少,且相对于其他病因女性比例更高。
在比较GN与其他病因时,研究人员发现了142种差异表达蛋白质,其中68种上调,74种下调。ADP-核糖基转移酶3(ART3)、双特异性磷酸酶13(DUSP13)和SLIT与NTRK样家族成员1(SLITRK1)上调最为显著,形成了与其他病因相比的独特表达差异。nephrin(NPHS1)作为肾小球裂孔隔膜的关键结构蛋白,在GN患者中显著下调。此外,晚期糖基化终末产物特异性受体(RAGE)和硫酸乙酰肝素6-O-磺基转移酶2(HS6ST2)表达上调,提示糖萼破坏和炎症反应在GN发病机制中的作用。
通路分析显示,高迁移率族蛋白B1信号传导、IL-15产生,CLEAR信号通路和糖基磷脂酰肌醇(GPI)锚定蛋白的合成与GN密切相关,反映了肾小球特异性损伤的分子基础。
HTN占研究人群的17%,患者比GN年龄更大,且UACR低于GN或DKD患者。
HTN患者的蛋白质组学特征相对较为局限,仅发现10种差异表达蛋白质,7种下调,3种上调。其中,表皮调节素(EREG)表现出最显著的上调(log2差异0.38),而过氧化物氧还蛋白3(PRDX3)和骨形态发生蛋白4(BMP4)等也显示出特异性改变。
CKD病因分层的通路网络
这项研究具有重要的临床意义:首先,确立了不同CKD病因的特异性分子指纹,为精准医学奠定了基础。其次,发现的生物标志物有望用于早期诊断和疾病监测。最重要的是,研究揭示了多个可靶向的分子通路,为新药开发提供了方向。
例如,针对VAP-1的抑制剂已在二期临床试验中显示出降低DKD患者蛋白尿的效果。而IL-6作为DKD的核心调节因子,其抑制剂ziltivekimab在CKD患者中也显示出抗炎和抗动脉粥样硬化的潜力。
研究团队还在肾脏精准医学项目(KPMP)队列中验证了DKD相关标志物,PLXNB2和VAP-1在外部队列中显示出相同的表达趋势,增强了研究结果的可靠性。
未来研究方向包括验证这些生物标志物在更广泛人群中的适用性,以及探索它们在指导个体化治疗中的价值。随着蛋白质组学技术的不断进步,我们有理由相信,CKD的精准医学时代正在加速到来。
1. M André de la Rambelje, Iris E Beldhuis, Hiddo J L Heerspink, Peter J Greasley, Rasmus Agren, Ann Hammarstedt, C David Sjöström, Adriaan A Voors, Niels Jongs, Protein profiles and associated biological pathways among different aetiologies of chronic kidney disease: new insights from DAPA-CKD, Nephrology Dialysis Transplantation, 2025;, gfaf180