Olink Proteomics品牌商
1 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
世界阿尔兹海默症日|p-Tau217封神后,神经退行性疾病诊疗的下一个突破口
318 人阅读发布时间:2025-09-29 11:07
神经退行性疾病,如阿尔茨海默症(AD)和帕金森症(PD)等,由于其复杂性和隐匿性,给诊断和治疗带来了巨大的挑战。研究表明,淀粉样蛋白β(Aβ)的病理性改变在AD症状出现前数十年即已形成,在早期阶段进行干预能够显著提升治疗效果[1]。然而,对疾病发生的早期识别仍面临巨大挑战。传统的诊断方法,如脑脊液(CSF)检测和PET断层扫描,具有侵入性或成本高昂的缺点。亟需开发一种无创,高特异性和高灵敏度的生物标志物检测方法,实现疾病风险预测和早期诊断。
单一标志物困境:p-tau217的优势与局限
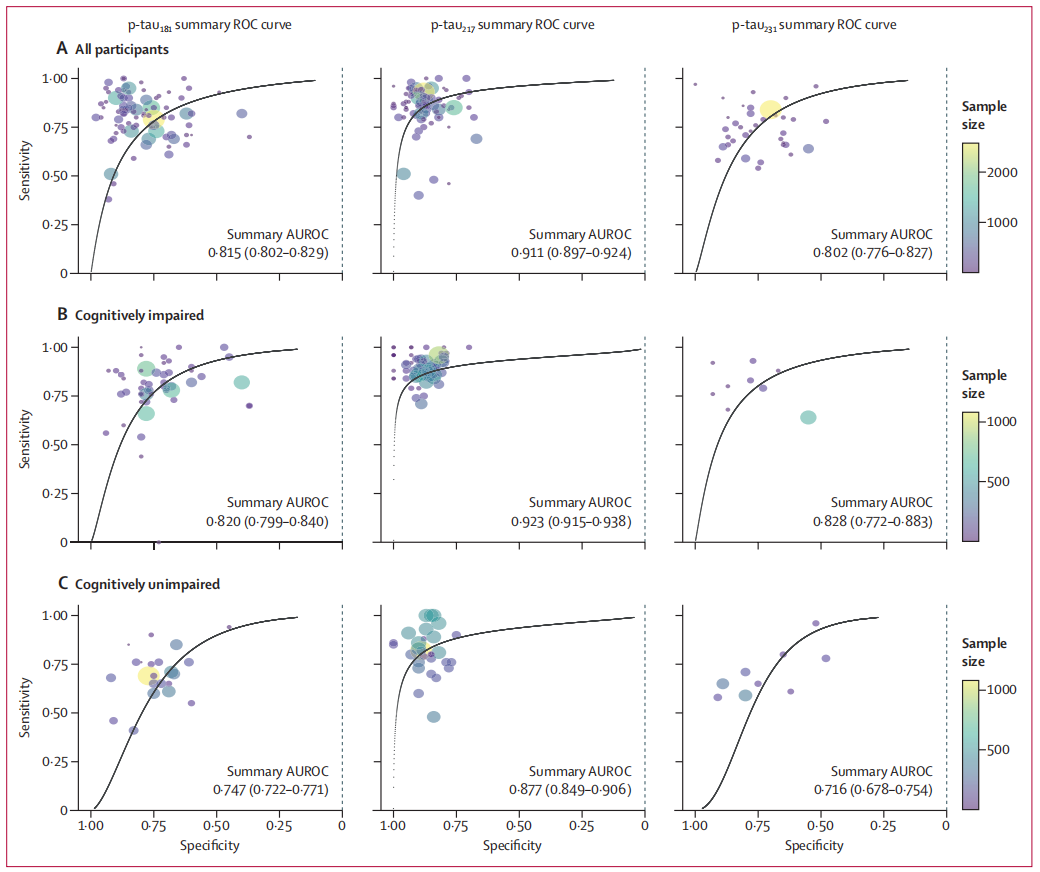
p-tau181、p-tau217和p-tau231的汇总受试者工作特征(ROC)曲线
为了评估血浆p-tau217单独或联合PET/CSF在识别临床前AD中的效能,来自瑞典隆德大学临床记忆研究中心等阿尔兹海默症研究领域的团队近期在《JAMA Neurology》发表了一项国际多中心横断面队列研究[3]。该研究纳入了美国、欧洲,澳大利亚和加拿大等国家的12个队列的2,916名认知未受损个体,检测和比较了血浆p-Tau217,Aβ-PET和CSF标志物(Aβ42/40 比值或p-tau181/Aβ42比值)。
研究表明,血浆p-Tau217是识别认知未受损个体中Aβ阳性状态的有效标志物,单独使用能获得80%的准确率,但其敏感性较差,根据参考标准判定仅识别出了全部Aβ阳性病例中的46%。两步法筛查(血浆p-Tau217初筛+PET/CSF确认)可以显著提升预测效能,与单独PET筛查相比,减少了40%的检测需求。
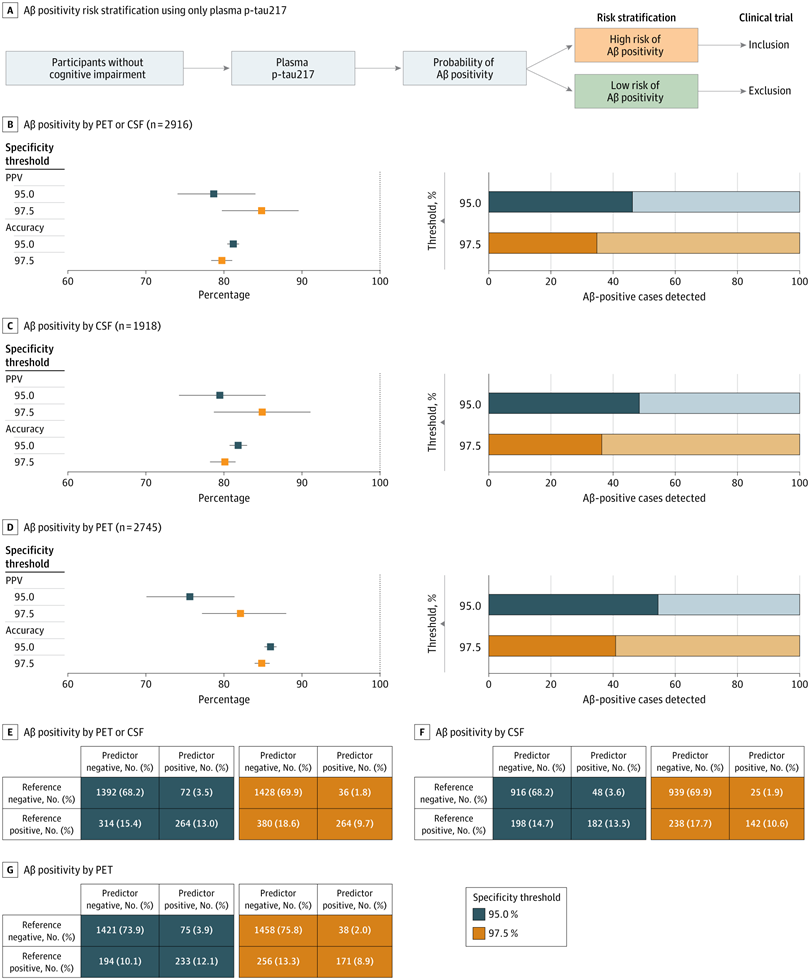
血浆磷酸化Tau 217(P-tau217)作为淀粉样蛋白β(Aβ)阳性的独立确认性标志物
新方向:多重蛋白标志物组合
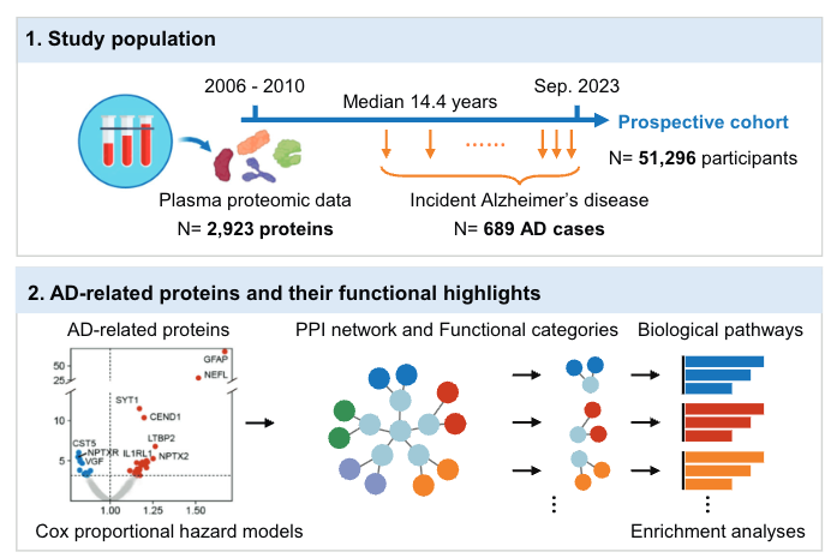
上述研究表明,单一生物标志物策略在临床前阶段仍面临严峻挑战——即使是最优的p-Tau217检测,仍会漏诊54%的早期患者,需依赖进一步PET/CSF确认才能实现高效能(>90%的阳性预测值(PPV))。那么,采用多重标志物能否获得更好的预测效果?UKB数据挖掘大家郁金泰教授团队2024年发表于《Molecular Psychiatry》的文章或许能提供新的研究方向[4]。

该研究基于英国生物样本库药物蛋白质组学项目(UKB-PPP) 一期数据,对51,296参与者的2,923种Olink血浆蛋白数据进行了深度分析。通过对长达15年随访期内的689例新发AD患者进行分析,运用Cox比例风险回归模型,识别了在不同时间阶段与AD发病风险显著相关的蛋白质。进一步通过蛋白质分类关联分析,研究者观察到特定蛋白质Z分数的时序性变化,这反映了AD发生发展过程中动态的病理生理演变轨迹。
为深入探究这些蛋白与AD之间的因果关联,研究采用了孟德尔随机化(MR)分析。该方法利用蛋白定量性状位点(pQTL) 数据作为工具变量,为识别AD的潜在药物靶点提供了遗传学层面的因果证据。
研究共发现了48个AD相关蛋白质,其中四个核心蛋白(CEND1、GFAP、NEFL和SYT1)在短期和长期AD风险中均呈现显著关联。研究表明,SYT1、CEND1、GFAP和NEFL四种核心蛋白在AD诊断前15年开始升高,且呈进行性上升趋势,提示了突触与神经元早期且持续的功能障碍。
多核心蛋白标志物模型
GFAP(胶质纤维酸性蛋白)和NEFL(神经丝轻链蛋白)已经在多项研究中被证明与AD相关。GFAP反映了Aβ聚集体触发脑内免疫炎症反应,是AD早期病理事件的敏感指标;NEFL反映了神经轴突变性和损伤,是AD疾病进展和神经元功能丧失的有力标志。SYT1(突触结合蛋白 1)是神经元中调控囊泡运输的关键蛋白。
MR分析表明,SYT1基因与阿尔茨海默病(AD)的发生存在潜在的遗传因果关联。具体而言,当SYT1在血液中表达升高时,会增加AD的患病风险,这与在AD患者脑脊液(CSF)中观察到SYT1表达升高的现象一致。一项荟萃分析也指出,SYT1基因不仅深度参与AD的发病过程,还有潜力作为诊断AD的生物标志物以及治疗的潜在靶点[5]。
该Panel的标志物经过精心设计,涵盖以下关键病理生理通路:
-
神经退行核心标志物:Aβ40, Aβ42, pTau217, NEFL, WWOX, MOG, OMG, BMP7, EIF2AK2
-
突触功能与损伤:NPTXR, NPTX1, NPTX2, CLSTN3, GLRX, NLGN1, STX1B, SYT1
-
清除机制相关:DDHA1, BACE1, ENO2, KLK8, TP53, SCG2
-
神经炎症反应:GFAP, AGER, HLA-DRA, MMP10
展望未来:个体化诊疗的新时代
随着高通量蛋白质检测技术的发展,我们正进入神经退行性疾病诊疗的新时代。为了对神经疾病的生物标志物和生物机制进行深入研究,Olink于2021年成立了一个科学家合作社区——CORAL联盟,利用Olink蛋白组学平台,对血液和脑脊髓液样品进行神经疾病类生物标志物和生物机制研究。通过大规模蛋白质组学分析,比较不同神经退行性疾病的分子特征,为阿尔茨海默病、帕金森病等神经退行性疾病的生物学基础提供了新的见解。
多标志物策略能够更全面地反映神经退行性疾病的复杂病理过程,未来的神经退行性疾病生物标志物研究也将更加注重跨疾病比较和个体化应用。
在不远的将来,随着生物标志物研究的深入,我们将会看到神经退行性疾病的诊疗策略朝着多靶点干预和个体化精准医疗的方向快速发展。这意味着临床医生将能够更多地依据患者具体的分子分型、遗传背景以及炎症免疫状态等综合信息,为其选择最匹配的靶向药物,并确定最佳的干预时机。正如比尔·盖茨在《自然-医学》的“世界展望”文章中所言:"我们比以往任何时候都更接近这一天:确诊阿尔茨海默病不再等于被判死刑"
参考资料:
1. Sperling R, Mormino E, Johnson K. The evolution of preclinical Alzheimer’s disease: implications for prevention trials. Neuron. 2014;84(3):608-622. doi:10.1016/j.neuron.2014.10.038PubMedGoogle
2. Therriault J, Brum WS, Trudel L, et al. Blood phosphorylated tau for the diagnosis of Alzheimer's disease: a systematic review and meta-analysis. Lancet Neurol. 2025 Sep;24(9):740-752. doi: 10.1016/S1474-4422(25)00227-3. PMID: 40818474.
3. Salvadó G, Janelidze S, Bali D, et al. Plasma Phosphorylated Tau 217 to Identify Preclinical Alzheimer Disease. JAMA Neurol. 2025 Sep 15. doi: 10.1001/jamaneurol. 2025.3217. Epub ahead of print. PMID: 40952756.
4. Zhang, Y., Guo, Y., He, Y. et al. Large-scale proteomic analyses of incident Alzheimer’s disease reveal new pathophysiological insights and potential therapeutic targets. Mol Psychiatry 30, 2347–2361 (2025).
5. T P, Katta B, Lulu SS, Sundararajan V Gene expression analysis reveals GRIN1, SYT1, and SYN2 as significant therapeutic targets and drug repurposing reveals lorazepam and lorediplon as potent inhibitors to manage Alzheimer’s disease. J Biomol Struct Dyn. 2023;1–22.