Olink Proteomics品牌商
1 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
Olink蛋白组学助力揭示严重肥胖的关键炎症驱动因素
402 人阅读发布时间:2025-07-31 09:47
研究背景
严重肥胖(Severe Obesity, SO, BMI≥40 kg/m2)不仅影响个体的健康和生活质量,还给社会带来了沉重的医疗负担。尽管全基因组关联研究(GWAS)已识别出1,000多个与体重指数(BMI)相关的基因位点,但我们仅了解其中一小部分的生物学机制。此外,目前对于严重肥胖的分子机制和潜在的治疗靶点仍有许多未知之处。深入研究肥胖的分子基础,有助于开发更有效的干预措施。
新文速递

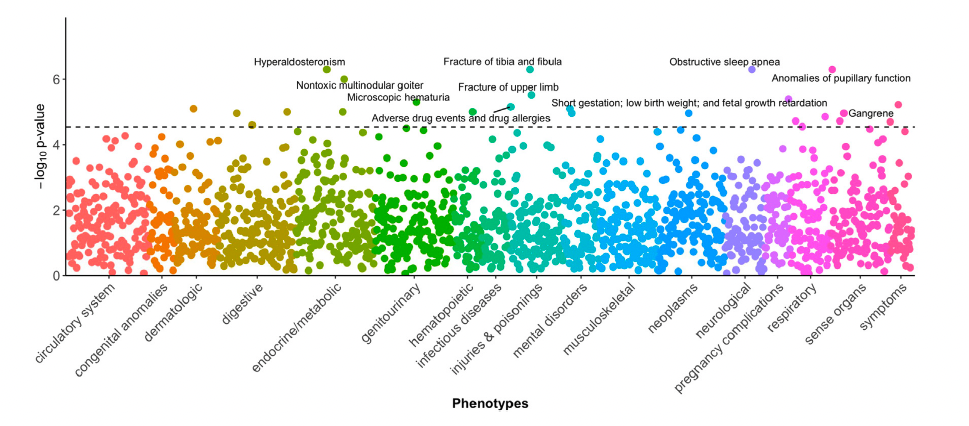
北卡罗来纳大学吉林斯全球公共卫生学院和范德比尔特大学医学中心研究团队近期在国际期刊 Cell Genomics (IF = 9)发表新研究成果:文中针对西班牙裔 / 拉丁裔人群重度肥胖(BMI≥40 kg/m²)的多组学研究,通过全血转录组、Olink血浆蛋白组学、脂肪组织转录组等分析,识别出 124 个差异表达基因(SO-DEGs),并揭示了 IL4R、LILRA5和OSM 等炎症相关基因在重度肥胖中的关键作用,同时探讨了这些基因与肥胖相关并发症(如阻塞性睡眠呼吸暂停和高醛固酮症等)的潜在机制关联,为肥胖相关疾病的预防和治疗提供了新的视角。
研究亮点
-
发现124个基因在西班牙裔严重肥胖人群中存在差异表达
-
ZNF438、LINC01503、MSL3、ARRB1、CACNB4、FCGRT和NCF1B基因在脂肪组织中具有普遍性 -
AKT1、SCAP和POLR2E基因在减肥手术前及术后1年在脂肪组织中均存在差异表达。
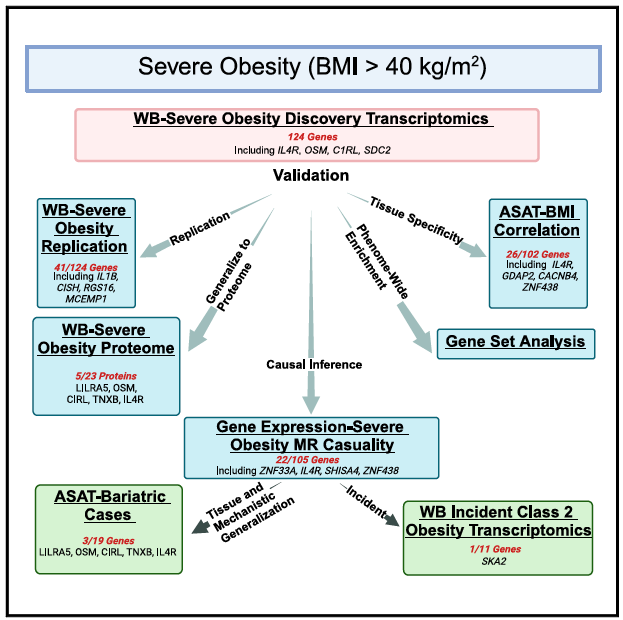
研究设计
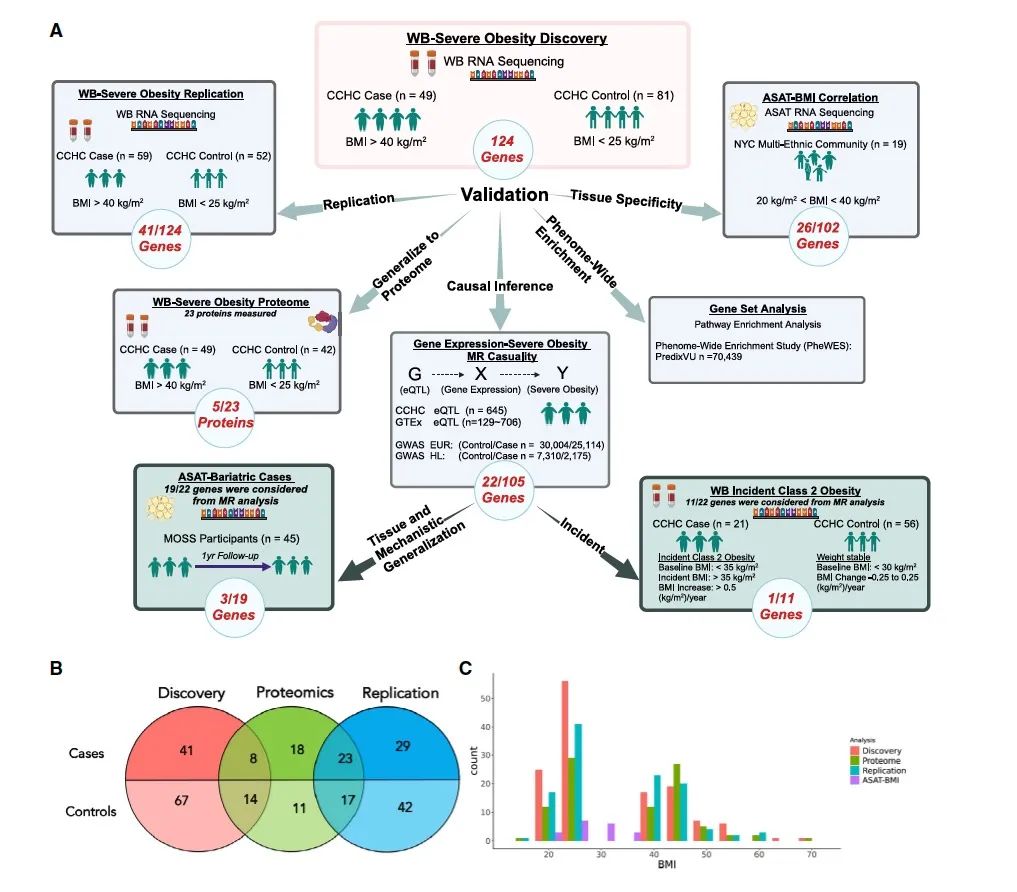
研究结果
● 转录组发现和验证
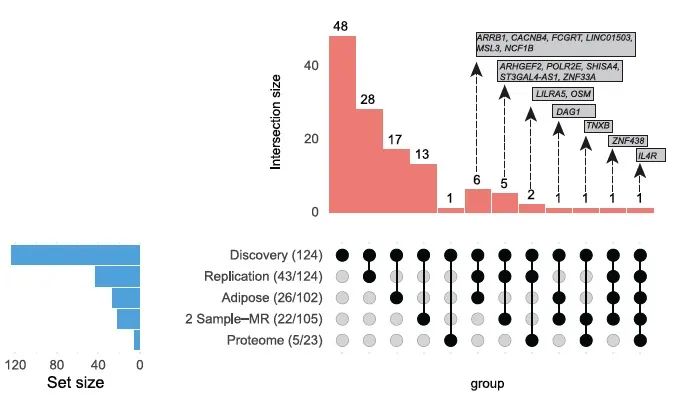
差异表达基因的交集点
为探讨全血中发现的差异表达基因能否推广到肥胖相关组织——腹部皮下脂肪组织(ASAT)中,研究者通过19名社区志愿者(20 kg/m2 < BMI < 40 kg/m2)ASAT的RNA-Seq数据研究了BMI与基因表达的相关性。124个差异表达基因的102个通过了质控,26个与BMI显著相关,其中差异较大的几个基因与BMI显著相关(如IL4R, ZNF438和CACNB4)。
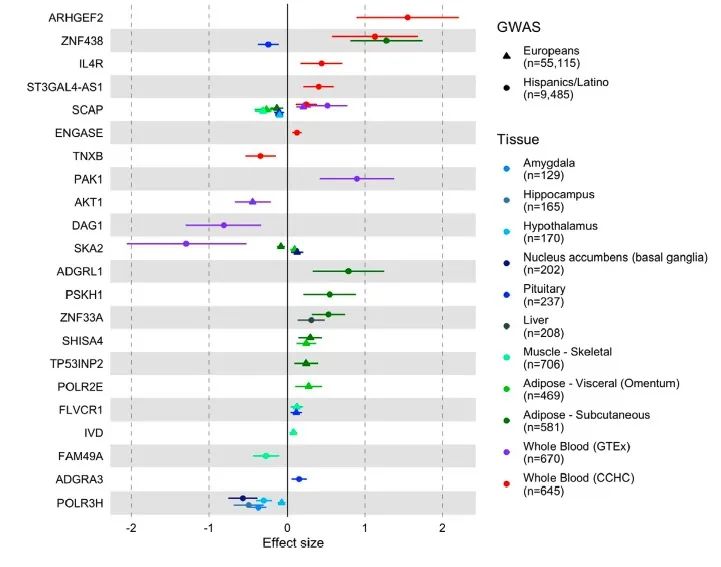
因果关系
● 前瞻性分析与纵向随访
为支持上述因果推理发现,研究者评估了11个基因的基线表达与随访期间2级肥胖的关系。在MR分析发现的因果基因中,SKA2经Bonferroni多重检验校正后,其表达对肥胖具有显著影响;AKT1也观察到名义显著性。此外,研究者通过一项正在进行的纵向研究评估了45名减肥手术后患者1年后ASAT的基因表达变化。AKT1、SCAP和POLR2E在减肥手术前后的表达有显著改变。
● 通路富集分析
● 全表型组关联研究PheWES
写在最后
该研究通过多组学分析,揭示了严重肥胖的关键炎症驱动因素,发现了参与严重肥胖发病机制的炎症基因。这些发现不仅增进了对严重肥胖分子机制的理解,还为开发针对肥胖相关疾病的预防和治疗策略提供了新的方向。未来的研究将进一步探索这些关键基因和蛋白在肥胖发生发展中的具体作用,并评估其作为治疗靶点的潜力。
Olink PEA技术在本研究中帮助研究人员验证了转录组学的发现在蛋白水平上的变化,为研究人员提供了全面、实时的视野。有助于发现与严重肥胖相关的蛋白标志物,并为进一步的机制研究和临床应用提供了基础。
参考资料