江苏瀚江生物科技有限公司
1 年
手机商铺
- NaN
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
- 3.2
公司新闻/正文
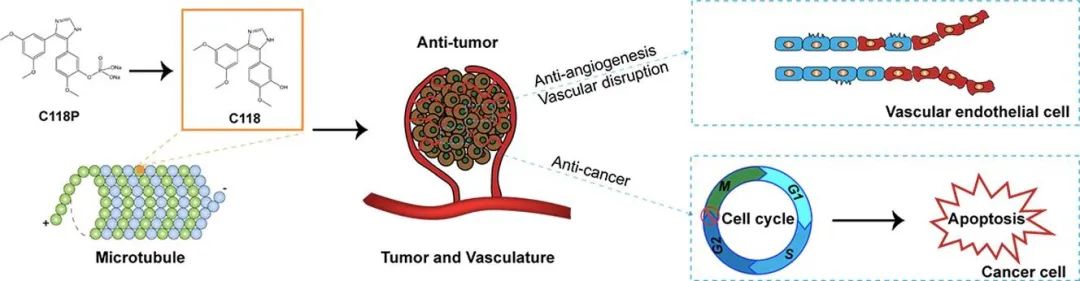
文献解读|ScienceDirect——一种具有抗血管生成和血管破坏活性的新型微管抑制剂C118P,对肝细胞癌具有抗肿瘤效果
576 人阅读发布时间:2025-08-19 17:22

肝细胞癌肝细胞癌(HCC),一种高血管性实体瘤是全世界癌症死亡的主要原因。微管结合剂靶向肿瘤血管系统C118P是一种新合成的CA4类似物,具有改善的水溶性和延长的半衰期,当前研究调查了C118P及其活性代谢物C118,我们首先通过体外实验确认了C118具有微管解聚活性,并通过分子对接揭示了它能够与秋水仙碱 结合位点微管蛋白,此外,我们发现C118P和C118改变了人脐静脉内皮细胞中的微管动态和细胞骨架,因此,我们观察到C118P和C118通过管形成试验和小鸡尿囊膜血管生成试验抑制了血管生成并破坏了已建立的血管网络,此外,我们的数据显示C118P和C118对各种癌细胞,包括HCC细胞系,在MTT试验或硫堇此外,我们通过流式细胞术分析发现C118P诱导了HCC细胞系BEL7402和SMMC7721的G2/M期细胞周期停滞和凋亡,免疫印迹最后,我们确认C118P通过靶向肿瘤血管并诱导SMMC7721异种移植小鼠模型中的凋亡来抑制肝癌生长。总之,研究表明,C118P作为一种有效的微管破坏剂,通过诱导细胞周期停滞和凋亡以及靶向肿瘤血管来发挥其对肝癌的多重药理作用,因此,C118P可能是治疗肝癌的有前景的药物候选者。
细胞系培养
分子对接
微管聚合
测定
微管解聚
实验
免疫荧光
分析
管腔形成
试验
鸡胚绒毛尿囊(CAM)血管生成试验
细胞增殖
抑制试验
细胞周期
分析
细胞凋亡
分析
免疫印迹
分析
异种移植
小鼠肝癌模型
免疫组化检测
统计分析
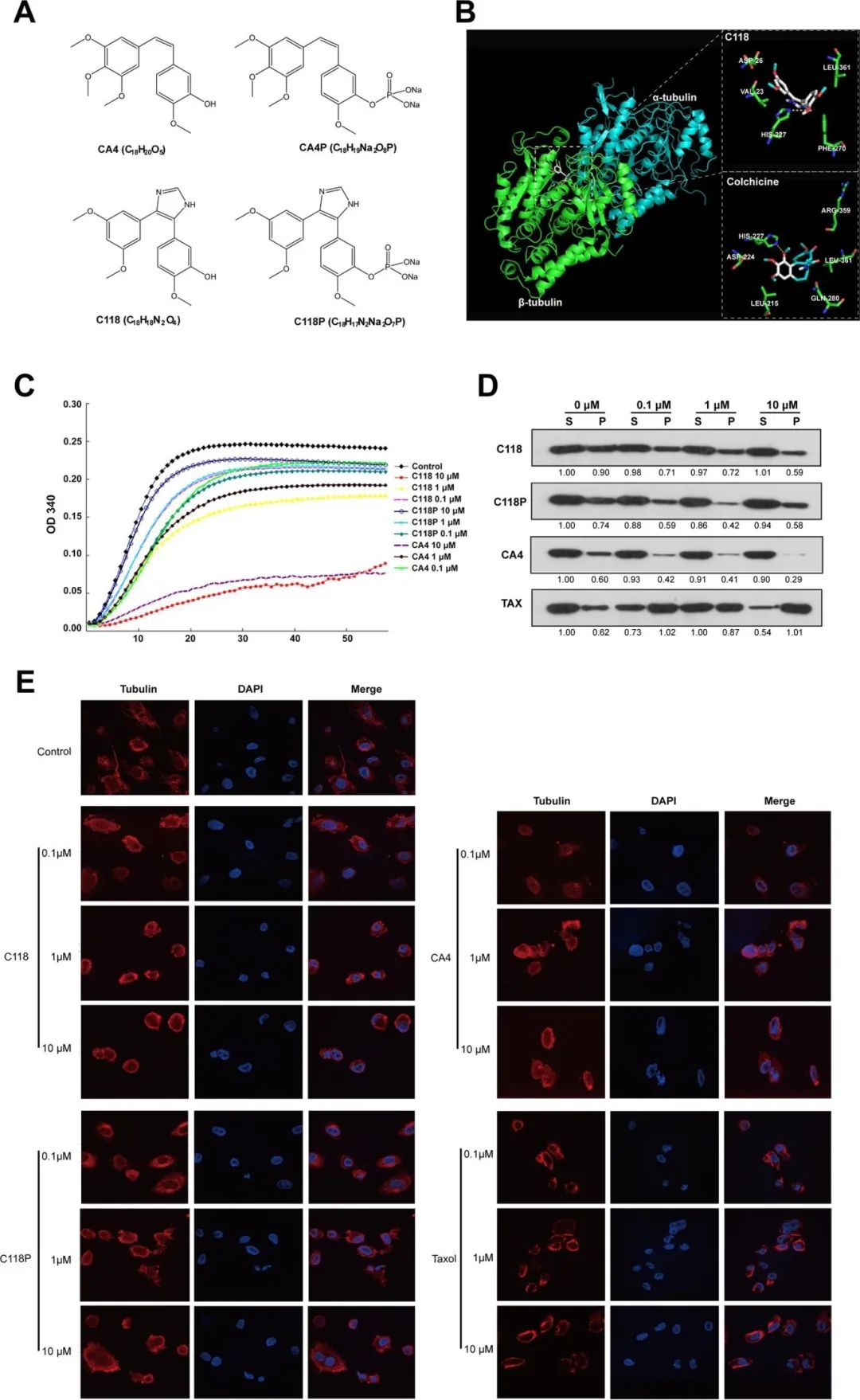
A) CA4、C118P和C118的化学结构。
B) 代谢物C118与α/β-微管复合体结合的对接结构和相互作用,左侧面板显示C118适配于α/β-微管复合体上的秋水仙碱位点;右侧面板放大区域显示C118/秋水仙碱与β-微管氨基酸残基之间的详细残基;
C) 微管聚合测定显示C118P、C118、CA4P和CA4对微管聚合的抑制作用;
D) 代表性斑点图像显示用不同浓度化合物处理后的HUVECs中S型和P型微管的变化;
E) 代表性免疫荧光测定检测微管的图像,显示用C118P(0.1、1、10 μM)、C118(0.1、1、10 μM)、CA4(1 μM)和紫杉醇(TAX,1 μM)处理的HUVECs的内皮细胞骨架变化。
总结:C118P 在细胞内转化为 C118 后,能有效抑制微管蛋白聚合,导致 HUVECs 中微管解聚(S型↑,P型↓) 和 细胞骨架破坏(微管网络分散,细胞收缩)。
C118 的作用与 CA4 相似,是一种 微管靶向抗血管生成候选分子,而 紫杉醇则促进微管聚合(作用机制相反)。C118P 作为前药,需在细胞内代谢为 C118 才能发挥抑制作用,这可能是其药代动力学优化的重要因素。
2.C118P抑制了体外癌细胞的增殖
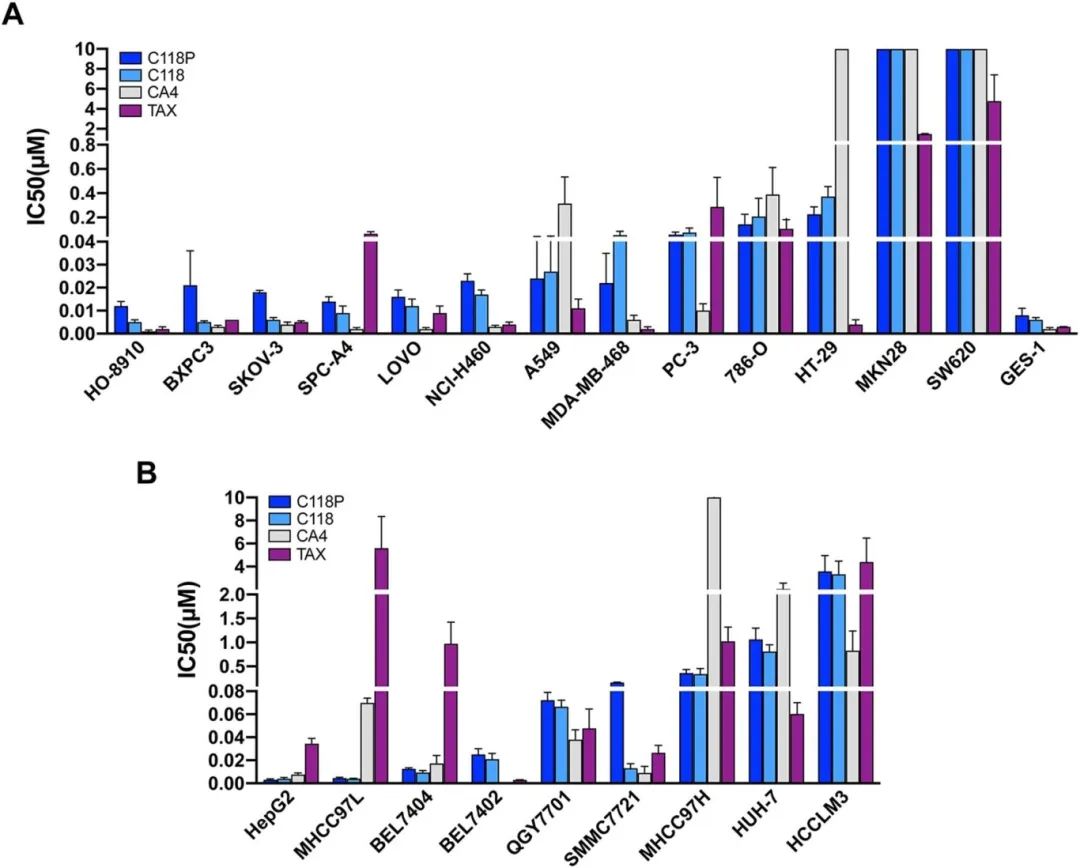
A)MTT[3-(4,5-二甲噻唑-2-基)-2,5-二苯基四氮唑溴化物]检测总结数据,显示C118P及其代谢物C118对多种癌细胞系的增殖抑制作用;
B)MTT检测总结数据,显示C118P和C118对4HCC5细胞系的增殖抑制作用。CA4和紫杉醇(TAX)被用作阳性对照。每组n=3。
3.C118P抑制异种移植肝癌的生长
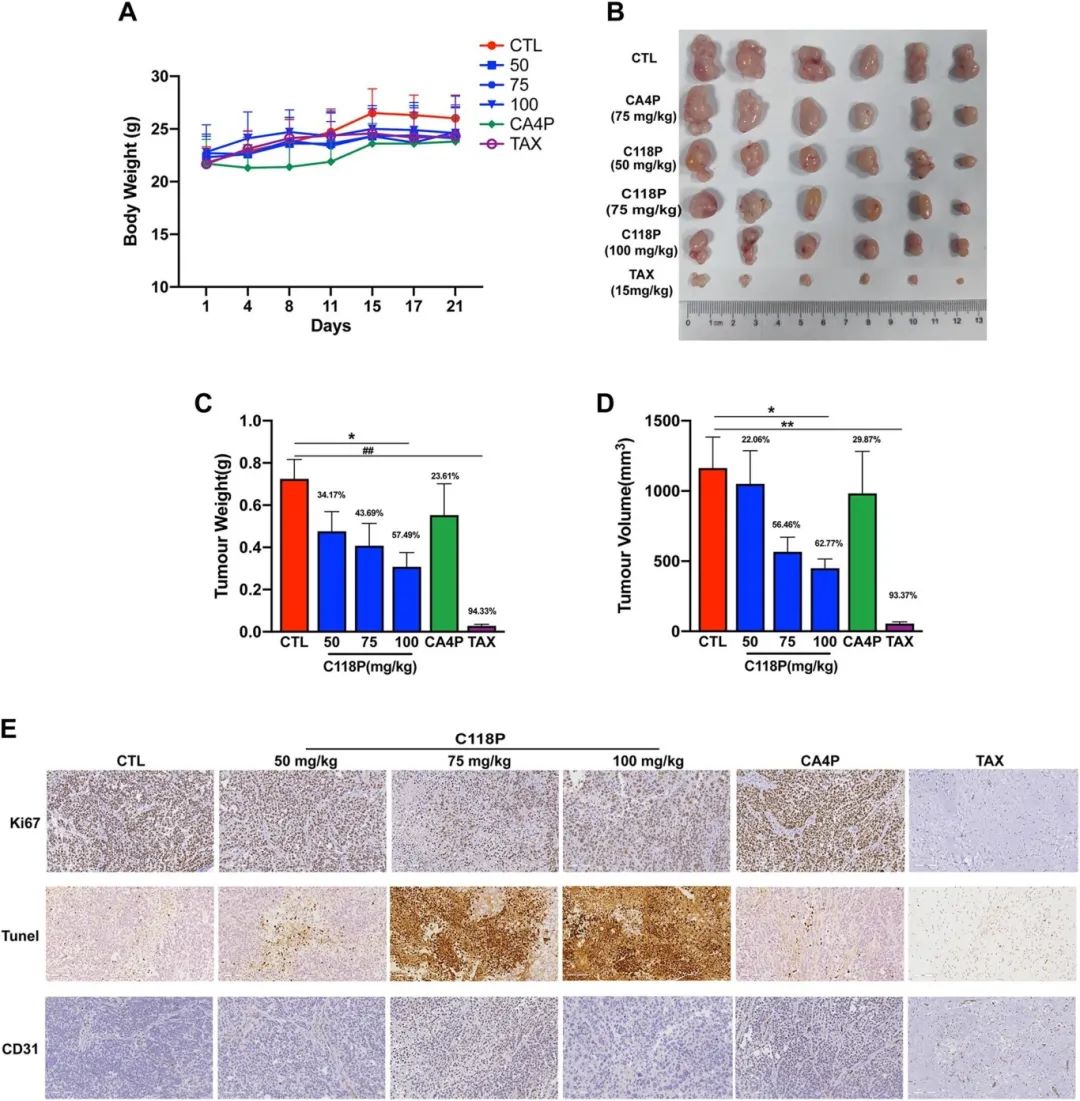
A)肿瘤荷瘤小鼠的体重;
B)使用C118P(50、75、100毫克/千克)、CA4P(50毫克/千克)、紫杉醇(TAX,15毫克/千克)治疗的肿瘤荷瘤小鼠切除肿瘤的图像;
C-D)总结数据显示,使用C118P(50、75、100毫克/千克)治疗的肿瘤荷瘤裸鼠的肿瘤重量(C)和体积(D)。
E)代表性免疫组化图像显示,使用C118P(50、75、100毫克/千克)治疗的肿瘤荷瘤裸鼠的肿瘤组织中Ki67、CD31和TUNEL阳性细胞表达。CA4P、紫杉醇作为阳性对照。每组n = 6。*p < 0.05,**p < 0.01,#p < 0.001,##p < 0.0001与阴性对照(CTL)相比。
总之,目前的研究表明,C118P是一种新合成的具有良好稳定性和水溶性的微管结合剂,通过靶向肿瘤血管并诱导细胞周期停滞以及凋亡,对HCC表现出抗肿瘤效果,越来越多的证据表明微管抑制剂对肿瘤血管的影响及其在所有细胞中的功能作用,C118P作为一种强效的微管破坏剂,可能是治疗肝癌的有前景的治疗药物。然而,C118P诱导细胞周期停滞和凋亡的分子机制尚不清楚。我们的初步数据显示C118P与14-3-3 zeta和MDM2的高亲和力,这些在调节细胞增殖和凋亡中起着重要作用,未来的研究需要阐明C118P这种效应的详细介导机制,这有助于合理和适当地使用C118P进行癌症治疗。






