北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
如何辩证看待近期的中国“猴荒焦灼”与美国FDA单克隆抗体“减猴指南”?
74 人阅读发布时间:2025-12-04 12:15
写在前面的:
北 京 基 尔 比 生物科技公司主营产品:
Kilby 多通道3D细胞培养系统,
Kilby Gravity 微超重力三维细胞培养系统,
动植物/微生物等地面重力环境模拟装置【可以定制】,
Kilby Bio类器官摆动式精密重力摇床,
Kirkstall Quasi Vivo 类器官3D串联芯片培养系统
近期,中国非人灵长类(NHP)实验动物价格的急剧上涨,与同期美国FDA发布的旨在减少单克隆抗体(mAb)非人灵长类测试的指南草案,共同揭示了全球药物研发与安全性评价(安评)领域正在经历一场深刻的结构性矛盾与范式转型。
从药物安评和研发人员的视角审视,这不仅是一个供应链问题,更是倒逼行业加速向更科学、更高效、更伦理的现代评估体系转型的战略契机。
一、 双重压力:现实的“猴荒”与未来的“减猴”
1. 中国“猴荒”:短期成本危机与长期战略隐忧
部分自媒体等虽未直接提供“两个月大涨30%”的数据源,但揭示了“猴荒”的结构性背景。中国是全球主要的非人灵长类实验动物(以食蟹猴、恒河猴为主)供应国之一。价格上涨的核心原因在于需求与供给的严重失衡:
-
需求激增:全球生物医药创新浪潮,尤其是大分子生物药(如单抗、基因疗法)研发高度依赖与人类生理相近的非人灵长类动物进行安评。一个典型的单抗开发项目可能需使用超过100只非人灵长类动物。
-
供给受限:非人灵长类动物繁育周期长(性成熟需5-8年)、饲养成本高、伦理标准日益严格,导致供给弹性极低。同时,中国自身正大力发展生物医药产业,国内需求同步攀升,2025年4月在广西防城港举办的高规格行业大会,正体现了国家层面对整合与提升该战略资源产业的高度重视。
对研发人员而言,“猴荒”直接导致:
(1)项目成本失控:单只非人灵长类动物成本已高达数万美元,价格飙升使临床前研究预算面临巨大压力。
(2)项目周期延误:动物资源短缺可能导致关键毒理实验排队,拖慢整体研发进程。
(3)供应链风险:过度依赖单一、脆弱的生物资源供应链,给全球新药研发管线带来系统性风险。
2. 美国FDA指南:监管科学的范式前瞻
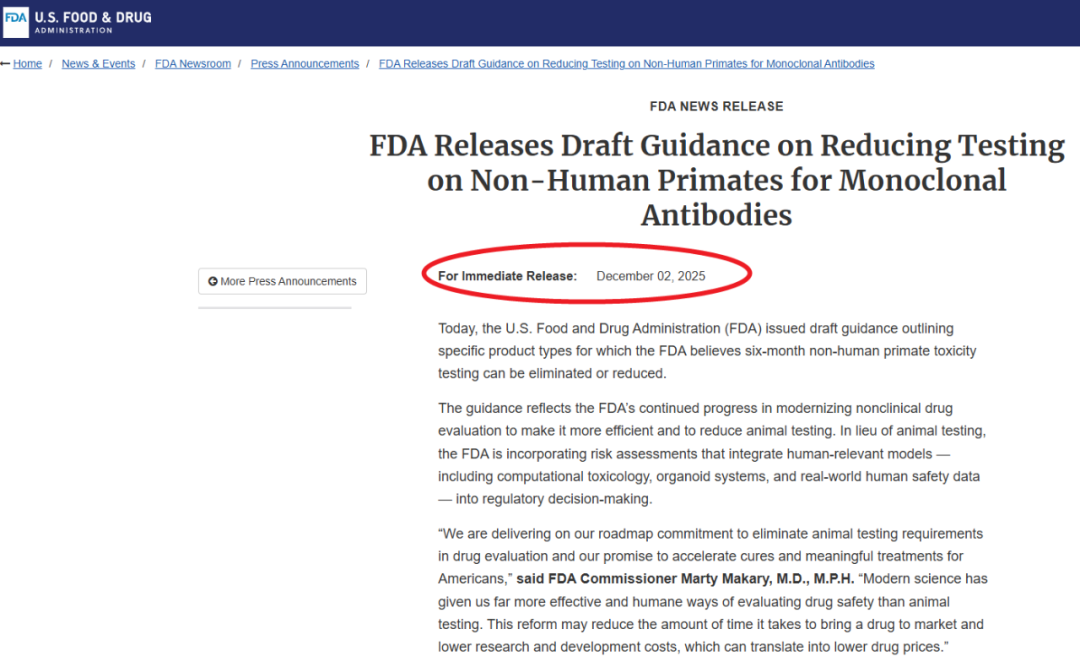
几乎与中国“猴荒”同时,2025年12月,美国FDA发布了《单克隆抗体:简化的非临床安全性研究》指南草案。其核心是:基于风险评估,允许在特定情况下,减少甚至取消对单抗药物进行的6个月非人灵长类长期毒性试验。
A.政策动因:FDA明确指出,此举是为了兑现减少动物测试的承诺,并采用“更有效、与人类更相关”的现代科学方法。这直接回应了传统动物模型的根本缺陷——物种差异导致预测性不足。据统计,约90%在动物试验中看似安全的药物在人体临床试验中失败。
B.替代路径:指南鼓励采用基于知识的风险评估,整合类器官、器官芯片、AI计算模型等“新方法方法论”(NAMs),以及已有的临床人体数据,来替代部分动物试验。
二、 研发与安评人员的核心解读:挑战、机遇与战略应对
面对“当下资源短缺”与“未来范式转变”的双重信号,药物研发与安评人员需进行多维度的战略思考。
1. 对传统安评模式的深刻反思
伦理与成本的双重压力已成为不可承受之重。高昂的动物成本和稀缺资源正从经济上质疑传统模式的可持续性。同时,社会伦理要求也在不断升高,推动行业遵循“减少、优化、替代”(3R)原则。
科学效度的根本性质疑被监管机构正式确认。FDA的转变并非妥协,而是基于科学认知的进化。它公开承认,对于许多生物药,尤其是靶点特异性强的单抗,过度依赖非人灵长类动物的长期毒性数据可能“科学必要性不足”。这解放了研发人员的思维,鼓励他们寻求更具预测性的工具。
2. 对新兴技术与能力的紧迫需求
下表对比了传统模式与新兴范式对研发人员核心能力要求的变化:
|
|
|
|
|
|---|---|---|---|
| 核心工具 |
|
类器官
|
|
| 决策依据 |
|
基于知识的风险评估
|
|
| 研发周期与成本 |
|
有望显著缩短早期筛选和毒性评估时间
|
|
| 监管沟通 |
|
更具灵活性,但也更复杂
|
|

3. 对全球研发格局的深远影响
短期阵痛与长期分化:短期内,“猴荒”可能延缓全球研发进度。但长期看,能更快拥抱并验证NAMs的企业和地区,将建立新的竞争优势。他们能降低对稀缺动物资源的依赖,更快、更准地推进管线。
中国市场的战略抉择:中国同时面临“资源卖方”和“研发买方”的双重身份。一方面,需稳定和优化非人灵长类战略资源产业;另一方面,必须全力投入NAMs的研发、标准化和监管接纳进程,避免在新一轮安评技术革命中落后。需加快转化为具体行动和监管框架。

三、 结论与行动建议:在危机中构建未来能力
“猴荒”与“减猴指南”看似矛盾,实则是同一历史进程的两面:传统模式已触及天花板,变革势在必行。对于药物研发与安评人员,应主动采取以下行动:
-
拥抱技术,投资能力:立即着手了解和引入类器官、器官芯片、AI预测模型等NAMs,将其作为内部研发和安评能力的“第二支柱”进行投资和验证。
-
转变思维,主导风险评估:从被动执行标准动物试验,转向主动构建化合物的综合风险图谱。深入理解药物作用机制,成为能用多源数据(包括早期临床数据)论证安全性的专家。
-
促进合作,推动标准:积极参与行业联盟、学界合作,共同建立和验证NAMs的标准操作流程与数据库。推动国内监管机构关注国际动态,启动相关指南的研讨与制定,为创新方法开辟监管通路。
-
重新规划,优化策略:在项目早期即评估使用NAMs进行部分毒性筛选和风险评估的可能性,以规避后期非人灵长类实验的供应链与成本风险,优化整体研发策略。
总之,当前的“猴荒”危机是一声尖锐的警报,而FDA的指南则是一张清晰的未来地图。对于有远见的药物研发者而言,真正的“焦灼”不应仅停留在对资源涨价的忧虑,更应转化为对技术范式更迭的紧迫感。谁能在人类相关性更高的评价体系中率先建立可靠能力,(而不是在等待,观望,跟随,甚至在嘲笑/讥讽......)谁就能在未来的药物创新竞赛中降本增效,把握先机。这场变革不仅是科学的进步,更是产业竞争力的重塑。
Kirkstall Quasi Vivo 串联多器官芯片培养系统的应用,本质是 “从模拟体内生理环境到解析复杂生命过程,从辅助研究工具到推动临床转化” 的跨越。未来,随着技术的进一步优化(如更高通量的模块设计、更精准的微环境调控)、与其他技术(如单细胞测序、AI 数据分析)的融合,以及监管体系的逐步完善,该系统有望在疾病机制研究、药物研发、再生医学等领域实现更大突破,成为连接基础研究与临床应用的核心平台,最终推动生命科学研究进入 “精准化、人性化、无动物实验” 的新时代。