北京基尔比生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
技术资料/正文
详细步骤:人输卵管上皮细胞建立和长期维持3D生殖类器官
186 人阅读发布时间:2025-11-07 20:47
一、研究背景与核心优势
该方案旨在解决传统输卵管研究模型的局限性(如永生化细胞系缺乏分化细胞类型、无法研究癌症起始等问题), 输卵管类器官技术突破了这些限制,能够在体外重建输卵管上皮的三维结构和生理功能,包含纤毛细胞和分泌细胞两种主要细胞类型,为研究生理、病理过程及卵巢癌起源提供了高度仿真的模型。

关键特征:
可在3周内从约5 cm³组织块扩增出高达1×10⁸个上皮前体细胞,类器官包含PAX8阳性分泌细胞和脱酪氨酸化微管蛋白阳性纤毛细胞,可通过激素(β-雌二醇+孕酮)或化学物质(双苯并氮杂䓬DBZ)分别富集分泌细胞或纤毛细胞,稳定传代至少20次无生长缺陷
二、技术原理
成功建立依赖Notch和Wnt信号通路的激活,培养基需持续添加:
-
Wnt3a条件培养基(25%)
-
R-spondin-1条件培养基(25%)
-
Noggin(100 ng/mL)等关键因子
这些因子维持上皮前体细胞的干性和增殖能力,在撤除或添加特定诱导条件下可分化为成熟细胞类型。

三、完整实验流程(四大核心步骤)
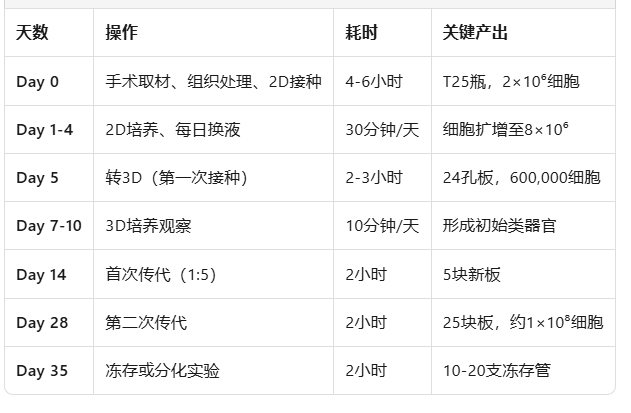
本阶段目标:从手术标本中高效分离纯化输卵管上皮干细胞,并在2D条件下快速扩增至足够数量(约5天达70%融合),为后续3D类器官构建提供高质量种子细胞。
A1. 组织获取与预处理(关键2-3小时窗口期)
-
样本来源与伦理
-
组织类型:优先选择因良性妇科疾病(如子宫肌瘤、子宫内膜异位症)行子宫切除术时连带切除的输卵管组织,最大限度降低肿瘤细胞污染风险
-
病理评估:每例样本必须经病理医师确认无恶性病变
-
知情同意:获取患者签署的科研用途知情同意书
-
伦理审批:实验需通过当地伦理委员会审查(如文中提到的Charité EA1/002/07或Kiel D631/24)
-
GMO合规:若使用L-Wnt3a等基因工程细胞系,需获得当地基因技术监管机构的批准
-
-
运输与暂存
-
手术离体后立即置于冰浴的ADF+++培养基中运输
-
关键时间窗:必须在2-3小时内开始处理,否则细胞活性显著下降
-
若无法立即处理,可将组织剪成小块后冻存于液氮(长期)或4℃短期保存(<6小时)
-
A2. 组织解离与清理(无菌操作台中)
-
初步清洗
-
将输卵管转移至10 cm细胞培养皿,用10 mL DPBS轻柔冲洗2-3次,去除血液、黏液和腹腔积液
-
用无菌镊子固定组织,避免反复抓握上皮区域
-
-
去除非上皮成分
-
浆膜层(外膜结缔组织)
-
血管束(可见的红色管状结构)
-
肌层(较厚的平滑肌组织,尽量去除以减少成纤维细胞污染)
-
使用11号或22号无菌手术刀,在解剖显微镜下精细剔除:
-
技巧:沿输卵管长轴方向"片"状切削,而非"剪"断,可保持上皮完整性
-
-
纵向剖开暴露黏膜
-
用精细眼科剪从伞端至峡部全程纵向剪开,使黏膜皱襞完全展开
-
再次用DPBS冲洗管腔,清除管腔内液体和脱落细胞碎片
-
A3. 上皮细胞采集(两种策略)
-
首选方法:机械刮取(更高纯度)
-
持手术刀与管腔表面呈45-60°角,用刀背或钝侧沿长轴方向单向刮取3-5次
-
力度控制:中等力度,听到轻微"沙沙"声为宜,过度施压会带入基质细胞
-
收集:每刮2-3次将刀尖上的乳白色糊状物用DPBS冲洗至15 mL Falcon管中
-
优势:纯度>90%,显著减少成纤维细胞污染
-
-
备选方法:组织微块消化
-
若组织过软易碎(如妊娠期输卵管),改用精细剪将黏膜层剪成约 0.5 mm³ 的微小组织块
-
注意事项:块越小消化越充分,但会损失部分细胞
-
A4. 胶原酶消化解离
-
消化体系配置
-
消化液:0.5 mg/mL I型胶原酶(Sigma SCR103)溶于ADF基础培养基
-
推荐体积:每根输卵管使用10 mL消化液,确保组织充分浸没
-
容器选择:使用25 cm²培养瓶而非离心管,可增加组织与酶接触面积
-
-
消化条件优化
-
消化终点:组织块边缘模糊,展开呈"云雾状",单个细胞或细胞团游离
-
过度消化:细胞碎片增多,存活率<70%
-
温度:37℃恒温水浴或培养箱
-
动态摇床:100-200 rpm持续摇动【或者使用北京基尔比生物Kilby 类器官精密灌注摆动式重力摇床,如下图】,关键!静态消化效率降低60%以上

-
时间监控:标准45分钟,但需镜检判断:
-
可视指标:消化充分时,浑浊度明显增加,肉眼可见絮状物消散
-
-
终止消化与过滤
-
直接加入等体积含5% FCS的ADF(无需加TrypLE抑制剂)
-
过100 μm细胞筛网至0.1% BSA预包被的50 mL管中,去除未消化组织
-
包被技巧:加入1 mL 0.1% BSA,旋转润洗管壁后弃去,防止细胞粘附
-
A5. 细胞洗涤与接种
-
离心参数
-
500×g,5分钟,25℃(室温即可,避免低温激活细胞应激)
-
弃上清,保留约200 μL残液以防吸入细胞沉淀
-
-
二次洗涤
-
用10 mL ADF重悬,轻柔吹打5-8次(避免气泡)
-
重复离心一次,彻底去除胶原酶和细胞碎片
-
-
接种密度与培养基
-
用FT isolation medium重悬沉淀,调整密度至1×10⁶ cells/mL
-
接种于未经包被的T25培养瓶(上皮细胞可贴壁,基质细胞贴壁差)
-
每瓶接种量:2 mL细胞悬液(约2×10⁶细胞)
-
-
抗污染强化措施
-
添加庆大霉素(10 μg/mL)和Fungin(0.1% v/v),前3天每天换液
-
第4天起改用标准扩增培养基(含1% P/S)
-
A6. 2D培养监控与维护
-
日常观察
-
Day 1-2:可见小簇状贴壁细胞,呈铺路石样形态
-
Day 3-4:细胞岛扩大,边缘清晰,无成纤维细胞混杂(呈梭形)
-
Day 5-7:达70-80%融合,准备转入3D
-
-
换液策略
-
第1-3天:每天换液,去除未贴壁细胞和碎片
-
第4天起:每2天换液,避免过度消耗生长因子
-
换液技巧:沿侧壁缓慢加入,避免直接冲击细胞层
-
B. 3D类器官建立
B1. 准备工作(所有步骤冰上操作)
-
ECM融化
-
提前12-24小时将Matrigel(Corning 354230)或Cultrex(R&D 3533-010-02)从-80℃移至4℃冰盒
-
严禁在37℃水浴快速融化,会形成凝胶块
-
融化后轻轻旋转混匀(避免涡旋),分装成200 μL或1 mL冻存管备用
-
-
耗材预冷
-
将所有离心管、移液枪头、24孔板(仅板底)置于-20℃预冷10分钟
-
24孔板仅预热底部,加入细胞前37℃孵育30分钟(促进ECM快速聚合)
-
-
离心机预冷
-
设置4℃,至少提前30分钟开启
-
-
试剂准备
-
ADF+++:冰上预冷
-
FT expansion medium:37℃水浴预热(使用前再加热,避免反复升温)
-
B2. 细胞消化与精确计数
-
TrypLE消化优化
-
吸弃培养基后,用DPBS快速漂洗1次(去除FCS残留)
-
加入2 mL TrypLE Express(Gibco 12605010),37℃孵育
-
关键监控:每2分钟镜检,见细胞边缘变圆、细胞间连接松开即可终止
-
标准时间:5-10分钟,切勿超过15分钟,会损害细胞表面受体
-
-
细胞收集
-
直接加入10 mL ADF+++(无需FCS中和,TrypLE非动物源)
-
用P1000枪头轻柔吹打3-5次,避免过度剪切力
-
-
离心参数
-
300×g,7分钟,4℃(低温降低细胞代谢,减少损伤)
-
-
精确计数与活率评估
-
弃上清,用200 μL ADF++重悬
-
使用自动细胞计数仪(含台盼蓝染色)或血球计数板
-
合格标准:活率>85%,单个细胞占比>90%
-
计算公式:所需细胞总数 = 25,000 cells/孔 × 总孔数
-
B3. ECM-细胞悬液配制(黄金比例)
-
浓度标准化
-
每孔:10 μL细胞悬液(含25,000 cells)+ 40 μL ECM = 50 μL微滴
-
每板(24孔):240 μL细胞悬液 + 960 μL ECM = 1,200 μL总量
-
目标密度:25,000 cells / 50 μL ECM微滴 = 500,000 cells/mL(ECM中最终浓度)
-
推荐配比:细胞悬液与ECM按 1:5体积比混合
-
-
分步混合技巧
-
先在15 mL管中加入冰ECM(如960 μL)
-
再缓慢加入冰细胞悬液(如240 μL),边加边用预冷枪头轻柔吹打
-
严禁反向操作(将ECM加入细胞悬液会导致局部浓度过高)
-
混合后立即使用,放置超过5分钟会导致ECM提前聚合
-
B4. 微滴接种技术(稳定性关键)
-
手法演示
-
持P200枪头,垂直于孔中心上方约1 cm
-
缓慢推动活塞,让液滴自由落体至孔底中央
-
理想形态:形成**穹顶状(dome)**立体微滴,直径约5-6 mm
-
避免:液体铺展过大(ECM过稀)或无法成滴(ECM过浓)
-
-
板边缘处理
-
边缘孔易蒸发,建议加入PBS或空白ECM填充,减少边缘效应
-
或接种后用板盖密封膜包裹
-
B5. 固化与培养基覆盖
-
固化参数
-
37℃孵育30-45分钟,切勿晃动
-
判断标准:微滴由半透明液态变为不透明凝胶状,倾斜板不流动
-
-
培养基添加
-
沿侧壁缓慢加入500 μL预热的expansion medium
-
关键:枪头勿触碰ECM微滴,避免机械破坏
-
培养基应室温平衡5分钟,避免温度冲击
-
-
初期培养监控
-
Day 1-2:细胞在ECM中呈单个或小簇状
-
Day 3-5:形成5-10个细胞的致密团,开始出芽
-
Day 7-10:形成50-100 μm囊性结构,可见极性化
-
Day 14:成熟类器官,直径100-300 μm,可用于传代
-
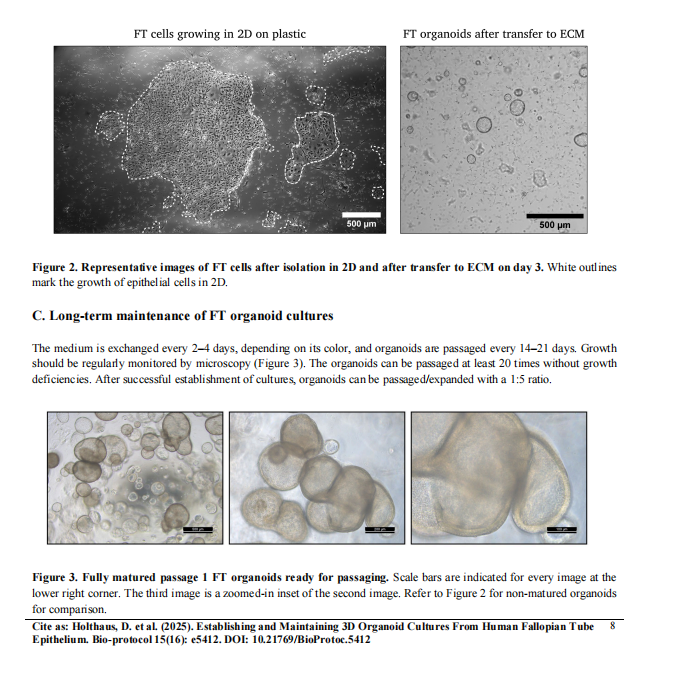
C. 长期传代与维持
C1. 传代时机判断(精准窗口)
-
形态学标准
-
最佳时机:类器官直径150-300 μm,囊腔明显,但未出现坏死核心
-
过早传代(<100 μm):细胞数量不足,传代后生长缓慢
-
过晚传代(>500 μm):中心细胞坏死,释放DNA导致ECM液化
-
-
时间周期
-
标准:14-21天传代一次
-
高密度培养:可缩短至10-12天
-
低密度培养:可延长至25天
-
C2. 完整传代流程(标准12孔/管)
-
ECM破碎
-
用P1000枪头垂直刺入微滴中心,快速上下吹打3-4次
-
技巧:每孔破碎后立即将悬液吸入同一15 mL管,避免ECM重新聚合
-
收集量:每管不超过12孔(即6 mL ECM悬液),否则离心不充分
-
-
第一次离心与洗涤
-
破碎后每孔加入500 μL 冰ADF+++,用枪头吹打混匀
-
收集至15 mL管,再补加ADF+++至总体积12 mL
-
离心:300×g,5分钟,4℃
-
观察:应见三层结构——上清(透明)、ECM层(白色胶状)、细胞沉淀(粉红)
-
弃液:吸弃上清和大部分ECM层,保留约500 μL残液
-
-
TrypLE二次消化(核心步骤)
-
包被方法:针筒内吸入0.1% BSA后推出,重复3次
-
力度:中等速度,避免产生气泡
-
每管加入1 mL TrypLE Express,用枪头充分重悬ECM-细胞混合物
-
水浴:37℃,5分钟,摇晃水浴(50-100 rpm)显著提高消化效率
-
机械破碎:用BSA预包被的18G钝针抽吸6-8次
-
-
终止与二次离心
-
立即加入11 mL冰ADF+++终止消化
-
离心:300×g,5分钟,4℃
-
关键:此时沉淀应为松散细胞团,而非紧密团块
-
C3. 重悬与再接种
-
计数与调整
-
弃上清,用200 μL ADF+++重悬
-
无需精确计数,按经验比例传代(如1:5)
-
活率要求:>80%
-
-
ECM再包埋
-
常规扩增:25,000 cells/孔(50 μL微滴)
-
高密度实验:50,000 cells/孔(观察细胞间相互作用)
-
低密度克隆:5,000 cells/孔(研究单克隆起源)
-
按 1:5比例 加入冰ECM(如200 μL细胞悬液 + 1,000 μL ECM)
-
接种量调整:
-
-
后续培养
-
接种后第3天首次换液,之后每2-4天换液
-
长期稳定性:至少20代无核型异常或生长衰退
-
D. 冻存与复苏
D1. 冻存前准备(细胞状态优化)
-
最佳时机
-
形态:培养5-7天,类器官直径100-200 μm,处于对数生长期
-
密度:24孔板中70-80%孔有类器官,避免过密
-
时间:传代后第5天冻存,而非传代当天(细胞需恢复)
-
D2. 冻存流程(慢速冻存)
-
消化与收集
-
按C部分步骤1-6破碎ECM、消化、离心
-
弃上清后,不清洗,直接保留细胞沉淀
-
-
冻存液配制与重悬
-
举例:48孔类器官 → 12 mL CryoSFM
-
CryoSFM(PromoCell C-29922):无需稀释,直接使用
-
配比:每4孔类器官用1 mL冻存液
-
重悬:用枪头轻柔吹打,避免产生气泡
-
-
分装与程序降温
-
每支1.5 mL冻存管加入1 mL细胞悬液(含约3-5×10⁵个类器官碎片)
-
立即转入预冷4℃的程序降温盒(如Mr. Frosty或CoolCell LX)
-
程序:-80℃冰箱过夜(12-18小时) → 次日转入液氮气相2小时 → 投入液相长期保存
-
标签:注明患者ID、 passage数、日期、细胞密度
-
D3. 复苏流程(快速复苏)
-
复苏前准备
-
提前融化ECM,预热24孔板,准备冰ADF+++
-
水浴预热:37℃水浴锅调至最高水位,确保冻存管完全浸没
-
-
快速解冻
-
从液氮取出冻存管,立即投入37℃水浴
-
关键时间:90-120秒内完全解冻,严禁超过2分钟
-
判断标准:冻存液刚完全融化,但管壁仍感冰凉
-
-
稀释与洗涤
-
提前在15 mL管中准备11 mL冰ADF+++
-
将解冻后的1 mL悬液逐滴加入ADF+++中,边加边轻摇混匀(降低渗透压冲击)
-
离心:300×g,5分钟,4℃
-
-
再接种优化
-
弃上清后,用200 μL ADF+++重悬
-
复苏密度:双倍接种密度(50,000 cells/孔),因部分细胞会死亡
-
ECM混合与接种同B部分
-
关键补充:培养基中Y-27632浓度加倍至20 μM,持续3天,帮助细胞恢复
-
-
复苏后监控
-
Day 1-2:观察碎片较多属正常
-
Day 3-5:应见新类器官形成,若未见则复苏失败
-
Day 7:恢复常规培养,Y-27632降回10 μM
-
六、质量控制与常见故障
成功标志:
-
2D阶段:5天内达到70%融合,获得8×10⁶细胞
-
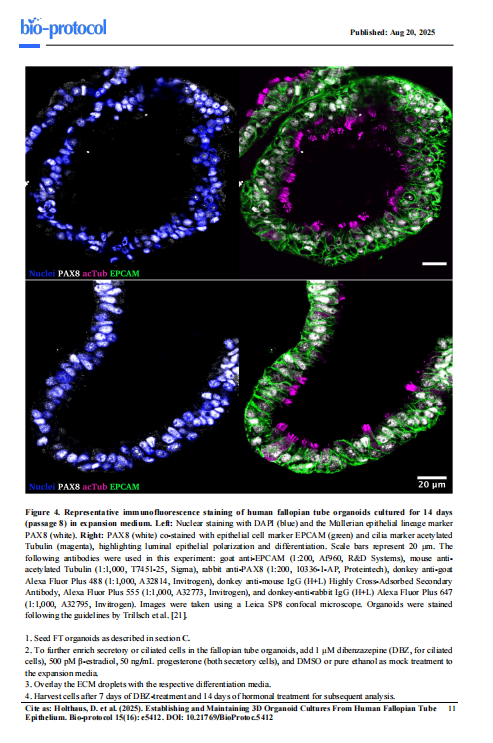
3D阶段:类器官呈囊性结构,边界清晰,直径100-500 μm(见图2-3)
常见问题:
-
消化不足:组织块剪更小或延长胶原酶消化时间
-
ECM塌陷:确保ECM充分混匀,提高ECM:培养基比例
-
无生长:检查条件培养基活性(可用Wnt报告基因细胞系验证),提高初始接种密度
-
离心后ECM悬浮:使用冰PBS、BSA包被离心管、每管不超过12孔样本
全流程核心禁忌
-
温度失控:ECM接触室温>5分钟即不可逆聚合
-
消化过度:TrypLE>15分钟会降解Wnt受体(LRP5/6),导致类器官无法形成
-
密度过低:<10,000 cells/孔会导致类器官形成效率<30%
-
传代过晚:>25天传代会引发中心坏死,释放IL-1β导致整体死亡
-
复苏过慢:>2分钟解冻会激活caspase级联反应,存活率<20%