深圳泽医原代细胞生物技术有限公司
2 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
PD-1 表观遗传调控改善T细胞耗竭的新发现
709 人阅读发布时间:2024-10-10 17:27
PD-1 表观遗传调控改善T细胞耗竭的新发现
在癌症和慢性病毒感染的领域,PD-1(程序性死亡蛋白1)的表达调控一直是研究的热点。PD-1是一种重要的免疫抑制分子,其在CD8+ T细胞上的高表达与T细胞的耗竭状态密切相关。尽管PD-1阻断疗法在肿瘤治疗中展现出显著疗效,但完全失去PD-1功能(如通过基因敲除)带来的效果较为复杂,既可能促进T细胞增殖,也会引发更高的细胞死亡率和较差的记忆T细胞形成。在T细胞耗竭中驱动 PD-1 高表达的机制尚不清楚,对于理清其有益或有害的影响至关重要。近期,由Debattama R. Sen教授及其团队发表在《Nature immunology》上的研究“Epigenetic tuning of PD-1 expression improves exhausted T cell function and viral control”为我们提供了新的视角。

1.构建EnhDel 小鼠模型
作者利用CRISPR-Cas9 基因编辑删除了Pdcd1基因上游的1.2 kb 的 OCR,创建了一个 EnhDel小鼠模型。在未感染情况下 EnhDel 小鼠与同窝野生型(WT)对照进行比较,包括CD+8在内的多种免疫细胞频率相当(图1C)。CD8 +T 细胞的 PD-1表达在WT和EnhDel模型中相比也无差异,但Treg和 γδ T 细胞中PD-1表达在EnhDel模型中显著降低,表明增强子可能特异性地维持这些细胞的PD-1的表达。
在体外,急性刺激实验中EnhDel 细胞的PD-1表达与WT 细胞相似,且细胞增殖能力也无差异(图1f)。但在慢性LCMV Clone 13感染中, EnhDel 细胞的 PD-1的表达在感染晚期与WT 细胞相比显著降低(图1h、j)。表明增强子缺失可降低慢性感染中耗竭 T 细胞中的 PD-1 表达,在其他 T 细胞活化情况下表达不变。
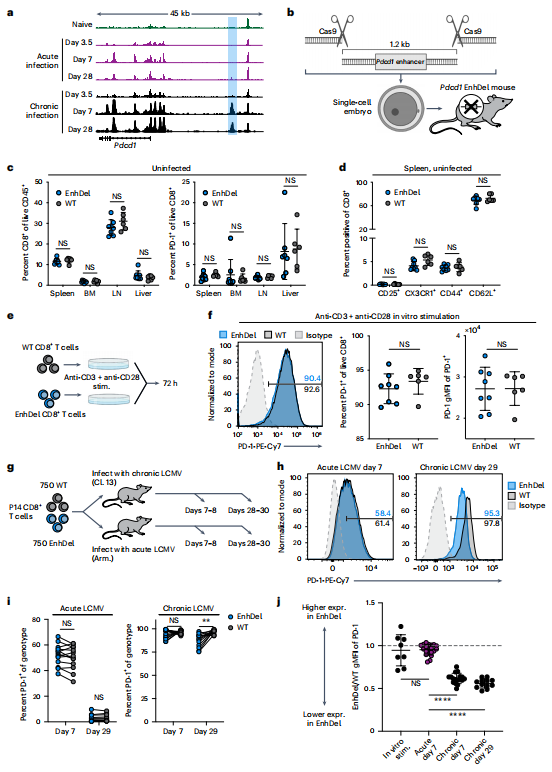
图一 在慢性感染期间,耗竭相关的 Pdcd1 增强子特异性降低 CD8 T 细胞中的 PD-1 表达
2. 增强子缺失对CD8+ T的影响:扩增 CD8 + T 细胞,促进增殖和存活,不产生新的耗竭。
在慢性感染的第 28-30天, CD8+ T 细胞在EnhDel中明显多于WT,且这种情况持续到第50天之后,但在急性感染中未观察到。作者还进行了增强子缺失对亚群形成的影响研究,增强子缺失导致 PD-1表达在各个亚群中减少,并影响了亚群的分布(图2e)。前期,EnhDel 细胞偏向于Prog. 亚群 和Term亚群,而在第30天时仅有Term亚群EnhDel 细胞中富集。
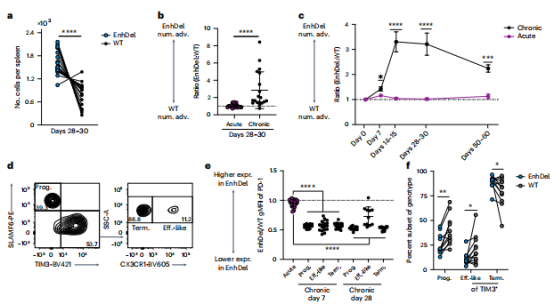
图2增强子缺失增加耗竭的 CD8 T 细胞数量并调节亚群分布
作者还通过BrdU 和Annexin V实验对增强子缺失对T细胞增殖和凋亡两个过程的影响进行了研究。实验发现增强子缺失对增殖和细胞死亡的影响因亚群和时间点而异,在早期时间点(第7天和第15天)EnhDel细胞比WT细胞增殖更多,细胞凋亡显著降低。这种现象在不同亚群内表现不同,Prog.细胞在早期增殖更快,而Term细胞在晚期凋亡减少。相关数据表明耗竭相关的完整的PD-1增强子能抑制Prog细胞的早期增殖,促进Term细胞的晚期细胞死亡。
单细胞 RNA 测序(scRNA-seq)和ATAC-seq分析表明,三种基因型的耗竭细胞亚型分布有所不同,增强子缺失和 Pdcd1-KO 都不会从根本上改变耗竭 T 细胞亚群的形成,并且两个分析的亚群的染色质可及性谱在基因型之间非常相似(图4)。
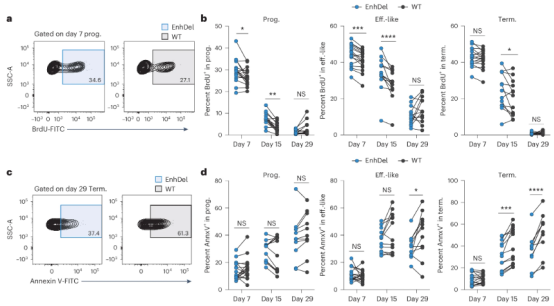 图 3:增强子缺失增加了耗竭 CD8 T 细胞的早期增殖和晚期存活率
图 3:增强子缺失增加了耗竭 CD8 T 细胞的早期增殖和晚期存活率
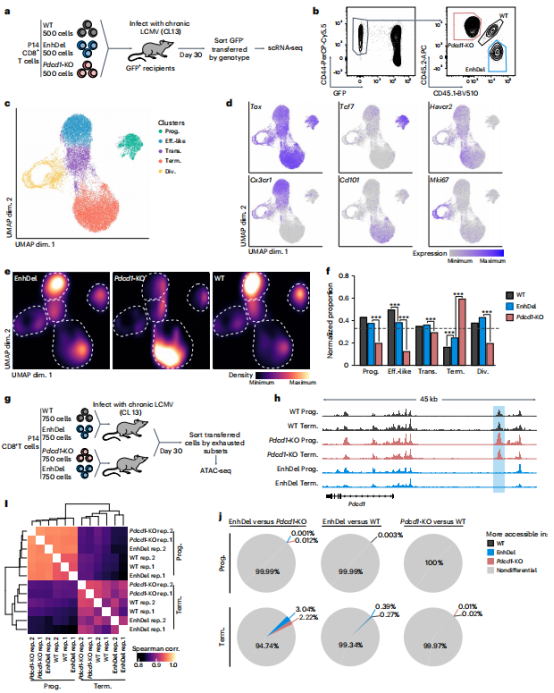
图 4:PD-1 表达的遗传扰动不会产生新的耗竭性 CD8 T 细胞亚群
3.增强子缺失诱导的特殊的效应功能
通过主成分分析(PCA)和基因集富集分析(GSEA)将EnhDel细胞与野生型和Pdcd1 KO T细胞区分开来,并明确了EnhDel 富集的基因集,EnhDel细胞显著富集效应状态和氧化磷酸化基因,而凋亡基因减少(图5e-f)。EnhDel细胞在Prog.和Term.亚群中的IFNγ表达水平介于WT和Pdcd1-KO之间(图6d),GZMB在Eff.-like和Term.亚群中高于Pdcd1-KO(图6e),而TNF 产生无显著差异。EnhDel细胞还表现出较低的TOX和较高的KLRG1表达(图6f-g),并减少了凋亡(图6h)。EnhDel的出现似乎在完全PD-1缺失和野生型表达的极端之间取得了平衡,突显了量身定制干预措施优化T细胞功能的潜力。
该团队还研究了增强子缺失对疾病进展和宿主健康的影响,在小鼠模型中,EnhDel细胞转移减少了体重损失(图7b)并提高了生存率(图7c),在感染早期降低了病毒滴度和炎症因子水平(图7d-f),慢性阶段也显著增强了病毒控制(图7g-h)。相比Pdcd1-KO,EnhDel细胞在改善抗病毒效果的同时,避免了宿主损伤。与可能导致免疫病理学的完全PD-1缺失不同,EnhDel细胞维持病毒控制而不会引起致命的病理反应。
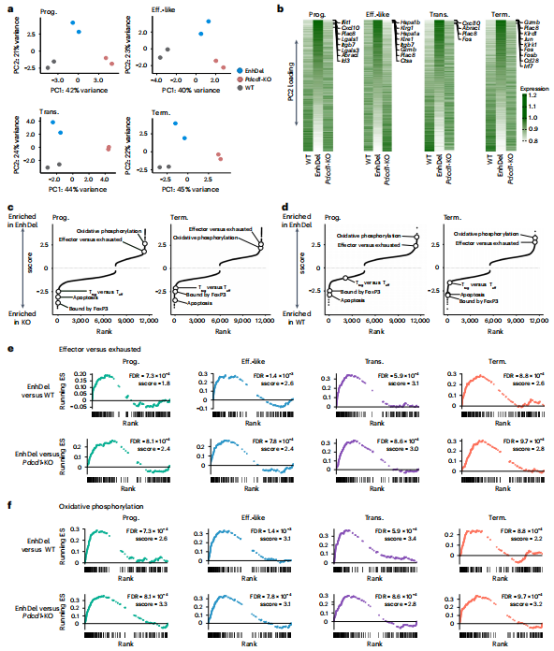
图5:增强子缺失促进了不同于WT和Pdcd1-KO T细胞的效应转录状态
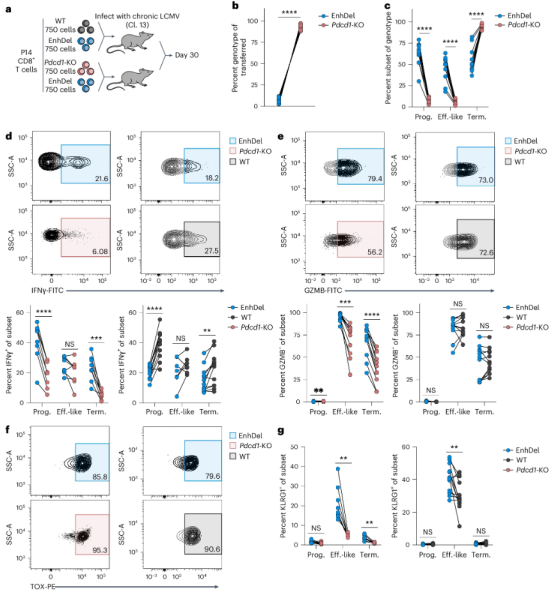 图 6:与 Pdcd1-KO 和 WT 细胞相比,增强子缺失会产生中间和独特的功能特性。
图 6:与 Pdcd1-KO 和 WT 细胞相比,增强子缺失会产生中间和独特的功能特性。
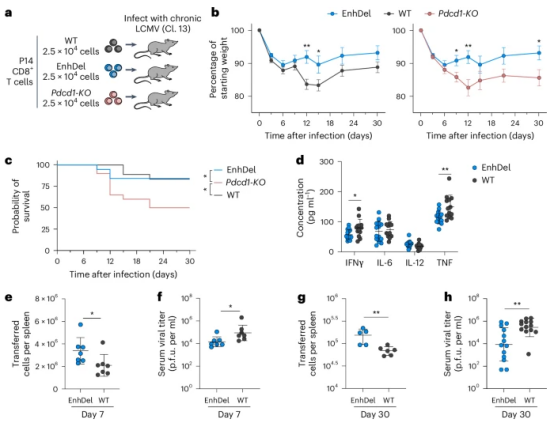 图 7: 增强子缺失改善了病毒控制,同时限制了宿主损伤
图 7: 增强子缺失改善了病毒控制,同时限制了宿主损伤
研究发现,这种特定的增强子缺失可降低慢性感染中耗竭 T 细胞中的 PD-1 表达,增强了CD8+ T细胞的持久性,并改善对病毒的控制。然而,与完全敲除PD-1基因不同,这种增强子缺失并未引发免疫病理损伤。该研究表明,通过操控特定的增强子可以适度调控PD-1的表达,改善慢性感染中CD8+ T细胞的功能,同时避免了过度的免疫病理学问题。通过精细调控PD-1的表达,研究者们实现了在不增加自身免疫风险的情况下,增强了T细胞对慢性感染的控制能力。
这一发现不仅为理解PD-1在T细胞功能中的作用提供了新的分子机制,也为癌症和病毒感染的治疗提供了新的思路。通过表观遗传编辑技术,我们或许能够找到一种“最佳点”,在不影响免疫系统正常功能的前提下,优化PD-1的表达水平,从而提高T细胞的抗肿瘤和抗病毒能力。这项研究的重要性在于,它不仅增进了我们对PD-1调控机制的理解,还为未来的免疫治疗提供了新的方向。通过精准调控PD-1的表达,我们有望开发出更为安全有效的治疗策略,以应对癌症和慢性病毒感染的挑战。随着研究的深入,我们期待能够看到更多基于这一机制的临床应用,为患者带来新的希望。